被动式电子标签用于花鼠种群动态研究的可行性
2013-12-21马建章
杨 慧,马建章,戎 可
(东北林业大学野生动物资源学院,哈尔滨 150040)
在开展动物种群生态学、行为生态学研究时常常需要对动物进行个体标记[1-7]。传统标记方法以体表标记为主,在小型啮齿动物研究中以切趾法、染毛法和耳标法最为常用[8-9]。这些方法存在着可能改变被标记动物的生理状态和行为表现、难于对大群体进行个体识别、标记物易脱落等缺点。
被动式电子标签(PIT)既可以用作体外标记,也可以用作体内标记,在动物园、养殖业和动物贸易中被广泛应用[10]。自1983年PIT标签首次应用于测量鱼类活动距离[10]以来,它的应用范围逐步扩大到无脊椎动物、两栖类、爬行类、鸟类及哺乳动物[11-15]。目前国内PIT标签的应用还仅限于以水生动物为主的有限的几类物种的研究活动中[16-19]。
尝试在花鼠种群生态研究中使用PIT标签,本文就此种标签在小型哺乳动物中的使用方法和可行性报道如下。
1 研究方法
1.1 研究地概况
野外调查在黑龙江省凉水国家级自然保护区进行。该保护区位于我国小兴安岭山脉东南段达里带岭支脉的东坡,地理坐标为东经 128°47'8″—128°57'19″,北纬 47°6'49″— 47°16'10″。保护区全境均为山地,最高海拔 707.3 m,最低海拔为 280.0 m。
保护区地处中纬度大陆东岸,属温带大陆性夏雨季风气候。年平均气温-0.3℃。年平均相对湿度78%左右,年降水量676.0 mm,年蒸发量805.4 mm,河流冰冻期长达6个月。
保护区地带性植被是以红松占优势的针阔混交林,基本分为山地和谷地植被两大类,山地植被为阔叶红松林,谷地植被为云、冷杉林,毛赤杨林及河岸柳丛。20世纪前半叶对红松的采伐,使原始阔叶红松林被处于不同演替阶段的次生林、人工林和空地分割成大小不一的斑块。野外工作地点在保护区的19林班,其植被组成在凉水自然保护区具有代表性和典型性。
花鼠是松鼠科(Sciuridae)花鼠属(Eutamias)的小型哺乳动物,体重73—104 g,体长115—150 mm,广泛分布于我国北方地区,也是小兴安岭针阔混交林下重要的啮齿动物种类,参与红松(Pinus koraiensis)、平榛(Corylus heterophylla)、毛榛(Corylus mandshurica)和蒙古栎(Quercus mongolica)等种子的分散贮藏[20]。在凉水自然保护区,花鼠秋季在越冬洞穴中集中贮藏大量红松松籽[21]。对花鼠种群动态的研究可以为天然林的保护管理提供依据。
1.2 研究样地的设置
在保护区19林班的红松林内设置200 m×400 m面积为8 hm2的长方形调查样地。在样地中设置了32个25 m×25 m的固定样方,排列成南北向8行东西向4列,相邻样方中心间距50 m。设置固定样方的目的是为了收集生境数据。
1.3 花鼠标记方法
1.3.1 花鼠的捕捉
为捕捉花鼠,在每个固定样方中放置4个捕鼠笼,鼠笼分别放置在与每个样方中心相距10 m的东、西、南、北4个方向的固定位置上。鼠笼放置在固定位置上的目的是为了调查花鼠个体的活动范围。鼠笼大小为10 cm×10 cm×25 cm,使用本地采摘的红松松塔作为捕鼠诱饵。
花鼠种群调查分别在2011年秋季和2012年春季进行,共进行了5次,每次调查为期7 d。秋季调查时间分别为2011年10月3日—10日、10月21日—10月28日,计2次(分别记为A1,A2)。春季调查时间分别为2012年4月15日—4月22日、5月4日—5月11日和5月31日—6月6日,计3次(分别记为S1,S2,S3)。
调查期间,每天8:00打开全部鼠笼笼门。根据对花鼠日活动节律的观察[22],在每天10:00和14:00分别检查全部鼠笼,下午检查结束后关闭笼门,避免花鼠或其他动物在非调查时段被误捕。
捕捉到的花鼠转移至不透光布袋进行物理保定后进行标记并测量各项体征数据。
1.3.2 标记方法
PIT标签是一种电子标签,不携带电源,可在专用阅读器激发下传回储存的信息。标签可以通过注射或简易手术放置到动物的皮下或体内,其表层涂有防移动涂层,具有不易丢失的特点。本研究采用广州市洪腾条码技术有限公司生产的PIT标签,截面尺寸2 mm×8 mm,平均质量0.09 g,外层为生物兼容的玻璃材质,内部由三部分构成。第一部分是一个微芯片,包含了存贮唯一编码的存贮器和发送编码所需的电子电路,第二部分是接收阅读器发来的信号并且把编码发送回阅读器的天线线圈,第三部分是一个用来调谐的电容(图1)。
每个PIT标签都存贮有国际唯一编码,可以用来进行个体识别。动物标签厂商通过向国际动物编码委员会(International Committee for Animal Recording,ICAR)申请验证,获得ICAR给予的由“国家码+企业码”组成的5位数的唯一企业号码。企业在这个企业号码后为每个标签建立唯一编码,保证每个动物标签编码的唯一性。
标记花鼠时,用浓度75%的医用酒精消毒花鼠皮肤和PIT标签,使用消过毒的专用注射器将PIT标签平行于体表注射到花鼠皮下。经验表明,花鼠耳后皮肤松弛,皮下对标签的容留性好且注射不易出血,比其他部位更适合进行注射。注射后,用医用酒精对注射口周围皮肤进行消毒处理,避免伤口感染。
注射标签完成后记录PIT标签编码,观察和测量花鼠的性别、体重、年龄组、体长、尾长、后足长、耳长等数据。体重测量使用精度0.01 g的电子秤,长度测量使用精度为1 mm的钢卷尺。标记和测量工作结束后,用手指触检确定标签是否成功注入皮下,再用阅读器扫描确认标签编码后原地释放花鼠。
成功标记第1只花鼠后,所有捕捉到的花鼠都先用阅读器扫描确定是否携带有PIT标签,携带有PIT标签的即为重捕个体。若为重捕个体,称重后只记录重捕日期、时间、捕捉位置及标签编码后即可释放。
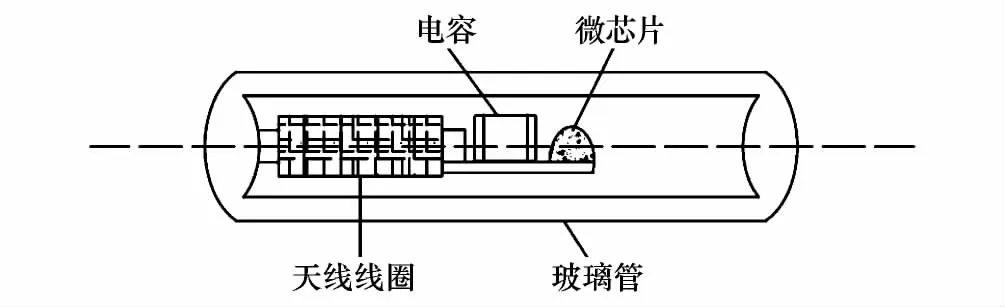
图1 PIT标签(passive integrated transponder)结构示意图Fig.1 Schematic illustration of a PIT (passive integrated transponder)tag
1.4 注射PIT标签对花鼠个体影响的判断方法
采用两项检查来判断PIT标签是否对花鼠个体有影响,其一是检查注射口的变化,其二是注射标签前后花鼠的体重变化。
1.4.1 注射口状况检查内容
检查内容包括观察重捕个体的注射口愈合情况、触检PIT标签附近组织是否有异变(如肿块等)、标签是否仍处于注射位置附近等。
1.4.2 体重变化
如果重捕个体出现明显体重下降,则PIT标签的注射对其生理可能有负面影响,反之,则认为PIT标签对花鼠没有明显影响。
为了考察注射PIT标签对花鼠的短期影响,把2011年秋季初捕且在同年秋季重捕(同季重捕)的花鼠个体的体重变化用成对数据t检验进行比较。为了考察注射PIT标签对花鼠的远期影响,把2011年秋季初捕且在2012年春季重捕(跨季重捕)的花鼠个体的体重变化用成对数据t检验进行比较。作为对照,把2011年秋季新捕捉个体和第2年春季新捕捉个体体重用单因素方差分析(One-way ANOVA)进行比较,以考察花鼠种群越冬前后体重的季节变化。
1.5 应用实例:基于PIT标签收集花鼠生态学数据
PIT标签在生态学研究中既可作为普通标签,又可起到个体识别的作用。本文以种群动态研究和活动距离研究为例,分别说明PIT标签在花鼠生态学研究中的应用。
(1)实例一:花鼠种群动态研究
将PIT标签视作普通标记,采用标志重捕法进行花鼠种群动态的研究。把收集到的捕捉及重捕数据采用Jolly法[23]估算种群密度,获取种群动态数据。将5次调查分别视作一个种群估算单元,分别计算种群密度。在每个估算单元里,以每个调查日为时间单位,第1天捕捉到的花鼠无论是否带有标签都可视作初捕。由于通过PIT标签能够识别个体,所以第2天以后可以根据标签编码判断是否在同一单元里被重捕,从而可以统计每日捕捉的花鼠数量、释放的花鼠数量、捕捉的花鼠中已标记和未标记的数量,以计算种群数量。
(2)实例二:花鼠种群的空间分布
应用标志重捕法的前提假设是种群在生境中均匀或随机分布。采用方差/均值法[24]考察花鼠在样地内的分布情况。该方法建立在Poisson分布的预期假设之上。如果Poisson分布的总体方差V和均值m相等,即如果V/m=1,则种群呈随机分布。如果V/m>l,则呈聚集分布。当V/m<1时,则呈均匀分布。V和m计算方法如下:

式中,N为样方总体数;Xi为每样方中的个体数,来自1.5.1的计算结果。为检验实测样本是否接受预期假设,需要以为标准差进行t检验。t值的计算方法如下:

(3)实例三:花鼠的活动范围
由于重捕后的花鼠可以根据PIT标签编号识别个体,根据捕捉花鼠的鼠笼位置,利用几何方法可以计算出花鼠的活动距离,从而确定花鼠的活动范围。以同一花鼠个体两个相距最远的鼠笼之间的距离作为花鼠最大活动距离的估计值。采用单因素方差分析比较花鼠在不同季节活动距离是否存在差异。
为了考察花鼠的活动倾向,分别计算2011年秋季和2012年春季花鼠在原地重捕的比例。原地重捕指花鼠在初捕样地中又被重捕。
所有的计算结果均用mean±SE表示。统计检验的显著水平设定为0.05。
2 结果
2.1 捕捉及注射PIT标签对花鼠个体的影响
观察表明,被捕的花鼠在鼠笼中并未出现激烈的挣脱行为,笼中作为诱饵的松塔也常常被啃食干净。有人靠近时花鼠会在笼中乱窜,但用布袋进行物理保定后挣扎明显缓和。
注射标签时只要保证花鼠眼睛不露出,很容易控制花鼠活动。注射器穿透皮肤的瞬间未见花鼠发出叫声或因不适而挣扎。整个注射过程花鼠无明显可见的应激反应,说明注射PIT标签对动物的刺激不大。
5次调查共捕捉花鼠140只,其中雄性59只,雌性80只,数据不全1只,性比(♀∶♂)为1.36∶1。其中有59.29%的个体被重捕至少一次。
2011年秋季标记的72只花鼠中有39只在第2年春季被重捕,最大重捕次数为8次(表1)。第2年春季重捕的花鼠依然很活跃,说明注射PIT标签的花鼠能够保持活动并长期生存。所有重捕的花鼠注射口愈合良好,未见感染,触检到的标签附近无组织异变状况且标签仍处于注射部位。

表1 秋季标记个体在第二年春季被重捕的次数Table 1 Recapture times of the autumn marked chipmunks in next spring
注射PIT标签15 d后的重捕个体体重上升(成对数据t检验,t=4.62,d f=12,P=0.0006)。注射PIT标签5个月后(春季)的重捕个体体重上升(成对数据t检验,t=2.52,d f=48,P=0.0151)。与此同时相对于第一年秋季,整个花鼠种群个体体重在第2年春季没有显著变化(ANOVA,F1,116=2.79,P=0.10(图2)。据此可以认为注射PIT标签对花鼠的生理无明显的负面影响。
2.2 应用实例的研究结果
2.2.1 花鼠种群动态
以每个固定样方为基础估算花鼠种群密度,结果显示红松林内2011年秋季平均种群密度(8.91±2.76)只/hm2,2012年春季平均种群密度(6.14± 1.29)只/hm2。5 次调查结果间没有显著差异(ANOVA,F4,7=0.40,P=0.80),秋季与春季的种群密度没有显著差异(ANOVA,F1,10=1.01,P=0.34)(图 3)。
2.2.2 花鼠种群的空间分布
统计结果表明(表2),花鼠种群春季在红松林内为均匀分布,秋季为聚集分布。
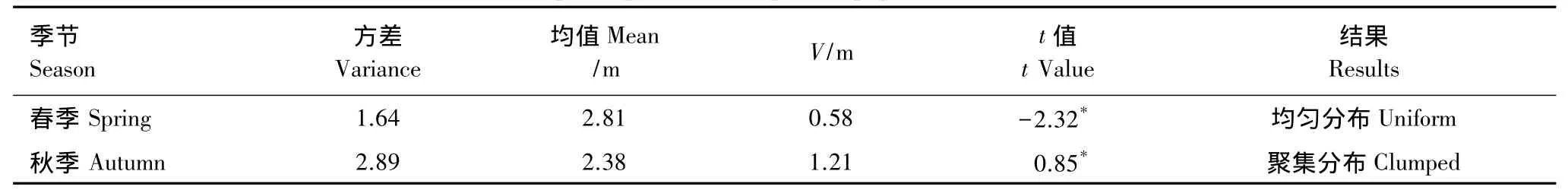
表2 不同季节花鼠种群的空间分布Table 2 The special pattern of chipmunk population in different seasons
2.2.3 花鼠的活动范围
秋季最大活动距离(65±8)m(n=31),春季最大活动距离(67±4)m(n=55),秋季和春季的最大活动距离没有显著差异(ANOVA,F1,48=0.07,P=0.80)。
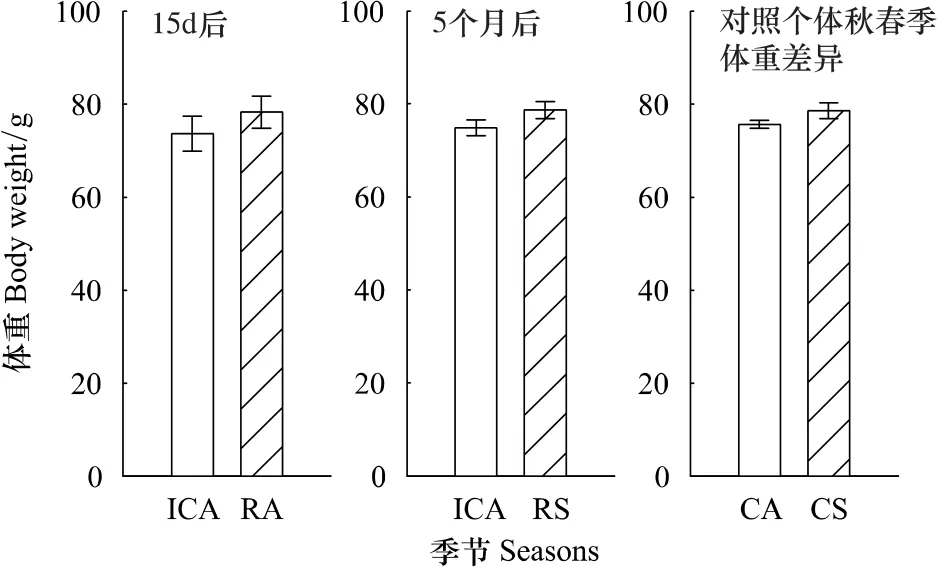
图2 注射PIT标签后花鼠体重的变化Fig.2 The weight change of chipmunks after PIT tag injection

图3 红松林内花鼠种群密度Fig.3 Population density of chipmunks in Korean pine forest
花鼠秋季的原地重捕率为61.29%,春季原地重捕比例占30.91%(图4),说明花鼠秋季更倾向于留在原地,而春季则更倾向于向四周活动。这一结果与花鼠种群空间分布的研究结果相一致(表2)。
3 讨论
3.1 对传统动物标记方法的评价
标记动物的方法大致可以分为永久性标记、半永久性标记和临时性标记3种类型[25]。切趾、剪耳、烙印、纹身法属于永久性标记方法。耳标、耳环、颈圈、脚环是半永久性标记。剪毛和染色法是临时性标记。
在永久性标记方法中,切趾法操作简单,在啮齿动物研究中被普遍接纳和使用,但会对动物肢体造成永久伤害,可能影响被标记个体的行为甚至生存,并且可能会与动物自身受到的伤害相混淆[8]。烙印法主要应用于体毛少而短的大型动物,而且由于热烙印处皮肤易出现创伤感染,这种方法也不适用于小型哺乳动物。纹身只能选取无毛或少毛部位进行而无法广泛应用,并且纹身会逐渐淡化,不能起到长期标记的作用[10,25]。
在半永久性的动物标记方法中,以耳标法和耳环法应用较早,类型也较多,形成的伤口较易于愈合。颈圈是佩戴在动物颈部的标记,主要缺点在于:大小不易控制,太大易松动,太小会影响动物活动;颈圈的颜色及附属物也可能对被标记动物形成影响(如吸引捕食者等)。无线电颈圈可以识别个体并进行远程跟踪,但因为携带电池而显得笨重。电池没电后或调查结束时要进行的回收过程也容易加大对标记个体的损伤。脚环多用于鸟类环志,可用于调查迁徙路线和时间等难以连续跟踪监测获得的数据,但脚环数据记载量较小,磨损也可能造成数据缺失。这些半永久的标记都是体外标记,易丢失而导致标记失败率高,因而也并不完全适用于小型的哺乳动物。
剪毛法简便易行,但难以做到个体识别。经染色法标记的动物易于识别,但白天不利于动物隐蔽,荧光标记又局限于针对夜行性动物的研究。这两种临时方法都需要在前期进行预实验以掌握标记失效时间,否则会严重影响研究结果。
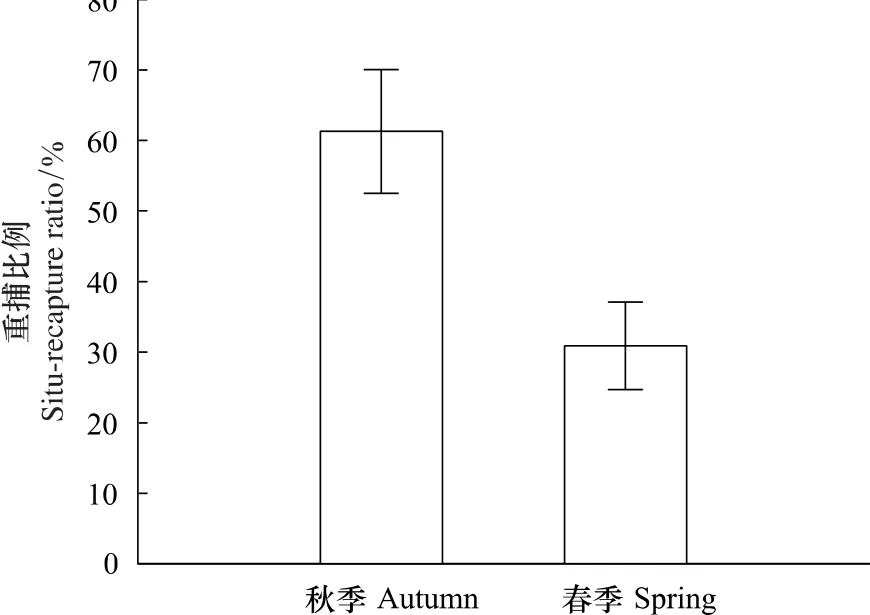
图4 花鼠原地重捕的比例Fig.4 The percentage of situ-recapture
3.2 注射PIT标签对花鼠的影响
研究结果显示(图2),注射PIT标签15 d后重捕的花鼠个体体重上升,表明注射PIT标签不影响花鼠短期存活。注射PIT标签5个月后重捕的野外花鼠个体体重也上升,表明注射PIT标签也不影响花鼠越冬,对花鼠长期的行为及生理也无显著负面影响。这一结果表明,PIT标签对于标记花鼠是安全的。
重捕个体体重上升的原因,推测是因为被捕的花鼠经常会将鼠笼中的松塔啃食殆尽,而且被捕花鼠对鼠笼位置形成了记忆,能够主动搜寻鼠笼而被反复重捕,如此导致重捕个体体重上升。
目前的研究已证明PIT标签的注射对鱼类、鸟类及鼬科动物无生理影响[26-28]。Rao和Edmondson进行的小鼠组织反应测试也证明PIT标签具有很好的组织相容性[29]。在对其它小型哺乳动物的研究中也未见死亡、受伤和感染的报道[30-34]。因此,将PIT标签应用于标记小型哺乳动物是可行的。
3.3 对实例研究的分析
标志重捕法的前提是种群在生境中均匀或随机分布,但花鼠在样地中的分布不满足这个前提假设(表2)。PIT标签可以对捕捉到的花鼠进行个体识别,可以把样地分为面积相等的小区域分别计算种群密度,用得出的结果对以整个样地数据计算得出的种群密度结果进行校正。这种基于个体识别的种群密度计算结果将能够更准确地反映动物种群密度的实际情况。
秋季和春季花鼠最大活动距离无显著差别,说明花鼠在两个季节的活动范围大致相当。但最大活动距离只反映了花鼠活动的最大范围,而原地重捕率则反映了花鼠的活动倾向。秋季原地重捕率超过半数,春季却只占约三成(图4),表明花鼠在秋季更倾向于留在原地,而在春季更倾向于向样地外活动。推测食物资源的变化是出现这种情况的原因。秋季红松松籽成熟,其它食物也较为丰富,因此花鼠不必长距离觅食。但春季花鼠洞穴中贮藏的食物耗尽,环境中食物可得性偏低,营养含量也不高,因此花鼠要在更大范围内觅食,需要更向外扩大活动范围。
由于花鼠实际的最远活动位置可能位于两个相邻的鼠笼之间,因此对花鼠最大活动距离的估计是保守结果,这可通过加密鼠笼的方法改善。是否需要加密鼠笼取决于研究所需达到的精度。
研究实例中列举的数据分析方法都依赖于对花鼠个体的识别,剪毛、染毛、剪趾等传统标记方法因为无法进行个体识别而无法满足类似研究的要求。而可以进行个体识别的耳标法等又因体外标记容易脱落或磨损,从而影响研究结果的准确性。
综上所述,PIT标记技术相对于传统标记技术具有很多优越性。可用作体内标记从而减少标记物丢失是这种标记方法最突出的优点。此外,应用PIT标签还具有标记信息丰富持久可靠、识别迅速、对动物损伤小、可循环使用等优点[10]。其全球唯一的编码使基于个体识别的研究成为可能,也可以允许不同研究组在同一地域同时开展研究而不致相互混淆,提高研究效率与准确性。
3.4 应用PIT标记技术应注意的问题
应用PIT标记方法需要在动物皮下注射PIT标签,这意味着需要近距离接触被标记动物。一方面,注射过程中要对动物皮肤、标签、针头进行严格的消毒。另一方面,在对野生动物进行标记时,标记人员也需要加强个人防护。
PIT标签体积非常小又是体内标记,在野外工作条件下容易出现标记失败的情况,比如可能因为标签意外掉落而造成空注射等。因此注射标签后需要触检并用阅读器扫描以确定标记是否成功。注射部位的选择也很关键,在不影响被标记个体生理及行为的前提下,宜选择皮肤松弛且毛被稀薄的部位进行注射。未注射的标签应小心保管防止丢失。
PIT标签阅读器耗电量比较大,野外研究中应备足电池。现有阅读器的读写距离通常小于10 cm,并且无法隔金属笼进行识别,还需要配以完善的动物保定方法,因此这种方法不适于需要远距离个体识别的研究。
3.5 PIT标记技术的应用前景
研究实例显示PIT标签可以辅助收集种群动态和个体活动的数据。事实上,利用PIT标签可以辅助收集个体水平、种群水平及群落水平的各种数据,个体水平比如生长率、活动范围、存活和寿命等,种群水平比如性比、年龄结构、生命表、社会关系和行为谱等,群落水平比如食物网的研究等[10]。不同尺度的研究、不同的实验动物对标签有着不同的要求,PIT标签的多种规格尺寸可以满足这些需求,注射位置也可因不同目标动物的实际情况加以调整。
PIT标记技术还可以用于增强其它研究方法的准确性和可靠性。Fokidis在对5种啮齿动物的研究中比较了耳标和PIT标签的失败率并建议两种方法结合使用来增加标记的成功率[35]。将PIT标记技术与自动监控系统相结合,可避免重捕并实现全自动收集及传导数据,进行节律、行为、取食、跑道(runway)利用等研究[36-37]。开发PIT标签的扩展应用可以大幅度提高研究工作的效率,因而在小型哺乳动物生态学研究中具有广阔的前景。
PIT标签目前还存在着研究成本较高、读取距离较近的问题,随着电子技术的不断发展和制造成本的下降,上述困难终将被克服,PIT标记技术也将被广泛应用于基于个体识别的野生动物科研、立法、保护和管理各个方面[10]。
[1]Zeng Z Y,Ding W J,Yang Y M,Luo M S,Liang JS,Xie R K,Dai Y G,Song Z M.Population ecology of Rattus nitidus in the western Sichuan plain I.Population dynamics and body size.Acta Theriologica Sinica,1996,16(3):202-210.
[2]Wan X R,Zhang X J,Liu W,Wang G H,Wang M J,Zhong W Q.Social hierarchy and its seasonal changes of marked Lasiopodomys brandtii population.Chinese Journal of Ecology,2007,26(3):359-362.
[3]Liu W,Wan X R,Wang G H,Liu W D,Zhong W Q.Reproductive pattern of cohort and its adaptation in life history of Mongolian gerbils(Meriones unguiculatus).Acta Theriologica Sinica,2004,24(3):229-234.
[4]Shi H Y,Liu H,Wu Y,Hu JC.Postnatal growth and age estimation in villus noctule(Nyctalus velutinus).Acta Theriologica Sinica,2008,28(1):42-48.
[5]Xu H G,Yang F X,Zeng Z Y,Song Z M.A study of the identifying age of a species of desert lizard(Phrynocephalus przewalskii)in Tenggeli desert of Northwest China.Acta Zoologica Sinica,1993,39(2):146-153.
[6]Yang S J,Zhuge Y.Home range of Apodemus agrarius and Suncus murinus and their interspecific relationship on farmland.Acta Theriologica Sinica,1989,9(3):186-194.
[7]Liu W,Zhong W Q,Wan X R,Wang GH,Jiang Y Q,Liu WD.The behavioral characteristics of Mongolian gerbils,Merionesunguiculatus,and the ecological strategies of controlling during autumn harvest.Acta Theriologica Sinica,2001,21(2):107-115.
[8]Wan X R,Zhong W Q.A revised convenient toe-clipping system for rodent species.Chinese Journal of Zoology,2000,35(4):22-24.
[9]Flowerdew J.Ecological methods.Mammal Review,1976,6(4):123-159.
[10]Gibbons J W,Andrews K M.Pit tagging:simple technology at its best.BioScience,2004,54(5):447-454.
[11]Lauzon-Guay J S,Scheibling R E.Evaluation of passive integrated transponder(PIT)tags in studies of sea urchins:caution advised.Aquatic Biology,2008,2(2):105-112.
[12]Cucherousset J,Marty P,Pelozuelo L,Roussel JM.Portable pit detector as a new tool for non-disruptively locating individually tagged amphibians in the field:a case study with pyrenean brook salamanders(Calotriton asper).Wildlife Research,2009,35(8):780-787.
[13]Coates P S,Wylie G D,Halstead B J,Casazza M L.Using time-dependent models to investigate body condition and growth rate of the giant gartersnake.Journal of Zoology,2009,279(3):285-293.
[14]Low M,Eason D,McInnes K.Evaluation of passive integrated transponders for identification of kakapo,Strigops habroptilus.Emu,2005,105(1):33-38.
[15]Garroway C J,Broders H G.Nonrandom association patterns at northern long-eared bat maternity roosts.Canadian Journal of Zoology,2007,85(9):956-964.
[16]Zeng X Q,Zheng Y D,You K.A review of the tag methods used in the study of sea urchins.Periodical of Ocean University of China,2007,37(5):717-722.
[17]Gu W,Ji F,Hu G,Xu G F,Zhang Y Q,Wang B Q.Influence of passive integrated transponder(PIT)tags implantation on the survival and growth of yearling rainbow trout(Oncorhyncus mykiss).Chinese Journal Fisheries,2010,23(4):37-40.
[18]Wang Q J,Zhao H,Kouba A,Willard S T,Zhang H X,Chen J A.Study of the PIT marker technology application in young giant salamander(Andrias davidianus).Journal of Hydroecology,2011,32(2):146-148.
[19]Ma C Y.Application of electronic label technique in livestock husbandry animal management.Journal of Anhui Agricultural Sciences,2007,35(5):1382-1383.
[20]Thorington R W,Koprowski J L,Steele M A,Whatton J F.Squirrels of the World.Baltimore:Johns Hopkins University Press,2012:338-339.
[21]Liu B W,Li C R,Ni N M.Coniferous-seeds eated by birds and mammals in the Xiaoxing'an mountains.Forestry Science and Technology,1999,24(5):26-30.
[22]Su H J,Ma J Z,Zong C.Behavior comparison between four diurnal animals on seed consumption and hoarding of korean pine.Chinese Journal of Zoology,2007,42(2):10-16.
[23]Jolly G M.Explicit estimates from capture-recapture data with both death and immigration-stochastic model.Biometrika,1965,52(1/2):225-247.
[24]Greig-Smith P.The use of random and contiguous quadrats in the study of the structure of plant communities.Annals of Botany,1952,16(2):293-316.
[25]Xu H F,Zhang E D.Wildlife Conservation and Management Principles and Techniques.Shanghai:East China Normal University Press,1998:95-98.
[26]Newby N C,Binder T R,Stevens E D.Passive integrated transponder(PIT)tagging did not negatively affect the short-term feeding behavior or swimming performance of juvenile rainbow trout.Transactions of the American Fisheries Society,2007,136(2):341-345.
[27]Schroeder J,Cleasby I R,Nakagawa S,Ockendon N,Burke T.No evidence for adverse effects on fitness of fitting passive integrated transponders(PITs)in wild house sparrows Passer domesticus.Journal of Avian Biology,2011,42(3):271-275.
[28]Fagerstone K A,Johns B E.Transponders as permanent identification markers for domestic ferrets,black-footed ferrets,and other wildlife.The Journal of Wildlife Management,1987,51(2):294-297.
[29]Rao G N,Edmondson J.Tissue reaction to an implantable identification device in mice.Toxicologic Pathology,1990,18(3):412-416.
[30]Marmet J,Pisanu B,Chapuis J L.Home range,range overlap,and site fidelity of introduced Siberian chipmunks in a suburban french forest.European Journal of Wildlife Research,2009,55(5):497-504.
[31]Marmet J,Pisanu B,Chapuis JL.Natal dispersal of introduced Siberian chipmunks,Tamias sibiricus,in a suburban forest.Journal of Ethology,2011,29(1):23-29.
[32]Schooley R L,Van Horne B,Burnham K P.Passive integrated transponders for marking free-ranging Townsend's ground squirrels.Journal of Mammalogy,1993,74(2):480-484.
[33]Munro D,Thomas D W,Humphries M M.Extreme suppression of aboveground activity by a food-storing hibernator,the eastern chipmunk(Tamias striatus).Canadian Journal of Zoology,2008,86(5):364-370.
[34]Patriquin K J,Leonard M L,Broders H G,Garroway C J.Do social networks of female northern long-eared bats vary with reproductive period and age?.Behavioral Ecology and Sociobiology,2010,64(6):899-913.
[35]Fokidis H B,Robertson C,Risch T S.Keeping tabs:are redundant marking systems needed for rodents?Wildlife Society Bulletin,2006,34(3):764-771.
[36]Harper SJ,Batzli G O.Monitoring use of runways by voles with passive integrated transponders.Journal of Mammalogy,1996,77(2):364-369.
[37]Kunz T H.Seeing in the dark:recent technological advances for the study of free-ranging bats.Bat Research News,2001,42(3):91-91.
参考文献:
[1]曾宗永,丁维俊,杨跃敏,罗明澍,粱俊书,谢荣凯,戴应贵,宋志明.川西平原大足鼠的种群生态学 Ⅰ.种群动态和个体大小.兽类学报,1996,16(3):202-210.
[2]宛新荣,张新阶,刘伟,王广和,王梦军,钟文勤.布氏田鼠标志种群的社群等级及其季节变化.生态学杂志,2007,26(3):359-362.
[3]刘伟,宛新荣,王广和,刘文东,钟文勤.不同季节长爪沙鼠同生群的繁殖特征及其在生活史对策中的意义.兽类学报,2004,24(3):229-234.
[4]石红艳,刘昊,吴毅,胡锦矗.中华山蝠的生长发育及年龄估算.兽类学报,2008,28(1):42-48.
[5]徐海根,杨凤翔,曾宗永,宋志明.腾格里荒漠沙蜥(Phrynocephalus przewalskii)年龄划分的研究.动物学报,1993,39(2):146-153.
[6]杨士剑,诸葛阳.农田黑线姬鼠与臭鼩的巢区及种间关系的研究.兽类学报,1989,9(3):186-194.
[7]刘伟,钟文勤,宛新荣,王广和,姜雅琴,刘文东.长爪沙鼠在作物秋收期的行为适应特征及其生态治理对策.兽类学报,2001,21(2):107-115.
[8]宛新荣,钟文勤.一种简易的啮齿动物切趾编码方法.动物学杂志,2000,35(4):22-24.
[16]曾晓起,郑友德,尤凯.海胆标志方法的研究进展.中国海洋大学学报:自然科学版,2007,37(5):717-722.
[17]谷伟,纪锋,户国,徐革锋,张永泉,王炳谦.电子芯片标记植入对一龄虹鳟(Oncorhyncusmykiss)生长与存活的影响.水产学杂志,2010,23(4):37-40.
[18]王启军,赵虎,Kouba A,Willard ST,张红星,陈玖安.PIT标记技术在幼鲵标记中的应用研究.水生态学杂志,2011,32(2):146-148.
[19]马存云.电子标签技术在动物管理上的应用.安徽农业科学,2007,35(5):1382-1383.
[21]刘伯文,李传荣,倪乃萌.小兴安岭食针叶树种子的鸟兽.林业科技,1999,24(5):26-30.
[22]粟海军,马建章,宗诚.四种昼行性动物取食和贮藏红松种子的行为比较.动物学杂志,2007,42(2):10-16.
[25]徐宏发,张恩迪.野生动物保护原理及管理技术.上海:华东师范大学出版社,1998:95-98.
