OPRK1基因SNP与梅花鹿昼间行为性状的相关性
2013-12-20吕慎金魏万红
吕慎金,杨 燕,魏万红
(1.临沂大学生命科学学院,临沂 276005;2.扬州大学生物科学与技术学院,扬州 225009;3.临沂市农业科学院,临沂 276012)
随着分子生物学的发展,近年来许多学者将动物的数量性状与基因进行关联性分析,以筛选候选基因[1]。动物的行为也受到基因的控制,将动物行为与基因型进行相关性分析,不但可以了解行为表达的机制,也可以更为深刻的了解如何操作与控制动物行为,以更好的为人类和改善动物福利服务[2],而有关该方面的研究正处于探索之中。李剑虹等曾利用SNP方法对大白、长白和杜洛克猪的Kappa阿片(OPRK1)受体进行分析,结果表明Kappa阿片受体基因SNP对母猪静止站立行为性状存在一定影响[3]。对嗜酒(alcoholpreferring)和厌酒小鼠(alcohol-avoiding)的OPRK1基因多态性分布研究结果表明,在BALB/cJ厌酒小鼠OPRK1启动子区发现突变序列,而另外C57BL/6ByJ和CXBI两种小鼠没有发现多态位点,但其脑中mRNA表达水平不同[4]。
应激行为能引起机体分泌多种内源性阿片肽[5]。目前发现并克隆了3种阿片受体,分别为Kappa受体[6]、Mu 受体[7]和 Delta受体[8]。Kappa阿片受体又称作 OPRK1(Kappa Opoioid Receptor 1)基因,属于 G 蛋白偶联受体家族成员。研究表明OPRK1阿片受体主要分布在与痛觉、情绪、行为等有关的中枢神经系统区域,对动物的神经反应和行为表现有重要影响[9-10]。内源性阿片肽与不同的受体结合,参与表达性格、情绪、种属生存行为等一些基本反应,也对伤害性刺激、应激、奖赏等有不同的反应[7]。梅花鹿(Cervus nippon)属于哺乳纲(Mammalia)、偶蹄目(Artiodactyla)、鹿科(Cervidae)、花鹿属(Cervus)。我国梅花鹿共6个亚种:东北亚种(C.n.hortulorum)、华南亚种(C.n.kopschi)、四川亚种(C.n.sinchuanicus)、台湾亚种(C.n.taiouanus)、山西亚种(C.n.grassianus)和华北亚种(C.n.mandarinus)[11]。目前,野生梅花鹿仅存3个亚种,都被列为国家Ⅰ级保护动物[12]。人工饲养梅花鹿品系基本是在东北亚种的基础上选育而成[13]。近年来,国内对圈养梅花鹿报道主要集中在饲养繁殖、疾病防治、鹿茸生产等方面,对梅花鹿的行为学、遗传学研究也有报道[14-16],而OPRK1基因多态性和梅花鹿昼间行为性状是否相关尚无报道。因此,本研究以PCR-SSCP技术为手段,分析了OPRK1基因在梅花鹿中的单核苷酸多态性,验证基因多态性和动物行为性状是否相关,为进一步研究候选基因在动物行为遗传特性方面提供理论基础,也为与行为性状相关基因的筛选提供途径和方法。
1 材料与方法
1.1 研究材料
本研究梅花鹿来自扬州市动物园和扬州市平山堂养殖场两地((119°26'E,32°24'N))。两地均处于亚热带南部季风气候区,四季分明,年平均气温15.4℃,最冷月1月的平均气温1.8℃,最热月7月的平均气温为27.5℃。日照2 113 h,无霜期238 d,年降水量1 020 mm。平山堂养殖场位于扬州市瘦西湖景区,该场占地面积约1 500 m2,共4个半敞开式圈舍,每个圈舍面积20 m×10 m,共观测记录25只成年梅花鹿(♂15只,♀10只)。江苏省扬州市动物园位于扬州市郊区湾头镇,该园占地面积约52.6 hm2,梅花鹿个体散放公园食草区内(100 m×50 m),共观测记录23只(♂13只,♀10只)。两地梅花鹿饲喂时间均为每天8:00和15:00左右各1次。食物主要为白三叶(Trifolium repens)、紫花苜蓿(Medicago sativa)和其它青草,补充精料为配合饲料,饲料主成分为玉米、豆粕、麸皮、食盐及多种维生素、矿物质、微量元素等。
1.2 研究方法
1.2.1 行为性状观察
首先对两地梅花鹿个体进行辨识,利用耳标、角的形状、身体上的斑痕及个体大小等体型外貌特征区分梅花鹿个体。
在正式观察之前进行为期7 d的预观察,确定动物的行为格局和记录方法,并对观察者进行培训。正式观察时间为2006年7—12月及2007年2—6月,每周观察4 d。采用目标动物取样法每天8:30—16:30在距离动物5—15 m处对动物的行为进行观察。观察时1人观察口述,1人记录,每2 h轮换1次。根据梅花鹿生理特点以及前人研究结果[17],将梅花鹿行为参数定义如下:
取食 梅花鹿的上下唇协同动作,对青草、饲料等食物进行切割、咀嚼、吞咽的过程,若梅花鹿在移动过程中有上述动作发生,仍将其视为取食行为;反刍 梅花鹿在非睡眠时,头部高于背中线,对食物进行逆呕、咀嚼等过程,反刍分站立反刍和卧倒反刍;卧息 梅花鹿的卧息包括休息、浅睡和睡眠,卧下时,前肢先跪下,后肢下蹲,接着腹部着地,最后臀部触地,卧姿分为左侧卧和右侧卧;
观望 梅花鹿头昂起,耳朵朝有异响或异样方向转动,四肢静止不动,情况危急时则尾巴翘起,用力踏地;移动 梅花鹿从一地点到另外一地点的动作,移动包括走动和跑动,以走动为主;
修饰 梅花鹿为求得舒适而进行的自洁行为及排除蚊蝇干扰或对身体某些部位进行舔舐、轻咬、蹭墙、搔扒等行为;
其它 梅花鹿的饮水、排尿、排粪、嬉戏、鸣叫等。观测过程中,如果由于天气等原因不能观测,则在1周内补充观测。
由于动物园梅花鹿受游客影响较大,因此周末以及国家法定节日期间单独观测统计[18]。观测结束后,对行为记录数据进行整理,录入计算机进行分析。
1.2.2 血样采集
梅花鹿麻醉后颈静脉采血5—10 mL,置于15 mL指型管中(内置1—2.5 mL裂解液),充分摇动至血细胞完全破裂,溶液呈粘稠状为止。两地共采集样本48份,其中,扬州市平山堂养殖场共采集血样25份(♂15只,♀10只);动物园采集样本23份(♂13只,♀10只),并做好详细的个体信息登记。
1.2.3 引物信息
应用Primer 5.0软件,根据GenBank中收录有关OPRK1基因序列NC_007312、NW_00149302设计9对引物(表1)。各引物均由上海生工科技有限公司合成。引物稀释过程分2步进行:首先稀释为正常扩增的10倍浓度,-20℃长期保存;使用时再稀释10倍,作为正常使用的引物浓度。
1.2.4 最佳PCR扩增体系
PCR 反应体系为 20 μL,其中 0.20 μL(5U/μL)Taq 酶,2.20 μL 10×buffer(含 Mg2+),1.20 μL 浓度为1 μmol/L引物,1.20 μL浓度为2.0 mmol/L dNTPs,1.40 μL浓度为50 ng/L基因组DNA,最后用去离子灭菌水补齐至20 μL体系。PCR反应程序如下:94℃预变性5 min,然后94℃变性45 s,54—56℃退火40 s,72℃延伸30 s,共33个循环。72℃延伸5 min,产物4℃保存。

表1 梅花鹿OPRK1基因引物信息Table 1 Information of primers for sika deer with OPRK1 gene
1.3 分析方法
建立模型:
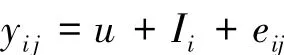
式中,yij为行为性状观测值;u为群体均值;Ii为第i基因型效应值;eij为随机误差。应用SPSS软件一般线性模型,对不同基因型与行为性状的关系进行比较分析。所有动物行为性状以8 h统计记录,以行为持续时间(M±S.E.)为观测变量,以不同基因型作为另一变量,输入SPSS软件分析系统,即可进行统计分析。
2 结果与分析
2.1 基因组DNA提取及PCR扩增产物检测
从梅花鹿血样中提取的基因组DNA溶于300 μL TE中,室温溶解24 h后用1.0%琼脂糖凝胶电泳检测。结果表明提取的基因组没有降解,条带较均匀一致,所含DNA符合生物学试验要求(图1)。在设计的9对引物中,只有位于第二内含子引物P-5和第三外显子的P-9引物获得扩增产物(图2)。对引物P-5进行SSCP分析,结果表现3种基因型,分别命名为EE、EF、FF(图3)。对引物P-9进行SSCP分析,结果表现3种基因型,分别命名为 GG、GH、HH(图4)。

图1 梅花鹿基因组DNAFig.1 The genome DNA of sika deer

图2 引物P-9 PCR产物检测结果Fig.2 Result of agrose gel electrophoresis for PCR product of primer P-9

图3 引物P-5多态性检测结果Fig.3 Result of polymorphism amplified by primer P-5

图4 引物P-9多态性检测结果Fig.4 Result of polymorphism amplified by primer P-9
2.2 OPRK1基因测序结果及同源性分析
将引物P-5所得EE、FF 2个基因型,引物P-9所得GG、HH两个基因型的克隆产物直接进行正反测序。测序结果表明,P-5引物获得序列与牛同源性达到97%,P-9引物与牛的同源性达到99%,因此可确定所获基因序列为梅花鹿序列。通过测序图比对发现引物P-5扩增片段在DNA序列72bp处发生G→A突变(图5),引物P-9扩增产物在132bp处发生T→A的突变(图6)。但氨基酸比较表明这两处突变均为沉默突变。

图5 OPRK1基因引物P-5扩增片段2个基因型序列比对Fig.5 The sequence alignment of two gene types amplified by primer P-5

图6 OPRK1基因引物P-9扩增片段的基因型序列比对Fig.6 The sequence alignment of gene types amplified by primer P-9
2.3 OPRK1基因的遗传学分析
在梅花鹿两个群体中,对OPRK1引物P-5和P-9的基因频率和基因型频率进行检测分析(表2),在OPRK1基因引物P-5扩增结果中检测3种基因型,其中EE型基因型频率最高,而EF和FF型基因型频率相等,适合性χ2检验结果表明梅花鹿在该位点处于Hardy-Weinberg不平衡状态(P<0.01)。在OPRK1基因引物P-9扩增结果中也检测到3种基因型,其中纯合子HH的基因型频率最高,GG基因型频率最低,适合性χ2检验结果表明,梅花鹿在该位点也处于Hardy-Weinberg不平衡状态(P<0.01)。

表2 OPRK1基因各引物等位基因频率和基因型频率及Hardy-Weinberg平衡检验Table 2 Alleles and genotype frequency and equilibrium test of Hardy-Weinberg for OPRK1 gene
2.4 OPRK1基因多态性与行为性状的关系
对OPRK1基因SNP位点基因型与梅花鹿各行为性状进行最小二乘分析,P-5引物基因型对梅花鹿修饰行为有极显著影响(P<0.01),对其余各行为无显著影响。引物P-9各基因型对观望行为有极显著影响(P<0.01),对卧息和修饰行为有显著影响(P<0.05),对其余行为性状均无显著影响。
进一步对不同基因型各行为性状的最小二乘均值进行多重比较(表3)。引物P-5各基因型间修饰行为EE型、FF型和EF型之间两两差异显著(P<0.05),其中FF型行为持续时间最长为15 min左右,EE型行为持续时间最短为3 min左右。在所观测的7种行为性状中,其它行为EE型和FF型差异显著(P<0.05);而另外5种行为性状在各个基因型中没有检测到显著差异。引物P-9各基因型间卧息行为GG型比GH型个体行为持续时间平均高近90 min,且两者之间差异显著;观望行为GG型、HH型和GH型3种基因型个体的行为持续时间依次升高,且GH型比GG型高4倍,3种基因型之间两两差异显著(P<0.05),但GH和GG两种基因型之间存在极显著差异(P<0.01);修饰行为HH型比GG型和GH型个体行为持续时间都高4 min多,且HH型和另外两者存在显著差异(P<0.05)。

表3 OPRK1基因不同基因型在梅花鹿中各行为性状比较(分钟)Table 3 Comparison for behavior traits of each genotype of OPRK1 in sika deer(min)
3 讨论
3.1 群体平衡的遗传学分析
本研究中,在OPRK1基因引物P-5及P-9扩增结果中都检测到3种基因型,且梅花鹿在这两个位点均处于Hardy-Weinberg不平衡状态。群体不平衡可能是由于基因的遗传漂变或选择、选配等因素所致[19]。遗传漂变即在有限群体中由于取样误差造成了基因频率的随机波动,其产生因素有始祖效应、小群体效应及瓶颈效应。而群体育种规模较小,导致群内个体间不能随机交配是目前养殖业普遍存在的现象,引种、杂交、分群、近交等都会引起基因遗传漂变现象的发生。群体越小,等位基因频率改变的几率越大,低频率基因向下漂变的可能性就越大[20]。本研究中样本量较小,这是造成检测群体处于不平衡状态的重要原因。结论也可能说明两地梅花鹿群体在饲养管理过程中该位点一直受到选择的影响;同时分析可知,长期的群体内闭锁繁育也可导致群体处于不平衡状态。所以要保持现有梅花鹿群体基因频率不变,保存现有基因资源,对梅花鹿群体选育时首先要考虑防止遗传漂变现象的发生;同时要考虑选择、选配对群体基因频率的影响,结合当前行业发展趋势及实际生产要求,在群体有足够大规模时,进行杂交、近交及人工选配。
3.2 OPRK1基因多态性与行为性状的关联分析
对OPRK1基因引物P-5和P-9不同基因型各行为性状的最小二乘均值进行多重比较可知,引物P-5各基因型间修饰行为差异显著,在所观测的7种行为性状中,其它行为EE型和FF型差异显著。P-9引物获得基因型在两地梅花鹿行为性状分析中,卧息行为之间差异极显著;观望行为的3种基因型个体的行为持续时间依次升高,且3种基因型之间两两差异显著(P<0.05);修饰行为也存在显著差异(P<0.05)。李剑虹等曾利用SNP方法对大白、长白和杜洛克猪的Kappa阿片(OPRK1)受体进行分析,结果表明Kappa阿片受体基因SNP对母猪静止站立行为性状存在一定影响[3]。有研究报道Kappa阿片受体基因敲除的小鼠对激动剂的镇痛作用消失,运动减少和烦躁不安的作用也显著降低[21。Kappa阿片受体也参与脑内系统神经回路的活动,系统神经回路上的神经递质(包括多巴胺和阿片肽)通过调节特定的靶神经元群的活动,从而作为一系列行为如学习、记忆、睡眠、摄食、饮水、性行为、攻击等行为和情绪变化的物质基础[22]。同样在小鼠上已经发现了Kappa阿片受体基因的多态性[4]。本研究表明,OPRK1基因引物P-5也检测到基因多态性,且不同基因型之间对梅花鹿的修饰行为产生一定作用,P-9位点扩增产物分析表明,其不同基因型对卧息、观望行为也产生显著影响。同样以BDNF为目的基因对梅花鹿日常行为性状进行研究的结果表明,不同基因型之间对梅花鹿的卧息及运动行为有显著差异[23],因此,初步认为本研究结果和文中所述有相似之处。
动物行为是一个复杂的生物现象,其行为性状是长期的自然选择和人工选择的产物,本研究选择OPRK1作为影响梅花鹿行为性状的候选基因,采用SNP方法分析该基因部分外显子序列单核苷酸位点突变和行为性状的关系,结论表明OPRK1基因可能和梅花鹿的卧息与观望行为存在统计学意义,初步认为GG型可能和动物卧息行为相关,GH可能和动物的观望行为有关。李剑虹等把猪长时间静止站立确定为是一种动物“规癖行为”[3]。圈养条件下,动物长时间卧息或者站立观望可以认为是动物的一种“规癖”或者“呆板”行为。有学者认为,规癖行为的出现是由于对生产性状的过度选育而造成的[24-25],也有学者研究发现规癖是由于动物在圈养条件下,其生存环境单调狭小造成的[26]。Grandin在20世纪70年代没有发现牛卷舌和其它异常行为,而在1996年发现Holstein品种表现为卷舌规癖,这可能是长期定向选择的结果,对高产母猪(产仔数高)的研究也发现其表现较多的行为规癖[27]。对动物园动物研究表明,动物园中驯养的灵长类动物因饲养环境单调狭小带来的紧张对其健康不利[28],导致动物出现无目的踱步、咬栅栏、摇摆身体、空嚼等呆板行为。有报道指出对小鼠进行应激刺激后可导致OPRK1基因的mRNA差异表达[29]。梅花鹿圈养与外界的干扰也是一种应激刺激,从而导致OPRK1基因外显子表现多态性,并且这种多态性与观望行为存在一定相关。另有研究表明,小鼠恐惧及焦虑行为同样可影响Kappa阿片受体在脑杏仁核的表达状况[30]。梅花鹿恐惧与焦虑的表现之一就是增加观望时间,这种观望行为的增加,也是其自身进化和环境适应相互作用的结果,表现在分子水平上,就有可能导致某些行为相关基因的突变,从而在OPRK1基因检测获得多态位点。
因此,在梅花鹿驯化饲养过程中,由于选择选配或者饲养环境单调狭小或外界干扰刺激过多,可能增加其长时间站立观望行为。在适应环境或干扰后又导致其卧息行为显著升高,根据本研究对OPRK1基因不同基因型与行为性状的相关分析结果,推测OPRK1基因可能在育种或者饲养过程中受到一定的选择压力,影响其行为规癖发育的倾向性,从而某种程度上可能形成“规癖”或者“呆板”行为。
[1] Robinson G E,Fernald R D,Clayton D F.Genes and social behavior.Science,2008,322(5903):896-900.
[2] Donaldson Z R,Young L J.Oxytocin,vasopressin,and the neurogenetics of sociality.Science,2008,322(2903):900-904.
[3] Li J H,Cui W G,Wang Y,Bao J.Single nucleotide polymorphism in exon partial sequence of sow kappa opioid receptor gene.Acta Genetica Sinica,2004,31(12):1369-1374.
[4] Saito M,Ehringer M A,Toth R,Oros M,Szakall I,Sikela J M,Vadasz C.Variants of K-opioid receptor gene and mRNA in alcohol-preferring and alcohol-avoiding mice.Alcohol,2003,29(1):39-49.
[5] Gilbert P E,Martin W R.The effects of morphine and nalorphine-like drugs in the nondependent,morphine-dependent and cyclazocine-dependent chronic spinal dog.The Journal of Pharmacology Experimental Therapeutics,1976,198(1):66-82.
[6] Evans C J,Keith D E Jr,Morrison H,Magendzo K,Edwards R H.Cloning of a delta opioid receptor by functional expression.Science,1992,258(5090):1952-1955.
[7] Meng A M,Liu J S.The progress on the opioid receptor function.Chinese Journal of Neuroimmunlolgy and Neurology,2002,9(3):180-182.
[8] Chen Y,Mestek A,Liu J,Hurley J A,Yu L.Molecular cloning and functional expression of a mu-opioid receptor from rat brain.Molecular Pharmacology,1993,44(1):8-12.
[9] Mansour A,Fox C A,Burke S,Meng F,Thompson R C,Akil H,Watson S J.Mu,delta,and kappa opioid receptor mRNA expression in the rat CNS:an in situ hybridization study.The Journal of Comparative Neurology,1994,350(3):412-438.
[10] Wittert G,Hope P,Pyle D.Tissue distribution of opioid receptor gene expression in the rat.Biochemical and Biophysical Research Communications,1996,218(3):877-881.
[11] Guo Y S,Zheng H Z.On the geological distribution,taxonomic status of species and evolutionary history of Sika Deer in China.Acta Theriologica Sinica,2000,20(3):168-179.
[12] Xu H F,Lu H J,Sheng H L,Gu C M.Status and current distribution of South China Sika Deer.Chinese Biodiversity,1998,6(2):87-91.
[13] Sheng H L,Cao K Q,Li W J.Cervus Nippon,the Deer in China.Shanghai:East China Normal University Press,1992:8-18.
[14] Liu H,Shi H Y,Hu J C.Daily activity rhythm and time budget of Sichuan Sika Deer(Cervus nippon sichuanicus)in spring.Acta Theriologica Sinica,2004,24(14):282-285.
[15] Guo Y S,Zheng H Z.Life table and the rate of natural increase in Sichuan Sika Deer.Acta Theriologica Sinica,2005,25(2):150-155.
[16] Lu X P,Wei F W,Li M,Yang G,Liu H.The relationship between Chinese Sika Deer(Cervus Nippon)genetic diversity and Japan deer.Chinese Science Bulletin,2006,51(3):292-298.
[17] Whittington C J,Chamove A S.Effects of visual cover on farmed red deer behaviour.Applied Animal Behaviour Science,1995,45(3/4):309-314.
[18] Lu S J,Todd P A,Yang Y,Liu Y Q,Fan H M,Wei W H.The effects of visitor density on Sika Deer(Cervus nippon)behaviour in Zhu-Yu-Wan Park,China.Animal Welfare,2010,19(1):61-65.
[19] Thévenon S,Thuy L T,Ly L V,Maudet F,Bonnet A,Jarne P,Maillard J C.Microsatellite analysis of genetic diversity of the vietnamese Sika deer(Cervus nippon pseudaxis).Journal of Heredity,2004,95(1):11-18.
[20] Tamate H B,Okada A,Minami M,Ohnishi N,Higuchi H,Takatsuki S.Genetic variations revealed by microsatellite markers in a small population of the Sika Deer(Cervus nippon)on Kinkazan Island,Northern Japan.Zoological Science,2000,17(1):47-53.
[21] Wang J N,Zhang D C.Research on the opioid receptor gene knock out mice.Chinese Clinical Neuroscience,2003,11(2):185-187.
[22] Zhang R M,Feng Z T,Zhang L Q.Clinical and Treatment of Opiates Such As Heroin Dependence.Taiyuan:Shanxi Science and Technology Press,1999:28-46.
[23] Lu S J,Yang Y,Wei W H.The association of BDNF gene polymorphisms with normal behavior traits in house-hold Sika Deer(Cervus nippon).Acta Ecologica Sinica,2011,31(17):4881-4888.
[24] Wright S.The relationship of livestock breeding to theories of evolution.Journal of Animal Science,1978,46(5):1192-1200.
[25] Belyaev D K.Destabilizing selection as a factor in domestication.Journal of Heredity,1998,70(5):301-308.
[26] Grandin T.Genetics and the Behavior of Domestic Animals.San Diego:Academy Press,1997:319-343.
[27] Von Borell E,Hurnik J F.The effect of haloperidol on the performance of stereotyped behavior in sows.Life Sciences,1991,49(4):309-314.
[28] Carlstead K,Shepherdson D.Effects of environmental enrichment on reproduction.Zoo Biology,1994,13(5):447-458.
[29] Lucas L R,Dragisic T,Duwaerts C C,Swiatkowski M,Suzuki H.Effects of recovery from immobilization stress on striatal preprodynorphin-and kappa opioid receptor-mRNA levels of the male rat.Physiology and Behavior,2011,104(5):972-980.
[30] Knoll A T,Muschamp J W,Sillivan S E,Ferguson D,Dietz D M,Meloni E G,Carroll F I,Nestler E J,Konradi C,Carlezon W A Jr.Kappa opioid receptor signaling in the basolateral amygdala regulates conditioned fear and anxiety in rats.Biological Psychiatry,2011,70(5):425-433.
参考文献:
[3] 李剑虹,崔卫国,王宇,包军.猪Kappa阿片受体基因外显子部分序列单核苷酸多态性分析.遗传学报,2004,31(12):1369-1374.
[7] 孟爱民,刘景生.阿片受体功能研究进展(综述).中国神经免疫学和神经病学杂志,2002,9(3):180-182.
[11] 郭延蜀,郑惠珍.中国梅花鹿地史分布、种和亚种的划分及演化历史.兽类学报,2000,20(3):168-179.
[12] 徐宏发,陆厚基,盛和林,顾长明.华南梅花鹿的分布和现状.生物多样性,1998,6(2):87-91.
[13] 盛和林,曹克清,李文军.中国鹿类动物.上海:华东师范大学出版社,1992:8-18.
[14] 刘昊,石红艳,胡锦矗.四川梅花鹿春季昼夜活动节律与时间分配.兽类学报,2004,24(14):282-285.
[15] 郭延蜀,郑慧珍.四川梅花鹿生命表和种群增长率的研究.兽类学报,2005,25(2):150-155.
[16] 吕晓平,魏辅文,李明,杨光,刘海.中国梅花鹿(Cervus nippon)遗传多样性及与日本梅花鹿间的系统关系.科学通报,2006,51(3):292-298.
[21] 王佳楠,张德昌.阿片受体基因敲除小鼠的研究.中国临床神经科学,2003,11(2):185-187.
[23] 吕慎金,杨燕,魏万红.圈养梅花鹿BDNF基因多态性与日常行为性状的关联分析.生态学报,2011,31(17):4881-4888.
