干旱胁迫下4种常用植物幼苗的光合和荧光特性综合评价
2013-12-16卢广超许建新李诗刚邵怡若
卢广超,许建新,,薛 立,*,刘 斌,李诗刚,邵怡若
(1.华南农业大学林学院,广州 510642;2.深圳市铁汉生态环境股份有限公司,深圳 518040)
近年来我国采石业的迅速发展引起了植被破坏和水土流失等严重的生态环境问题[1]。由于矿山开采迹地的侵蚀和水土流失引起的土壤干旱成为植物定居的最主要限制因子[2],所以研究干旱胁迫对矿山恢复植被的幼苗生理特性的影响具有重要的意义。国内外学者对干旱胁迫下的植物光合和荧光特性进行过研究,如Rouhi等[3]研究了干旱胁迫和复水下李属(Prunus)3种植物的光合特性气孔调节能力及其抗旱性差异。Ogaya等[4]比较干旱条件下冬青栎(Quercus ilex)和红景天(Phillyrea latifolai)的光合和荧光参数的变化,得出两物种在干旱环境的竞争力。王琰等[5]对不同种源油松(Pinus tabulaeformis)、蔡海霞等[6]对高山柳(Salix paraqplesia)和沙棘(Hippophae rhamnoides)在干旱胁迫下光合生理参数的变化进行了研究,比较不同植物的抗旱能力。以上研究表明,干旱胁迫引起的气孔关闭、水分平衡失调和酶失活等[3,7]原因会降低CO2同化量[8],导致光系统Ⅱ(PSⅡ)光化学活性与光合电子需求不平衡[9],过剩电子泄漏形成活性氧[10],伤害叶片的叶绿体光合机构PSⅡ系统[8],引发树木的光合机构异常[11],破坏光合电子传递而影响光合生理[12]。耐性品种通过热耗散和光呼吸等机制耗散过剩光能,起到自我保护[13]。由于植物抗旱性的指标很多,简单地用某些指标无法反映其综合抗旱能力,需要对多种生理指标进行综合评价和分析[14]。
老鸭嘴Thunbergia erecta,山毛豆Tephrosia candida,假连翘Duranta repens和葛藤Pueraria lobata是矿山恢复植被常用的几种植物,尽管有些学者研究了老鸭嘴的生理光合特性及其耐荫性[15]、干旱胁迫下山毛豆的光合生理[16]、水培条件下假连翘的生长及光合生理特性[17]、干旱和复水条件下葛藤的生理变化[18],尚未见到比较以上4种植物抗旱光合生理的报道。本研究中,将老鸭嘴等4种幼苗置于温室中盆栽培育,模拟干旱环境,测定其光合和叶绿素荧光参数,并利用主成分分析法对其抗旱性进行了综合评价,可以为矿山生态恢复植物的选择提供参考。
1 材料与方法
1.1 试验材料
试验于2011年7月在华南农业大学林学院院楼苗圃内,试验所用的老鸭嘴、山毛豆、假连翘和葛藤幼苗为营养袋实生苗,营养袋直径13 cm,深13 cm,基质为1∶1的腐殖质土与黄土。幼苗生长基本情况见表1。

表1 幼苗生长基本情况(平均值±标准差)Table 1 General situation of the experimental seedlings(mean±SD)
2011年8月采用自然干旱胁迫的方法对4种试验幼苗进行对照(0 d)、4、8 d及复水后第4和8天5种控水处理,各树种每个处理有6株幼苗用于各项光合和荧光指标的测定。干旱胁迫期间4种幼苗营养袋中的土壤含水量变化见表2。

表2 干旱胁迫期间的土壤含水量变化Table 2 Change of soil water during drought stress
1.2 光合和荧光参数测定
采用LI-6400便携式光合仪(LI-COR,USA)测定幼苗叶片在光强1000 μmol·m-2·s-1下的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci),并计算气孔限制值(Ls=1-Ci/Ca,式中Ca为大气中CO2浓度)。测定时使用开放气路,空气流速为0.5 L/min,叶温25℃,相对湿度60%,外界CO2浓度(Ca)为360 μmol/mol。选用幼苗顶部开始的第3—8枚叶中的5枚成熟叶进行挂牌标记,测定时间为光合作用比较活跃的9:00—11:00,每叶片记录5个值,取平均值。
采用脉冲调制荧光仪OS-1P调制荧光仪测定室温下荧光动力学参数。将挂牌成熟叶在不离体的条件放入样品室,暗适应20 min后,利用非化学淬灭(NPQ)模式下设定每次测量时间为2 min,每次测量5次重复,测定同一叶片相同部位的最大荧光(Fm)、光下最小荧光(F')、光下最大荧光(Fm')、稳态荧光(Fs)、非光化学淬灭(NPQ=Fm/Fm'-1),计算出PSⅡ光能捕获效率(Fv'/Fm'=(Fm'-F')/Fm')、实际光化学量子效率(Yield=(Fm'-Fs)/Fm')、表观电子传递速率(ETR=Yield×PAR×0.84×0.5,PAR 为光合有效幅射)。
1.5 数据分析与处理
利用Excel进行试验数据处理和图表的绘制,利用SAS9.0软件系统进行主成分分析。
2 结果与分析
2.1 干旱胁迫对4种幼苗光合指标的影响
2.1.1 干旱胁迫对幼苗叶片净光合速率的影响
经不同程度干旱胁迫处理后,4种幼苗叶片光合速率(Pn)急剧下降,其中老鸭嘴、假连翘、葛藤的Pn在干旱胁迫4 d和8 d时显著小于对照(P<0.05),山毛豆8 d时显著小于对照(P<0.05)(图1)。老鸭嘴和假连翘幼苗经过4 d复水处理(R4)后显著增加(P<0.05),4种幼苗的Pn经过8 d复水处理(R8)后均显著增加(P<0.05),其中山毛豆幼苗叶片的Pn恢复到对照水平。
2.1.2 干旱胁迫对幼苗叶片气孔导度的影响

图1 干旱胁迫下4种幼苗净光合速率的变化Fig.1 The change of net photosynthetic rate of the four seedling types under drought stress
干旱胁迫处理期间,4种幼苗的叶片气孔导度(Gs)持续下降,干旱胁迫4 d时假连翘和葛藤显著小于对照(P<0.05),干旱胁迫8 d时4种幼苗均显著小于对照(P<0.05)(图2)。在4 d复水处理后,老鸭嘴和假连翘山毛豆幼苗的叶片气孔导度Gs显著增加,8 d复水处理后小幅下降,其中老鸭嘴恢复到对照水平。山毛豆和葛藤幼苗的叶片气孔导度Gs在4 d复水处理后变化不大,8 d复水处理后,山毛豆恢复到对照水平,而假连翘和葛藤仍然显著小于对照(P<0.05)。

图2 干旱胁迫下4种幼苗气孔导度的变化Fig.2 The change of stomatal conductance of the four seedling types under drought stress
2.1.3 干旱胁迫对幼苗叶片蒸腾速率的影响
干旱胁迫处理期间,4种幼苗叶片叶片蒸腾速率(Tr)持续下降,均在第8天降到最小值(P<0.05)。经过4 d和8 d复水处理后,老鸭嘴的Tr恢复到对照水平(图3)。山毛豆的Tr复水4 d后略有下降,8 d复水处理后上升到对照水平。假连翘显著上升后保持稳定,葛藤的小幅波动后显著上升,二者8 d复水处理后仍显著小于对照(P<0.05)。
2.1.4 干旱胁迫对幼苗叶片胞间CO2浓度的影响
干旱胁迫处理期间,4种幼苗叶片胞间CO2浓度(Ci)均持续下降,第8天时的老鸭嘴、假连翘、葛藤的Ci显著小于对照(P<0.05),而山毛豆与对照无显著差异(图4)。经过4 d和8 d复水处理后,老鸭嘴、假连翘和山毛豆幼苗的Ci都先增后降,并在4 d复水后增加到对照水平,而山毛豆先降后增,并在8 d复水后增加到对照水平。葛藤经过4 d和8 d复水处理后,幼苗的Ci持续增加,并在8 d复水后增加到对照水平。
2.1.5 干旱胁迫对幼苗叶片气孔限制值的影响
由图5可以看出,假连翘幼苗叶片气孔限制值(Ls)随干旱胁迫时间的延长而逐渐增加,其他3种幼苗略降后增加,在干旱胁迫第8天时,老鸭嘴、假连翘和葛藤显著大于对照(P<0.05),并在4 d和8 d复水处理后恢复到对照水平。山毛豆在4 d复水处理显著大于对照(P<0.05),在8 d复水后恢复到对照水平。

图3 干旱胁迫下4种幼苗叶片蒸腾速率的变化Fig.3 The change of Leaf transpiration rate of the four seedling types under drought stress

图4 干旱胁迫下4种幼苗胞间CO2浓度的变化Fig.4 The change of intercellular CO2concentration of the four seedling types under drought stress

图5 干旱胁迫下4种幼苗气孔限制值的变化Fig.5 The change of stomatal limitation value of the four seedling types under drought stress
2.2 干旱胁迫对荧光指标的影响
2.2.1 干旱胁迫对幼苗PSⅡ光能捕获效率的影响、
干旱胁迫处理期间,4种幼苗叶片的PSⅡ光能捕获效率(Fv'/Fm')逐渐降低,并显著小于对照(P<0.05)(图6)。在经过4 d和8 d复水处理后,老鸭嘴和葛藤幼苗的Fv'/Fm'保持稳定,假连翘在逐渐上升,但是仍显著小于对照(P<0.05),山毛豆在4 d和8 d复水处理后恢复到对照水平。
2.2.2 干旱胁迫对幼苗的PSⅡ实际光化学量子效率的影响
干旱胁迫处理期间,4种幼苗叶片的PS实际光量子效率(Yield)显著小于对照(P<0.05),并在第8天到最小值(图7)。在经过4 d和8 d复水处理后,老鸭嘴、山毛豆和假连翘幼苗的Yield显著增加(P<0.05),但是仍显著小于对照(P<0.05)。葛藤的叶片Yield逐渐恢复到对照水平。

图6 干旱胁迫下4种幼苗的PSⅡ有效光量子产量的变化Fig.6 The change of the excitation capture efficiency of PSⅡ of the four seedling types under drought stress
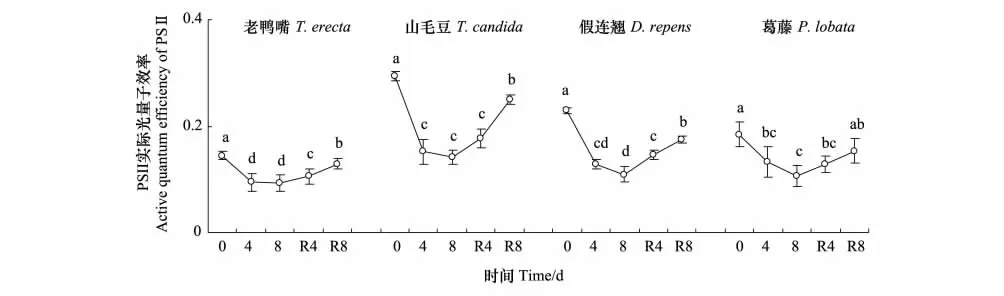
图7 干旱胁迫下4种幼苗的PSⅡ实际光量子效率的变化Fig.7 The change of active quantum efficiency of PSⅡ of the four seedling types under drought stress
2.2.3 干旱胁迫对幼苗表观电子传递速率的影响
干旱胁迫处理期间,4种幼苗叶片的表观光合电子传递速率(ETR)显著下降(P<0.05),在第8天降到最小值(图8)。经过4 d和8 d复水处理后,老鸭嘴幼苗叶片的ETR显著增加(P<0.05),恢复到对照水平。山毛豆、假连翘和葛藤幼苗叶片的ETR逐渐增加,仍显著小于对照(P<0.05)。

图8 干旱胁迫下4种幼苗的表观电子传递速率的变化Fig.8 The change of electron transport rate of the four seedling types under drought stress
2.2.4 干旱胁对幼苗非光化学淬灭的影响
干旱胁迫处理期间,4种幼苗叶片的非光化学淬灭(NPQ)持续上升,在第8天达到最大值(P<0.05)(图9)。经过4 d和8 d复水处理后,4种幼苗叶片的NPQ均持续下降,其中老鸭嘴、山毛豆和假连翘幼苗显著大于对照(P<0.05),而葛藤恢复到对照水平。

图9 干旱胁迫下4种幼苗非光化学淬灭的变化Fig.9 The change of non-photochemical quenching of the four seedling types under drought stress
2.3 4种幼苗抗旱性的综合评价
利用主成分分析法可以全面而准确地分析植物的各种生理指标的综合抗旱性[19]。本文以所测量的干旱胁迫下4种植物幼苗9个光合和荧光指标的平均值为基础数据,利用主成分分析法对4种幼苗的抗旱性进行综合分析。首先按以下公式对数值进行标准化:

式中,X为标准化后所得数据,xi为某项指标的观察值,为某项指标的平均值,S为标准差。
对标准化后的数据进行主成分分析。以累积贡献率达85%以上为参考值,确定主成分个数。由于主成分之间相互独立且有着不同的贡献率,因此,每个主成分得分就是其加权值,其中权重就是主成分对应的贡献率。由此分析得出4种幼苗抗旱性综合评价值大小顺序为:山毛豆>老鸭嘴>假连翘>葛藤(表3)。

表3 4种幼苗抗旱性综合评价值及排序Table 3 Comprehensive assessment values and orders of drought resistance of the four seedling types
3 结论与讨论
4种植物幼苗在干旱胁迫下出现不同程度的光合作用下降现象,光合指标Pn、Gs、Tr、Ci及荧光指标Fv'/Fm'、Yield、ETR均随着干旱胁迫时间的延长而下降,表明在干旱胁迫下,幼苗发生了光抑制,PSⅡ的原初光能转化效率和潜在活性降低,光合电子传递及光合磷酸化受阻,碳同化的运转和有机物的积累下降,但同时干旱胁迫初期的NPQ增大,可以通过热耗散防御过剩光能的破坏,对光合机构起一定的保护作用。另外,叶片Gs和Ci同时下降以及Ls的增加,限制了外界CO2通过气孔进入细胞间隙,导致光合速率下降,表明干旱胁迫下幼苗的Pn下降主要由气孔限制引起。
3.1 植物抗旱性与植物光合指标之间的关系
叶片光合速率(Pn)是光合作用中的一个重要指标,有研究表明,随着干旱胁迫的加剧,植物的叶片Pn随之下降[20],抗旱性强的植物Pn降低的程度比抗旱性弱的小[21]。4种幼苗干旱胁迫处理8 d后的Pn与对照相比,山毛豆下降幅度小于其他3种植物,表明山毛豆抗旱性优于这3种植物。经过复水处理后,山毛豆幼苗的叶片Pn恢复到了对照值,其他3种幼苗仍显著小于对照值,说明山毛豆在复水后恢复能力最强。
干旱胁迫会导致叶片气孔关闭,严重时损伤叶肉细胞、降低光合酶的活性,使植物的光合速率降低[22]。本研究中,4种幼苗叶片的Gs在干旱胁迫期间持续下降,有利于减少水分蒸腾。经过复水处理后,老鸭嘴和山毛豆恢复到对照水平,而其他2种幼苗有所恢复,但是仍然显著小于对照,说明前两者恢复快,对干旱胁迫的适应性和调节能力相对较强。
干旱胁迫使气孔导度下降,CO2进入叶片受阻而使光合下降,从而直接影响植物的光合作用,使植物的生长受阻[23]。在干旱胁迫期间,山毛豆叶片的Ci略有下降,Pn减少的幅度小,而其他3种幼苗的Ci浓度和Pn下降幅度较大。4种幼苗的Ls均显著增加,所以Pn降低的主要原因为气孔限制。此时由于幼苗叶片的气孔关闭,但是受试植物仍然在进行光合作用,故Ci浓度降低。
Tr作为光合作用的一个重要指标,随着干旱胁迫的加深不断地降低[24]。在本研究中,4种幼苗叶片的Tr在干旱胁迫处理期间持续降低,经过复水处理后显著增加,其中老鸭嘴和山毛豆复水8 d时的Tr恢复到对照水平,表明老鸭嘴和山毛豆的耐旱能力较强。
3.2 植物抗旱性与植物荧光指标之间的关系
Fv'/Fm'是PSⅡ光能捕获效率,它反映开放的PSⅡ反应中心原初光能捕获效率,代表激发能被开放的PSⅡ反应中心捕获的效率[25]。在环境(干旱)胁迫下,植物荧光作用的PSⅡ的 Fv'/Fm'值随着环境胁迫加深不断地变小[26]。PSⅡ反应中心活性下降,光化学电子传递速率降低。植物就利用自身的保护机制使过剩的激发能通过非光化学途径耗散,阻止了由于激发能积累引起的PSⅡ的损害[27]。干旱胁迫处理期间,4种幼苗叶片的PSⅡ有效光量子产量有所下降,第8天时显著小于对照(P<0.05),有利于保护细胞。复水后的老鸭嘴、假连翘和葛藤PSⅡ有效光量子产量仍然显著小于对照,而山毛豆恢复到对照水平,进一步表明该植物在本试验中表现出最强的抗旱能力。
实际光化学量子效率(Yield)常用来表示植物光合作用下PSⅡ总的光化学量子产额,它反映PSⅡ反应中心在部分关闭情况下的实际原初光能捕获效率[28]。4种幼苗的Yield值均下降,下降幅度最小的是老鸭嘴,说明其受到的光抑制最弱,适应强光的能力更强。复水后4种幼苗的Yield均回升,说明植物在复水之后,增加了PSⅡ反应中心开放比例,进而导致Yield的升大,这与复水后植物Pn的增加相吻合,说明植物的光合作用得以恢复。
ETR是反映实际光强下的表观电子传递速率,同时也是表示植物光合能力大小的有效参数[28],反映了PSⅡ反应中心的电子捕获效率[26]。4种幼苗的ETR显著下降(P<0.05),说明在干旱胁迫下,捕光蛋白复合体被抑制,使得电子传递受阻,光能转化效率降低[29]。经过复水处理后,4种幼苗叶片的ETR都显著增加,其中老鸭嘴恢复到对照水平,说明其具有较强的损伤修复能力。
非光化学淬灭(NPQ)反映的是PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分,是表示热耗散多少的指标[30]。所有幼苗的NPQ持续增加,假连翘增加幅度最大,表明其更能通过加强热耗散,保护光合器官。葛藤的Pn下降幅度最大,但是其NPQ上升幅度最小,不利于其热耗散,表明对干旱环境适应能力弱。经过复水处理后,各幼苗的叶片NPQ显著下降,说明光合器官的热耗散减少,传递给光化学反应中心的激发能增强,光合作用有所恢复。
山毛豆的ETR值较其他3种幼苗大,而NPQ值较它们小,表明山毛豆有较强的光呼吸能力,光能利用效率较高,热耗散较小,能保证吸收的光能最大限度地进入电子传递系统进而进行碳固定[31]。
[1] Yang Z Y,Xue L,Xu J X.Advances in ecology restoration of abandoned quarries.Acta Ecologica Sinica,2012,32(16):5264-5274.
[2] Meira-Neto J A A,Clemente A,Oliveira G,Nunes A,Correia O.Post-fire and post-quarry rehabilitation successions in Mediterranean-like ecosystems:implications for ecological restoration.Ecological Engineering,2011,37(8):1132-1139.
[3] Rouhi V,Samson R,Lemeur R,van Damme P.Photosynthetic gas exchange characteristics in three different almond species during drought stress and subsequent recovery.Environmental and Experimental Botany,2007,59(2):117-129.
[4] Ogaya R,Peñuelas J.Comparative field study of Quercus ilex and Phillyrea latifolia:photosynthetic response to experimental drought conditions.Environmental and Experimental Botany,2003,50(2):137-148.
[5] Wang Y,Chen J W,Di X Y.Characterization of the responses of photosynthetic and chlorophyll fluorescence parameters to water stress in seedlings of six provenances of Chinese Pine(Pinus tabulaeformis Carr.).Acta Ecologica Sinica,2011,31(23):7031-7038.
[6] Cai H X,Wu F Z,Yang W Q.Effects of drought stress on the photosynthesis of Salix paraqplesia and Hippophae rhamnoides seedlings.Acta Ecologica Sinica,2011,31(9):2430-2436.
[7] Flexas J,Medrano H.Drought-inhibition of photosynthesis in C3plants:Stomata land non-stomatal limitations revisited.Annals of Botany,2002,89(2):183-189.
[8] Wu G L,Duan R Y,Wang Z G,Zhang Z X,Wu L F.Effects of drought stress and rehydration on chlorophyll fluorescence characteristics in Fragaria X ananassa Duch.Acta Ecologica Sinica,2010,30(14):3941-3946.
[9] Vitale L,Di Tommasi P,Arena C,Riondino M,Forte A,Verlotta A,Fierro A,de Santo A V,Fuggi A,Magliulo V.Growth and gas exchange response to water shortage of a maize crop on different soil types.Acta Physiologiae Plantarum,2009,31(2):331-341.
[10] Luo M H,Hu J Y,Wu Q G,Yang J T,Su Z X.Effects of drought stress on leaf gas exchange and chlorophyll fluorescence of Salvia miltiorrhiza.Chinese Journal of Applied Ecology,2010,21(3):619-623.
[11] Flexas J,Ribas-Carbó M,Bota J,Galmés J,Henkle M,Martínez-Cañellas S,Medrano H.Decreased rubisco activity during water stress is not induced by decreased relative water content but related to conditions of low stomatal conductance and chloroplast CO2concentration.New Phytologist,2006,172(1):73-82.
[12] Zhou J,Wei H,Lü Q,Li C X,Wang Z X,Gao W,Chen W.Effects of soil water regime on leaf photosynthetic characteristics of slash pine(Pinus elliottii Engelm)seedlings.Chinese Journal of Ecology,2012,31(1):30-37.
[13] Ort D R,Baker N R.A photoprotective role for O2as an alternative electron sink in photosynthesis.Current Opinion in Plant Biology,2002,5(3):193-198.
[14] Tan X H,Gao Y P,Guo X P,Zhao T N,Wang L.Physiological characteristics and comprehensive evaluation of drought resistance in five plants used for roadside ecological restoration.Acta Ecologica Sinica,2012,32(16):5076-5086.
[15] Zeng X P,Zhao P,Cai X A,Rao X Q,Liu H,Ma L,Li C H.Shade-tolerance of 25 low subtropical plants.Journal of Beijing Forestry University,2006,28(4):88-95.
[16] Pei X C,Chen P,Liu J R,Yu D S.Evaluation of drought resistance of four native plants seedlings.Guangdong Agricultural Sciences,2010,37(2):37-41.
[17] Wang Q,Wang Y G,Shi C J,Sun J X,Tang Y F.Effect on the growth and photosynthetic traits of four kinds of greenbelt plants cultivated using reclaimed water.Acta Prataculturae Sinica,2010,19(6):106-113.
[18] Li L,Xu Z F,Wei X,Cao H L,Su J,Ye W H.Physiological compare Merremia boisiana with Pueraria lobata under drought stress and rewatering conditions.Guihaia,2008,28(6):806-810.
[19] Feng H F,Xue L,Ren X R,Fu J D,Zhang W G,Shi X L.Physiological responses of four broadleaved seedlings to drought stress simulated by PEG.Acta Ecologica Sinica,2011,31(2):371-382.
[20] Chen J,Zhang G C,Zhang S Y,Wang M J.Response processes of Aralia elata photosynthesis and transpiration to light and soil moisture.Chinese Journal of Applied Ecology,2008,19(6):1185-1190.
[21] Ao H,Zhang Y.Effects of water stress on photosynthetic characteristics of spruce.Bulletin of Botanical Research,2007,27(4):445-451.
[22] Lawlor D W,Cornic G.Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants.Plant,Cell and Environment,2002,25(2):275-294.
[23] Yao Q Q,Xie G S.The photosynthetic stomatal and nonstomatal limitation under drought stress.Chinese Journal of Tropical Agriculture,2005,25(4):84-89.
[24] Li Y X,Shen S H,Li L,Wang X M,Zhang F C,Han X M.Effects of soil moisture on leaf gas exchange and chlorophyll fluorescence parameters of winter wheat during its late growth stage.Chinese Journal of Ecology,2012,31(1):74-80.
[25] Bao S W,Tan F.Effects of high temperature on Taxus media chlorophyll fluorescence parameters.Journal of Fujian Forestry Science and Technology,2009,36(3):64-68.
[26] Sun J K,Zhang W H,Lu Z H,Liu X C.Chlorophyll fluorescence characteristics of Elaeagnus angustifolia L.and Grewia biloba G.Don var.parviflora(Bge.)Hand.-Mazz.seedlings under drought stress.Bulletin of Botanical Research,2009,29(2):216-223.
[27] Liang H Z,Dou D Q,Feng Y L.Diurnal changes in photosynthesis and chlorophyll fluorescence parameters of Amomum villosum lour.grown under tropical rainforest in rainy,and foggy and cool seasons at Xishuangbanna.Acta Ecologica Sinica,2004,24(7):1422-1431.
[28] Li C X,Cao H.Effects of drought on chlorophyll fluorescence parameters of Malus plant.Journal of Anhui Agricultural Sciences,2008,36(31):13536-13538.
[29] Li W,Zhao Y S,Zhou Z Q,Sun G Y,Liu T.Effects of drought stress and rehydration on chlorophyll fluorescence characteristics and antioxidant enzyme activities in leaves of Taxus cuspidata.Journal of Desert Research,2012,32(1):112-116.
[30] Zhou X J,Zhao H B,Ma C C.Effects of silicon on chlorophyll fluorescence of cucumber seedlings under severe drought stress.Acta Agriculturae Boreali-Sinica,2007,22(5):79-81.
[31] Zong M,Tan K,Wu G L.Comparative study on diurnal changes of chlorophyll fluorescence parameters of two types of Photinia serrulata Lindl.Journal of Biology,2010,27(1):27-30.
参考文献:
[1] 杨振意,薛立,许建新.采石场废弃地的生态重建研究进展.生态学报,2012,32(16):5264-5274.
[5] 王琰,陈建文,狄晓艳.不同油松种源光合和荧光参数对水分胁迫的响应特征.生态学报,2011,31(23):7031-7038.
[6] 蔡海霞,吴福忠,杨万勤.干旱胁迫对高山柳和沙棘幼苗光合生理特征的影响.生态学报,2011,31(9):2430-2436.
[8] 吴甘霖,段仁燕,王志高,张中信,吴礼凤.干旱和复水对草莓叶片叶绿素荧光特性的影响.生态学报,2010,30(14):3941-3946.
[10] 罗明华,胡进耀,吴庆贵,杨敬天,苏智先.干旱胁迫对丹参叶片气体交换和叶绿素荧光参数的影响.应用生态学报,2010,21(3):619-623.
[12] 周珺,魏虹,吕茜,李昌晓,王振夏,高伟,陈伟.土壤水分对湿地松幼苗光合特征的影响.生态学杂志,2012,31(1):30-37.
[14] 谭雪红,高艳鹏,郭小平,赵廷宁,王亮.五种高速公路边坡绿化植物的生理特性及抗旱性综合评价.生态学报,2012,32(16):5076-5086.
[15] 曾小平,赵平,蔡锡安,饶兴权,刘惠,马玲,李长洪.25种南亚热带植物耐阴性的初步研究.北京林业大学学报,2006,28(4):88-95.
[16] 裴彩霞,陈平,刘金荣,于得水.4种乡土植物幼苗抗旱性评价.广东农业科学,2010,37(2):37-41.
[17] 王齐,王有国,师春娟,孙吉雄,谭一凡.中水水培对4种绿地植物生长及光合生理特性的影响.草业学报,2010,19(6):106-113.
[18] 李玲,徐志防,韦霄,曹洪麟,粟娟,叶万辉.金钟藤和葛藤在干旱与复水条件下的生理比较.广西植物,2008,28(6):806-810.
[19] 冯慧芳,薛立,任向荣,傅静丹,郑卫国,史小玲.4种阔叶幼苗对PEG模拟干旱的生理响应.生态学报,2011,31(2):371-382.
[20] 陈建,张光灿,张淑勇,王梦军.辽东楤木光合和蒸腾作用对光照和土壤水分的响应过程.应用生态学报,2008,19(6):1185-1190.
[21] 敖红,张羽.水分胁迫对云杉光合特性的影响.植物研究,2007,27(4):445-451.
[23] 姚庆群,谢贵水.干旱胁迫下光合作用的气孔与非气孔限制.热带农业科学,2005,25(4):84-89.
[24] 李永秀,申双和,李丽,汪秀敏,张富存,韩小梅.土壤水分对冬小麦生育后期叶片气体交换及叶绿素荧光参数的影响.生态学杂志,2012,31(1):74-80.
[25] 鲍思伟,谈锋.高温对曼地亚红豆杉叶绿素荧光参数的影响.福建林业科技,2009,36(3):64-68.
[26] 孙景宽,张文辉,陆兆华,刘新成.干旱胁迫下沙枣和孩儿拳头叶绿素荧光特性研究.植物研究,2009,29(2):216-223.
[27] 梁红柱,窦德泉,冯玉龙.热带雨林下砂仁叶片光合作用和叶绿素荧光参数在雾凉季和雨季的日变化.生态学报,2004,24(7):1422-1431.
[28] 李春霞,曹慧.干旱对苹果属植物叶绿素荧光参数的影响.安徽农业科学,2008,36(31):13536-13538.
[29] 李威,赵雨森,周志强,孙广玉,刘彤.干旱和复水对东北红豆杉叶片叶绿素荧光特性和抗氧化酶活性的影响.中国沙漠,2012,32(1):112-116.
[30] 周秀杰,赵红波,马成仓.硅对严重干旱胁迫下黄瓜幼苗叶绿素荧光参数的影响.华北农学报,2007,22(5):79-81.
[31] 宗梅,谈凯,吴甘霖.两种石楠叶绿素荧光参数日变化的比较研究.生物学杂志,2010,27(1):27-30.
