大明竹属遗传多样性ISSR分析及DNA指纹图谱研究
2013-12-16黄树军陈礼光肖永太荣俊冬何天友郑郁善
黄树军,陈礼光,肖永太,荣俊冬,黄 婷,何天友,郑郁善,,*
(1.福建农林大学林学院,福州 350002;2.福建农林大学园林学院,福州 350002)
大明竹属(Pleioblastus)隶属竹亚科(Bambusoideae),主要分布东南亚,目前已发表的学名有100余种,我国有20余种,零散分布,长江中下游居多[1]。该属竹笋可食,但味苦,竹竿通直壁厚,可作毛笔杆、伞柄、支架等用。一些竹如川竹[P.simonii(Carriere)Naka]、大明竹[P.gramineus(Bcan)Nakai]等的形态优美,被广泛用于园林绿化及庭院景观。该属的生态和经济价值越来越受人们关注。
竹类植物的生长发育规律都较为特殊,以花、果实等形态为主的传统植物分类方法对竹子分类复杂困难,竹子分类不一[2-4],在学术上颇有争议[5]。随现代分子生物技术的飞速发展,分子标记技术在竹子分类及遗传多样性研究得到了广泛应用[6-11],分子标记可检测部分竹种的基因差异,在分子水平上辅助分类[12],助于解决分类争议,对鉴定种质资源起重要作用。近年来,常用的分子标记有RFLP、RAPD、AFLP、ISSR、SSR、SNP等。简单重复序列间扩增(ISSR)是由Zietkiewicz提出,有较好的稳定性和多态性[13-14],其技术要求低,操作简便,成本低,是构建基因图谱理想的分子标记技术。ISSR技术已广泛应用于鉴定品种、分析遗传多样性、绘制指纹图谱等研究领域[15-18]。目前大明竹属的部分植物分类还存在争议[19],应用分子标记技术大明竹属植物种间亲缘关系的研究报道不多。本试验利用ISSR技术分析大明竹属25个种的遗传多样性,并用引物构建25个种的DNA数字指纹识别码,为大明竹属部分竹种分类提供相关依据。
1 材料和方法
1.1 材料
在福建农林大学百竹园取大明竹属25个种含变种的嫩竹叶,每种取样3—5株,用放变色硅胶的冰壶干燥保鲜,并速带回置于-80℃低温保存,以备提取DNA。ISSR引物为哥伦比亚大学公布的100条中经筛选对25个种具有较好多态性的18条(见表1)。25个竹种依次编号(1—25)为:长叶苦竹P.china f.hisauchii、大明竹 P.gramineus(Bean)Nakai、垂枝苦竹P.amarus(Keng)Keng f.var.pendulifolius S.Y.Chen、光箨苦竹 P.amarus(Keng)Keng f.var.subglabratus S.Y.Chen、庆元苦竹 P.qingyuanensis、白纹东根世 P.chino f.angustifolius、遂昌苦竹 P.suichangensis、白纹女竹 P.simonii f.albostriatus、硬头苦竹 P.longifimbriatus S.Y.Chen、橙绿鞘苦竹 P.dokgyoamus、油苦竹 P.oleosus Wen、杭州苦竹 P.amarus var.(Keng)Keng f.var.hangzhouensis S.L.Chen et S.Y.Chen(accepted name)、苦竹 P.amarus(Keng)Keng f.、黄条金刚竹 P.kongosanensis f.aureostriaus、秋竹 P.gozadakensis Nakai、仙居苦竹 P.hsienchuensis Wen、云和苦竹 P.yunhoensis、斑苦竹 P.maculates(McClure)C.D.Chu et C.S.Chao、衢县苦竹P.juxianensis Wen、华丝竹P.intermedius S.Y.Chen、丽水苦竹 P.maculosoides Wen、宜兴苦竹 P.yixingensis S.L.Chen et、实心苦竹 P.longifimbriatus S.Y.Chen、螺节竹 P.graminens f.manstopiral、皱苦竹 P.rugatus Wen et S.Y.Chen。
1.2 主要试剂和仪器
l0×PCR Buffer、DNA ladder Marker、dNTPs Mixture(各2.5 mmol/L)、ISSR 引物、Taq DNA 聚合酶、RNA 酶、MgCl2、琼脂糖(Agarose)等购于上海生工生物工程技术服务有限公司(Sangon);核酸染料Gold View购于上海赛百盛公司;液氮购于福建省福州市第二化工厂;乙二胺四乙酸二钠(EDTANa2)、三羟基氨基甲烷(Tris)、硼酸、溴酚蓝、无水乙醇、蔗糖等为国产分析纯。主要实验仪器为:圣欧国际有限公司的LabCycler PCR、上海培清科技有限公司的JS-680全自动数码凝胶成像分析仪、北京六一仪器厂DYY-8C电泳仪等。
1.3 方法
1.3.1 DNA 的提取
大明竹属DNA的提取采用杭州博日公司Biospin植物基因组DNA提取试剂盒(Cat#BSCl3S1),在含有Gold View核酸染料的1.0%琼脂糖凝胶电泳,缓冲液为1×TBE,电泳电压为5 V/cm,电泳时间30 min,并用凝胶成像分析仪检测DNA的完整性。用紫外分光光度计测定DNA纯度及浓度。显示DNA质量完好,条带明亮清晰完整,纯度合格,满足试验要求,于-20℃冰箱保存。
1.3.2 ISSR-PCR反应体系和扩增程序
查阅资料[20],PCR 设定反应体积 20 μL,40 ng 模板 DNA、0.5 μmol/L 引物、0.5 mmol/L dNTPs、2 μL 的10×PCR Buffer、1.0 U Taq DNA聚合酶、2.0 mmol/L Mg2+。筛选时所应用的扩增程序固定为:94℃预变性5 min,94℃变性30 s,55℃复性30 s,72℃延伸90 s,循环40次,72℃延伸7 min,4℃结束。以大明竹DNA样品为模板,利用UBC811引物优化ISSR扩增体系。以设定的原初体系为基础,单因素设计不同梯度的Mg2+、Taq DNA、引物、dNTPs、模板DNA浓度,每次改变其中某一因素优化其体系。
经筛选,确定大明竹属部分植物的ISSR-PCR反应体系为20 μL体系:2 μL的l0×Buffer;0.15 mmol/L的dNTPs;0.5 μmol/L的引物;2.5 mmol/L 的 MgCl2;50 ng/20μL 的模板 DNA;1.0 U 的 Taq DNA 聚合酶;10.6 μL的灭菌ddH2O。其ISSR扩增程序为:94℃预变性5 min,94℃变性60 s,55℃复性45 s,72℃延伸90 s,循环40次,72℃延伸7 min,4℃结束。PCR产物检测用1.5%琼脂糖凝胶电泳1 h,电压80 V,核酸染料染色,在紫外凝胶成像分析仪拍照观察。
1.3.3 ISSR有效引物的筛选及反应体系的检验
用100条随机引物对任意一份DNA样品在优化的反应体系及扩增程序扩增以筛选引物,引物需符合(1)条带清晰,不模糊,不弥散;(2)空白中无或少假带;(3)对所有样品均有质量好的条带。最后,以25种竹子的DNA作为模版,用筛选的18条引物检验有效引物及反应体系(图1)。

图1 大明竹属植物ISSR部分引物筛选图Fig.1 Preliminary seletion of some ISSR primers on Pleioblastus
1.4 ISSR条带分析与数据统计
ISSR条带分析结果的记录过程,不能只依据带的强弱取舍位点,位点的带应具较好的可重复性,对弱带的处理方式为:若重复性好,仅因升高退火温度而消失,则视为退火位点不完全匹配造成,可记录;而弱带无规律可能为产物间退火、非专一性扩增或其他人为因素导致,不可记录。
采用Jaccard公式计算不同物种间随机扩增多态DNA片段相似性:F=2Nxy/(Nx+Ny),式中F为共享度,Nxy为物种X和物种Y共有的DNA片段数,Nx和Ny分别为物种X和物种Y的DNA片段数,任意两物种间的遗传距离(P)根据其共享的ISSR片段相似性D来计算,D=-lnF[21]。
ISSR扩增带用“1”和“0”表示有或无,建立数据库。利用DPS 7.05软件统计分析,根据遗传距离(P)采用UPGMA类平均法进行聚类分析,建立分析树状图。
2 结果与分析
2.1 大明竹属25种竹不同引物的ISSR标记多态性分析
利用筛选的18条引物对25种竹ISSR分析,引物的碱基序列如表1所示。多态位点百分率是衡量一个群体内遗传变异水平高低的重要指标,某群体的比值若高,则说明该群体的环境适应性强;反之则弱,经长期进化容易被淘汰。18条引物在供试样品中共扩增出155个位点,其中多态位点137个,每个引物平均扩增8.61个位点,多态位点有7.61个,多态位点占扩增位点88.3%。说明大明竹属种间有较大的遗传差异,该属作为一个群体具有强的环境适应能力。18条引物对25种竹共扩增条带1816条,每条引物平均扩增条带100.88条,部分引物扩增如图2—图3所示。扩增的DNA片段分子量在160—3000 bp之间。

表1 大明竹属ISSR分析引物Table 1 The sequence of ISSR primers on Pleioblastus
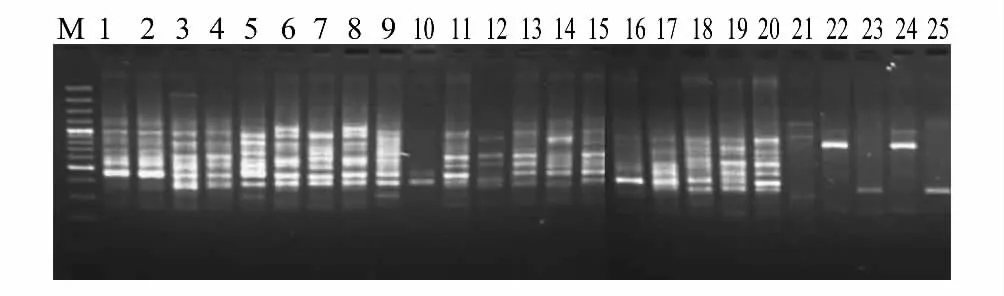
图2 引物U807对25个大明竹属样品的ISSR扩增电泳图谱Fig.2 The 25 samples for Pleioblastus amplified by ISSR U807

图3 引物U810对25个大明竹属样品的ISSR扩增电泳图谱Fig.3 The 25 samples for Pleioblastus amplified by ISSR U810
2.2 大明竹属部分竹类种间遗传距离及遗传多样性分析
通过比较扩增条带有无、数量及带型差异来分析种间的遗传多样性及亲缘关系。差异条带数量多,带型变化大,说明竹种间的遗传距离大,遗传多样性丰富,亲缘关系则较远,反之,遗传距离就小,亲缘关系则近。亲缘关系可通过遗传距离(0—1之间)来判定,若为1,则亲缘关系完全一样,若为0则无亲缘关系。依据18条引物扩增结果,量化基因组指纹图谱为数据矩阵,用Jaccard公式计算种间的遗传距离(表2)。大明竹属25种竹的平均遗传距离为0.5006,变异幅度在0.1486—0.7191之间,其遗传距离的平均值及变异幅度均较高,说明大明竹属具有较高的遗传多样性,表明该属在遗传进化过程,受各类因素影响,或地理位置变迁,或气候变化,种间的基因组DNA发生了变异,从而构成丰富的基因库。从DNA水平分析,若种间遗传距离的变异幅度大,则说明其遗传分化大,遗传多样性高,遗传背景复杂,该属的遗传距离大多在0.5范围内,说明了该属在遗传上的相对稳定性。表2可知同一竹种的变种的种间遗传距离小,不同种的种间遗传距离较大,大明竹亚属中的长叶苦竹、大明竹、螺节竹与苦竹组有较大的遗传距离,川竹亚属苦竹组的种间遗传距离小。种间遗传距离显示,大明竹属25种竹的亲缘关系与形态分类的分类结果基本一致,说明该形态分类方法比较合理,且用ISSR分析在分子水平检测该属部分植物的种间遗传多样性较为可靠。

2.3 大明竹属25种竹的聚类分析
对扩增结果形成的基因型原始数据矩阵,运用DPS 7.05软件分析大明竹属亲缘关系,根据遗传距离采用Nei_Li最长距离法聚类分析,建立聚类分析树状图(图4,表3)。
聚类结果表明:大明竹、长叶苦竹的遗传距离最近0.1618,先聚为第一类;在0.3662处宜兴苦竹、螺节竹聚为一起,并在0.4702处与丽水苦竹聚为第二类;在0.1618处同为苦竹变种的垂枝苦竹和光箨苦竹聚为一起,并在0.3665处与庆元苦竹聚为一枝;白纹东根世、白纹女竹在0.1750处聚在一起,并在0.3124处与遂昌苦竹聚为一枝;上述两枝在0.4332处聚为一枝;在0.2113处硬头苦竹、櫈绿鞘苦竹聚在一枝;在0.3319处,杭州苦竹、苦竹、黄条金刚竹、秋竹聚为一枝;在0.4286处实心苦竹与皱苦竹聚为一枝;在0.4337处,油苦竹、云和苦竹、衢县苦竹、斑苦竹、华丝竹、仙居苦竹聚为一枝;以上几枝最终在0.5396处合聚为第三类。在图4画线处(0.5396)可将25种竹划分为3组,即第1组遗传距离为0.1618:长叶苦竹和大明竹;第2组遗传距离为0.4702:丽水苦竹、宜兴苦竹及螺节竹;第3组遗传距离为0.5634:垂枝苦竹、光箨苦竹、庆元苦竹、白纹东根世、白纹女竹、杭州苦竹、苦竹、硬头苦竹、櫈绿鞘苦竹、黄条金刚竹、秋竹、云和苦竹、衢县苦竹、斑苦竹、遂昌苦竹、华思竹、油苦竹、仙居苦竹、实心苦竹和皱苦竹。

图4 25个大明竹属竹种间的聚类树状图Fig.4 Dendrogram of the cluster of 25 bamboo species of Pleioblastus based on ISSR markers

表3 大明竹属植物个体的聚类次序及距离Table 3 Clutering order and genetic distance of the 25 bamboo species of Pleioblastus
2.4 大明竹属25种竹基于ISSR技术的DNA数字指纹识别码
研究得出用U807、U815及U835可鉴定大明竹属25个竹种,还可与有较高多态性的U836、U840、U841和U844的4条引物共同构建大明竹属25种竹的DNA数字指纹识别码(表4),可用于鉴别大明竹属部分竹类的分类。
3 结论与讨论
研究共扩增出重复性好的多态位点高达88.3%,平均每个引物扩增8.61个,DNA分子量在160—3000 bp,大明竹属25种竹子的平均遗传距离为0.5006,变异幅度为0.1486—0.7191,说明大明竹属具有高的遗传多样性,种间遗传相对复杂。ISSR聚类分析结果,在遗传距离0.5396处将25种竹划分为3类,与形态分类结果大致一致。第3组大多竹种的遗传距离小于0.5(表3),其表现出稳定的遗传性状,它们均为中国植物志传统分类学的川竹亚属苦竹组竹种,其中同为苦竹变种的垂枝苦竹和光箨苦竹在0.1618处相聚,苦竹和苦竹的变种杭州苦竹在0.1806处相聚,表现出较高的遗传相似性。大明竹、长叶苦竹和螺节竹都为大明竹亚属,和川竹亚属苦竹组存在着较大的遗传差异,其中大明竹和长叶苦竹亲缘关系非常接近。杨光耀[22]用RAPD研究认为,宜兴苦竹与苦竹关系密切,大明竹与长叶苦竹、苦竹、斑苦竹、宜兴苦竹亲缘关系较远,本研究则认为大明竹与长叶苦竹关系密切,宜兴苦竹与苦竹组未聚一起,与其观点不一致。在传统分类学中,丽水苦竹和宜兴苦竹同属于川竹亚属苦竹组,但并未与苦竹组竹种相聚在一起,此结果有可能是因为竹种发生变异导致,或是人为因素促使,其具体原因及机理有待进一步研究。虽然大明竹属有些竹种未与其变种相聚在一起,划分在其他亚属里,但传统形态分类与聚类分析结果大致吻合,说明ISSR分析大明竹属部分竹类种间或种内的亲缘关系及遗传多样性较为精确可靠,有助于该属的分类。试验结果多态性丰富,说明大明竹属具有高的遗传多样性,其种间遗传相对复杂,而ISSR技术能灵敏精确检测多样遗传。试验用U807、U815、U835、U836、U840、U841、U844共7个引物建立大明竹属25个竹种的数字指纹识别码,为鉴定大明竹属提供相应依据。

表4 25个大明竹属竹种的数字指纹码Table 4 Fingerprints of the 25 provenances resources of Pleioblastus by ISSR
利用形态学、细胞学及分子标记等手段对竹类分类研究已有一定成果,但还存在较多分歧。分子标记也具有一定的局限性,ISSR是继SSR后发展的新技术,其重复性及稳定性高,被广泛用于分析遗传多样性及鉴定品种等方面。本研究利用ISSR技术对大明竹属部分竹种初步探究,分子技术在竹类领域的研究还值得继续探索。利用分子标记开展竹种间分子水平上遗传变异研究,结合形态分类,对竹类辨别分类,能够更好地鉴定与解决某些种属分类混乱问题,研究遗传多样性等,为竹子分类提供分子依据,使分类更加合理。随生物技术不断发展,竹类研究也将运用生物技术解决更多难题,竹类的基因组研究、基因机理、转基因技术和克隆技术,都将成为竹类研究的新方向。
[1] World Bamboo Resources.World bamboo resources.World Bamboo and Rattan,2005,3(1):30-30.
[2] Gan X H,Ding Y L.Advances in the anatomic structure of bamboo.Journal of Bamboo Research,2002,21(1):11-17.
[3] Guo Z L,Li D Z.Advances in the systematics and biogeography of the Bambusoideae(Gramineae)with remarks on some remaining problems.Acta Botanica Yunnanica,2002,24(4):431-438.
[4] Chen S L,Ying J.The decorative value and utilization of bamboo.Journal of Bamboo Research,2000,19(2):13-17.
[5] Zhao Q Z,Tang G G.The present status and problems of bamboo classification in China.Journal of Nanjing Forestry University:Natural Sciences Edition,1993,17(4):1-8.
[6] Jin P L,Ruth K,Ohn S,Leong H G,Yik Y G.A study of genetic variation and relationships within the bamboo subtribe bambusinae using amplified fragment length polymorphism.Annals of Botany,2000,85(5):607-612.
[7] Hodkinson T R,Renvoize S A,Chonghaile G N,Stapleton C M,Chase M W.A comparison of its nuclear rDNA sequence data and AFLP markers for phylogenetic Studies in Phyllostachys(Bambusoideae,Poaceae).Journal of Plant Research,2000,113(3):259-269.
[8] Lin X C,Ruan X S,Lou Y F,Guo X Q,Fang W.Genetic similarity among cultivars of Phyllostachys pubescens.Plant Systematics and Evolution,2009,277(1/2):67-73.
[9] Guo X Q,Li B,Ruan X S,Lou Y F,Lin X C,Tang D Q,Fang W.Genetic diversity of ten Phyllostachys edulis cultivars with ACGM markers.Scientia Silvae Sinicae,2009,45(4):28-32.
[10] Wu J Y,Deng Y Y,Ding Y L.RAPD analysis of the varieties of Phyllostachys Nidularia.Journal of Changzhou Institute of Technology,2008,21(1):59-63.
[11] Lou Y F,Yang H Y,Zhang Y Z,Li X F,Lin X C,Fang W.Analysis of genetic variation of some bamboo species by AFLP,ISSR and SRAP.Journal of Fujian College of Forestry,2011,31(1):38-43.
[12] Zheng R,Zheng W P,Fang W.Application of DNA molecular markers in studying bamboo toxonomy.Journal of Fujian Forestry Science and Technology,2006,33(3):162-165.
[13] Fango Q D,Roose M L.Identification of closely related citrus cultivars with inter-simple sequence repeat markers.Theoretical and Applied Genetics,1997,95(3):408-417.
[14] Zietkiewicz E,Rafalski A,Labuda D.Genome fingerprinting by simple sequence repeat(SSR)-anchored polymerase chain reaction amplification.Genomics,1994,20(2):176-183.
[15] Chen L,Wang J L,Yang X S.ISSR polymorphism and its application in plant molecular biology.Seed,2007,26(10):49-52.
[16] Joshi S P,Gupta V S,Aggarwal R K,Ranjekar P K,Brar D S.Genetic diversity and phylogenetic relationship as revealed by inter simple sequence repeat(ISSR)polymorphism in the genus Oryza.Theoretical and Applied Genetics,2000,100(8):1311-1320.
[17] Zhou Y Q,Jing J Z,Li Z Y,Zhang B H,Jia J F.Assessment of genetic diversity of Rehmannia glutinosa germplasm detected by RAPDs and ISSRs.Hereditas,2004,26(6):922-928.
[18] Yu A L,Zhang M Q,Chen R K.Applicability of inter-simple sequence repeat polymorphisms in sugarcane and its related genera as DNA markers.Journal of Fujian Agriculture and Forestry University:Natural Science Edition,2002,31(4):484-489.
[19] Yang G Y,Zhao Q Z.Phylogenetic relationships among five Pleioblastus species(Bambusoideae)from China and Japan based on random amplified polymorphic DNA.Acta Agriculturae Universitatis Jiangxiensis,2000,22(4):551-553.
[20] Sun Z J,Xiang Y,Wang J M,Shen Z G.The orthogonal optimization of ISSR amplification system in Phyllostachys sulphurea.Journal of Bamboo Research,2007,26(4):17-21.
[21] Yang R,Sun Z J,Xiang Y.ISSR analysis of genetic diversity among 14 bamboo species in Phyllostachys.Journal of Bamboo Research,2010,29(4):11-14,20-20.
[22] Yang G Y,Zhao Q S.RAPD study on intergeneric relationships in Shibataeeae Nakai emend Keng f.(Gramineae,Bambusoideae).Journal of Bamboo Research,2001,20(2):1-5.
参考文献:
[1] 国际竹藤组织编写组.世界竹子资源概况.世界竹藤通讯,2005,3(1):30-30.
[2] 甘小洪,丁雨龙.竹类结构植物学研究进展.竹子研究汇刊,2002,21(1):11-17.
[3] 郭振林,李德铢.竹亚科系统学和生物地理学研究进展及存在的问题.云南植物研究,2002,24(4):431-438.
[4] 陈双林,应杰.竹子的观赏价值及开发利用.竹子研究汇刊,2000,19(2):13-17.
[5] 赵奇僧,汤庚国.中国竹子分类的现状和问题.南京林业大学学报:自然科学版,1993,17(4):1-8.
[9] 郭小勤,李犇,阮晓赛,娄永峰,林新春,汤定钦,方伟.利用ACGM分子标记研究10个毛竹不同栽培变种的遗传多样性.林业科学,2009,45(4):28-32.
[10] 武建云,邓玉营,丁雨龙.篌竹变种的RAPD分析.常州工学院学报,2008,21(1):59-63.
[11] 娄永峰,杨海芸,张有珍,李晓芬,林新春,方伟.部分竹类植物遗传变异的AFLP、ISSR和SRAP分析.福建林学院学报,2011,31(1):38-43.
[12] 郑蓉,郑维鹏,方伟.DNA分子标记在竹子分类研究中的应用.福建林业科技,2006,33(3):162-165.
[15] 陈龙,王家良,杨贤松.ISSR分子标记及其在植物分子生物学中的应用.种子,2007,26(10):49-52.
[17] 周延清,景建洲,李振勇,张宝华,贾敬芬.利用RAPD和ISSR分子标记分析地黄种质遗传多样性.遗传,2004,26(6):922-928.
[18] 余爱丽,张木清,陈如凯.ISSR分子标记在甘蔗及其近缘属分类上的应用.福建农林大学学报:自然科学版,2002,31(4):484-489.
[19] 杨光耀,赵奇僧.苦竹类植物RAPD分析及其系统学意义.江西农业大学学报,2000,22(4):551-553.
[20] 孙志娟,项艳,汪结明,沈周高.刚竹ISSR反应体系的正交优化.竹子研究汇刊,2007,26(4):17-21.
[21] 杨茹,孙志娟,项艳.刚竹属14个品种遗传多样性的ISSR分析.竹子研究汇刊,2010,29(4):11-14,20-20.
[22] 杨光耀,赵奇僧.用RAPD分子标记探讨倭竹族的属间关系.竹子研究汇刊,2001,20(2):1-5.
