胰腺癌特异性MR分子探针的构建及体外研究
2013-12-10童明敏TONGMingmin
童明敏 TONG Mingmin
史玉振 SHI Yuzhen
吴越霏 WU Yuefei
王中秋 WANG Zhongqiu
胰腺癌是我国比较常见的恶性肿瘤之一,恶性程度高且预后差[1],因此,早期诊断非常重要。近年随着磁性纳米粒子技术的飞速发展,MR分子靶向成像逐渐成为研究热点[2-4],Yang等[2,5]成功研制的双模态靶向探针同时具有MR成像和荧光成像双重功能,并成功完成了动物模型实验。生存素(Survivin)除在胚胎发育组织中表达外,主要在肿瘤组织中常见[6,7],如胰腺癌、肺癌、胃癌等组织,在正常的成熟组织中几乎不表达,因此,Survivin可能是早期分子水平诊断及治疗胰腺癌的理想靶标。本研究以氧化铁磁性纳米颗粒(成分γ-Fe2O3)作为MR阴性对比剂载体标志Survivin反义基因,构建靶向Survivin的胰腺癌特异性分子探针(Sur-MNPs),并完成体外细胞成像的初步研究。
1 材料与方法
1.1 实验材料 人胰腺癌细胞株BxPC-3由南京市源端生物公司提供,Survivin反义寡核苷酸(ASON)由上海生工生物有限公司合成,5'末端修饰羧基。采用Sigma RPMI-1640培养基、壳聚糖,凯基Annexin V-APC/7-AAD细胞凋亡检测试剂盒。其余试剂均为国产分析纯。CO2培养箱,净化工作台(苏州生化净化设备厂),Siemens 1.5T MRI仪,美国BioTek公司ELx800酶标仪,KC4_32分析软件,美国BD公司FACS Calibur 6.0流式细胞仪,分析采用Cell Quest Pro软件。
1.2 实验方法
1.2.1 纳米材料的制备与修饰 采用共沉淀法制备γ-Fe2O3纳米颗粒,用壳聚糖修饰MNPs,所得纳米颗粒分散于双蒸水中,调节pH=5左右,4℃保存备用。
1.2.2 靶向探针的合成及连接情况检验 取Survivin反义核苷酸加入5 μl碳二亚胺/N-羟基琥珀酰亚胺,室温振荡(200 r/min,20 min),然后与壳聚糖修饰的γ-Fe2O3磁性纳米颗粒(CS@MNPs)按1︰10和1︰30混合,继续振荡2 h,根据羧基和氨基的反应,将反义核苷酸连接到CS@MNPs表面。反应结束后用磁分离法洗涤2~3次,最终将得到的靶向探针颗粒重悬于MES缓冲液中(pH=5.5)。取上清液及Sur-MNPs分别进行2%琼脂糖凝胶电泳,并在紫外线观察仪上观察拍照。另设3-氨丙基三乙氧基硅烷修饰的纳米材料(ATPS@MNPs)与Survivin反义核苷酸以1︰30反应作为对照,对比分析CS@MNPs与反义核苷酸的连接能力。
1.2.3 细胞培养 将生长状态良好的细胞以1×104个/ml接种于6孔板,于37℃、5% CO2培养箱中培养24 h,3~4 d更换RPMI-1640培养液。
1.2.3.1 细胞活力实验 实验组为CS@MNPs,对照组为未修饰的MNPs。胰腺癌细胞分别与CS@MNPs及MNPs培养24 h后,再加入5 mg/ml MTT 20 μl,放入37℃、5% CO2培养箱中孵育4 h,用PBS洗涤2遍,每孔加入150 μl二甲基亚砜,振荡10 min使结晶充分溶解。用酶标仪测定各孔吸光度值,计算细胞存活率,比较经壳聚糖修饰前后的纳米颗粒对细胞活力的影响。
1.2.3.2 细胞凋亡实验 细胞孵育24 h后,用Annexin V-APC/7-AAD细胞凋亡检测试剂盒进行细胞染色,采用流式细胞仪检测细胞凋亡率。采用Cell Quest Pro软件,细胞仪用激发波长488 nm氩绿光激发器激发。
1.2.3.3 普鲁士蓝染色 胰腺癌细胞转染CS@MNPs、MNPs、Sur-MNPs后除去培养液,以PBS漂洗3次,4%戊二醛固定、漂洗,加入普鲁士蓝染色液(2%酸性亚铁氰化钾与2%盐酸等比例混合)孵育20 min,漂洗,核固红复染5~10 s,在光学显微镜下观察。
1.2.3.4 MRI分析 将孵育不同材料的细胞收集于EP管中,以纯净水及未孵育任何纳米材料的空白细胞作为对照,2000 r/min离心3 min,弃上清,重悬于1%琼脂糖1 ml中,并迅速吹打混匀,待冷。另外取1 ml蒸馏水于EP管中作对照。细胞悬液在1.5T MR 扫描T2WI(TR 2500 ms,TE 20 ms,16个回波,视野1.5 cm×1.5 cm),测量T2值。
2 结果
2.1 透射电镜结果 CS@MNPs大小均匀、核心粒径核心在20 nm左右。
2.2 纳米颗粒与DNA的结合能力 琼脂糖凝胶电泳结果(图1)显示在第1、2、5泳道内见明显的亮带,即CS@MNPs与反义核苷酸在比例为1∶10、1∶30时均能有效连接,电泳迁移率水平与单纯反义核苷酸相似,且两种溶液洗涤的上清液中未见亮的条带影,说明大部分反义核苷酸已连接到纳米颗粒表面;而对照组ATPS@MNPs所在泳道未见明显的条带。
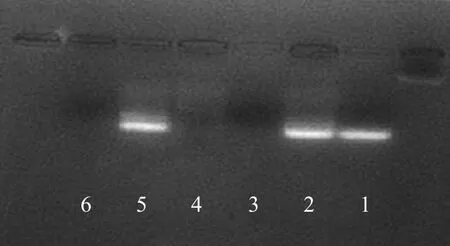
图1 琼脂糖电泳结果。第1~6泳道分别为单纯的ASON、ASON︰CS@MNPs=1︰10的溶液、ASON︰CS@MNPs=1︰10、ASON︰ATPS@MNPs=1︰30、ASON︰CS@MNPs=1︰30、ASON︰CS@MNPs=1︰30的上清液
2.3 细胞普鲁士蓝染色结果 未转染纳米颗粒的细胞内未见蓝色铁颗粒,而经纳米颗粒转染的两组细胞胞质内均见大量蓝色铁颗粒(图2)。
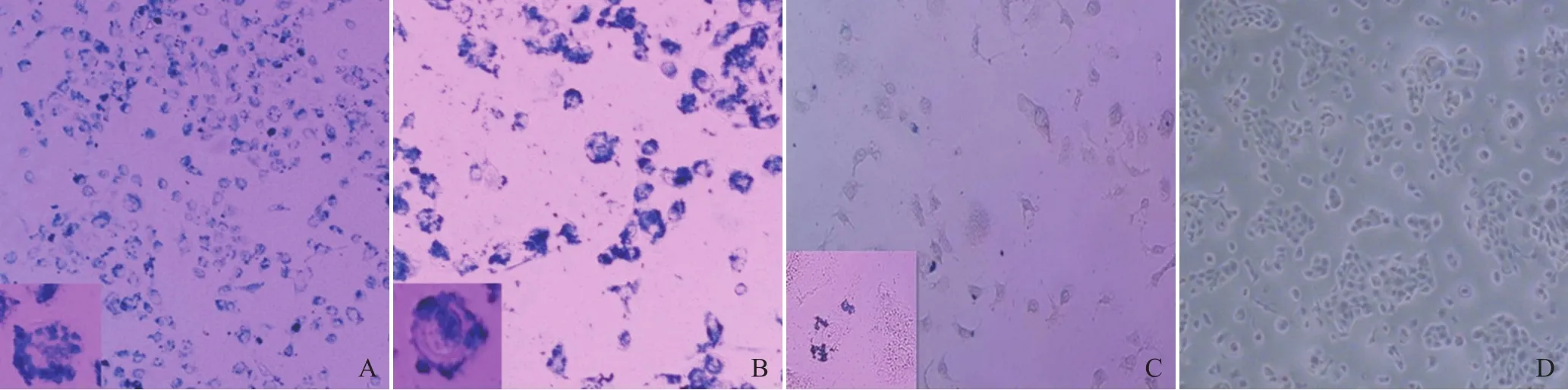
图2 细胞分别与不同纳米材料孵育24 h后的普鲁士蓝染色结果。A.细胞与CS@MNPs孵育(×200);B.细胞与靶向探针孵育(×400);C.细胞与MNPs孵育(×200);D.空白对照组,未孵育任何材料(×200)
2.4 细胞凋亡实验结果 未转染纳米颗粒、经MNPs转染和转染CS@MNPs组的细胞总凋亡率分别为34.31%、67.73%、42.88%,经MNPs转染的细胞总凋亡率高于未转染纳米颗粒和转染CS@MNPs组的细胞,见图3。

图3 细胞凋亡实验结果。A.未转染纳米颗粒的细胞组,总凋亡率为34.31%;B.转染MNPs的细胞组,总凋亡率为67.73%;C.转染CS@MNPs的细胞组,凋亡率为42.88%。细胞总凋亡率为前期凋亡+后期凋亡,即右上象限+右下象限分布的细胞
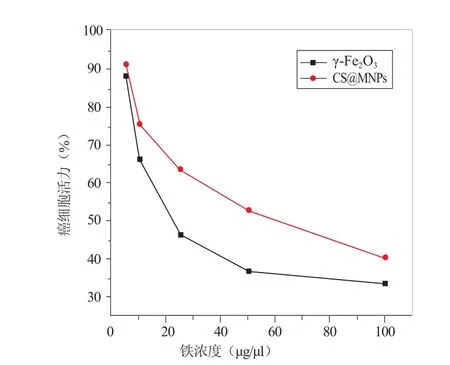
图4 细胞存活率曲线。细胞CS@MNPs和MNPs(γ-Fe2O3)分别孵育24 h(铁浓度25 μg/ml),随着溶液中铁浓度的增加,细胞活力呈递减趋势
2.5 细胞活性实验结果 细胞存活率随着纳米颗粒浓度的增加而降低,且在相同铁浓度下,MNPs孵育的细胞活力均比CS@MNPs低(图4)。铁浓度为25 μg/ml时 MNPs、CS@MNPs组的细胞活力分别为46.43%、63.68%,半数抑制浓度分别为29.63 μg/ml、56.23 μg/ml。
2.6 MR结果 随着T2时间的延长,纳米颗粒孵育的细胞信号逐渐降低(图5),空白对照组细胞、标志MNPs的细胞、标志CS@MNPs的细胞、孵育靶向探针的细胞的T2值分别为(331.5±18.3)ms、(219.5±21.8)ms、(218.0±17.3)ms、(171.7±32.5)ms。与对照组(未转染的细胞)比较,经纳米颗粒转染的两组细胞T2信号明显降低,而CS@MNPs转染的细胞信号较MNPs稍低。

图5 细胞MRI结果。A为纯净水组,B为未标志的空白细胞组(2×105个/ml),C为标志未修饰壳聚糖的MNPs纳米颗粒组,D为标志靶向探针的细胞组,E为标志CS@MNPs的细胞组
3 讨论
Survivin基因在乳腺癌、肺癌、胃癌和胰腺癌等恶性肿瘤中均呈高表达,基于Survivin基因在胰腺癌中呈高表达,而在正常组织和慢性胰腺炎组织中几乎不表达[8-10],Survivin很可能是胰腺癌诊断和治疗的一个理想靶点。有学者对磁性纳米颗粒标志细胞进行研究,并成功进行MR成像[11]。未经修饰的氧化铁纳米颗粒的稳定性及生物相容性差,需对其表面进行功能化修饰,降低细胞毒性,同时可以提供连接生物分子或药物等需要的基团,如氨基、羧基。本研究采用CS@MNPs作为成像载体,因为低分子量壳聚糖具有较好的生物相容性,能提高细胞对纳米颗粒的内吞并,降低未经修饰的MNPs对细胞的毒性,同时壳聚糖所携带的氨基为连接生物分子提供了必需的基团。经修饰后的纳米颗粒仅约20 nm,适用细胞成像[12]。此外,壳聚糖表面带正电荷,能增加与细胞膜的吸附作用,提高对细胞的转染率。壳聚糖作为DNA或药物的载体药物,可以达到靶向基因治疗或靶向药物治疗的目的[13]。
MTT细胞活力实验是衡量药物对细胞毒性作用的常用方法。本研究结果表明,随着培养基中铁浓度的增加,细胞的活力呈现递减趋势,且未修饰的MNPs细胞的活力明显低于实验组,当铁浓度高达100 μg/ml时,实验组细胞仍具有较高的活力(40.46%),说明CS@MNPs对细胞的毒性作用较小。普鲁士蓝染色结果直观地显示了纳米颗粒在细胞内的分布,胰腺癌细胞能大量地吞噬纳米颗粒,高倍镜下显示颗粒分布在细胞质内。MTT和普鲁士蓝染色结果也证明靶向探针以25 μg/ml能较好地标记胰腺癌细胞,几乎每个细胞内均能观察到纳米颗粒的分布。琼脂糖凝胶电泳结果显示靶向磁性探针研制成功后,Survivin反义核苷酸通过化学键可以稳定地连接到磁性纳米颗粒的表面。随着合成体系中纳米颗粒的比例增大,DNA的迁移速率减慢,在比例大于1︰30时较为明显,而对照组ATPS@MNPs提供的氨基不能牢固地连接Survivin反义核苷酸,故所在泳道未出现亮带影。经探针颗粒和壳聚糖孵育后的细胞能明显降低T2WI的信号。磁性靶向探针作为胰腺癌的特异性MR阴性对比剂,能较明显地降低T2弛豫时间,具有良好的临床应用前景。
本实验组研究制备的磁性纳米颗粒及靶向探针具有较好的细胞转染率及生物相容性,但是仅局限于体外细胞实验。有研究成功将DNA质粒连接至纳米颗粒表面,并实现动物肿瘤热疗的初步研究及MR成像[14]。国内外已有许多将靶向探针用于活体成像并取得初步成功的研究,本课题将继续靶向探针用于胰腺癌裸鼠原位模型的研究,观察磁性靶向探针的活体MR成像情况。
[1] Zhongqiu W, Guangming L, Jieshou L, et al. The comparative study of tumor angiogenesis and CT enhancement in pancreatic carcinoma. Eur J Radiol, 2004, 49(3): 274-280.
[2] Yang L, Mao H, Cao Z, et al. Molecular imaging of pancreatic cancer in an animal model using targeted multifunctional nanoparticles. Gastroenterology, 2009, 136(5): 1514-1525.
[3] Rudin MM, Rausch M, Stoeckli M. Molecular imaging in drug discovery and development: potential and limitations of nonnuclear methods. Mol Imaging Biol, 2005, 7(1): 5-13.
[4] Prucek R, Tuček J, Kilianová M, et al. The targeted antibacterial and antifungal properties of magnetic nanocomposite of iron oxide and silver nanoparticles. Biomaterials, 2011, 32(21):4704-4713.
[5] Yang L, Peng XH, Wang YA, et al. Receptor-targeted nanoparticles for in vivo imaging of breast cancer. Clin Cancer Res, 2009, 15(14): 4722-4732.
[6] Yang L, Cao Z, Lin Y, et al. Molecular beacon imaging of tumor marker gene expression in pancreatic cancer cells.Cancer Biol Ther, 2005, 4(5): 561-570.
[7] Liu WS, Yan HJ, Qin RY, et al. siRNA directed against survivin enhances pancreatic cancer cell gemcitabine chemosensitivity.Dig Dis Sci, 2009, 54(1): 89-96.
[8] Jiang C, Tan T, Yi XP, et al. Lentivirus-mediated shRNA targeting XIAP and survivin inhibit SW1990 pancreatic cancer cell proliferation in vitro and in vivo. Mol Med Report, 2011,4(4): 667-674.
[9] Shen YM, Yang XC, Song ML, et al. Growth inhibition induced by short hairpin RNA to silence survivin gene in human pancreatic cancer cells. Hepatobiliary Pancreat Dis Int,2010, 9(1): 69-77.
[10] Taylor A, Wilson KW, Murray P, et al. Long-term tracking of cells using inorganic nanoparticles as contrast agents: are we there yet? Chem Soc Rev, 2012, 41(7): 2707-2717.
[11] Au KW, Liao SY, Lee YK, et al. Effects of iron oxide nanoparticles on cardiac differentiation of embryonic stem cells. Biochem Biophys Res Commun, 2009, 379(4): 898-903.
[12] Kim HS, Choi Y, Song IC, et al. Magnetic resonance imaging and biological properties of pancreatic islets labeled with iron oxide nanoparticles. NMR Biomed, 2009, 22(8): 852-856.
[13] Bowman K, Leong KW. Chitosan nanoparticles for oral drug and gene delivery. Int J Nanomedicine, 2006, 1(2): 117-128.
[14] Tang QS, Zhang DS, Cong XM, et al. Using thermal energy produced by irradiation of Mn-Zn ferrite magnetic nanoparticles (MZF-NPs) for heat-inducible gene expression.Biomaterials, 2008, 29(17): 2673-2679.
