保加利亚乳杆菌产酸关键酶的研究
2013-12-06孙懿琳霍贵成
孙懿琳,方 伟,田 辉,霍贵成
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨150030)
酸牛乳在正常发酵结束后和食用前这一过程中,乳中的乳酸菌仍能继续生长,不断代谢乳糖产酸,导致酸度增加,使产品出现过酸味及其他感官质量下降的现象,表现出后酸化现象(postacidification)[1-2]。目前有采用新霉素诱变保加利亚乳杆菌筛选出H+-ATPase突变型酸敏感菌株来控制后酸化,也有采用基因突变的方法使影响β-半乳糖苷酶的基因缺失和β-半乳糖苷酶下游基因缺失,筛选弱后酸化突变菌株来降低后酸化,目前丹麦汉森公司已研制出高温条件下产酸能力强、低温条件下发酵乳糖产酸能力较弱的发酵剂,这正是理想的发酵剂;其实对于酸奶后酸化的研究除了要从酸奶的结构入手外,最有效的方法是从分子生物学角度上控制乳酸菌发酵乳糖的代谢机制,因为德氏乳杆菌保加利亚亚种是导致后酸化的主要菌株,此菌株贮存后期大量产酸与其大量代谢乳糖和葡萄糖密切相关,其中,乳糖经β-半乳糖苷酶催化,产生葡萄糖和半乳糖,葡萄糖经糖酵解途径生成乳酸和能量;而半乳糖不被利用,被排除细胞外[3-4],其中,控制乳酸菌糖代谢的关键则是控制各个代谢路径的关键酶。菌株KLDS1.1006和KLDS 1.1011为本实验室筛选出的弱后酸化菌株,但其弱后酸化机理目前还不是很清楚,菌株也没有投入生产使用,故本实验的主要目的就是从控制菌株KLDS1.1006和KLDS 1.1011发酵乳糖代谢路径的关键酶入手,通过对H+-ATPase、β-半乳糖苷酶、乳酸脱氢酶及蛋白酶的测定,找出导致其弱后酸化的根本原因,从而为直投式弱后酸化酸奶发酵剂的制备提供一定的理论指导。
1 材料与方法
1.1 材料与仪器
菌株KLDS1.1006、KLDS1.1011 为筛选出的天然弱后酸化保加利亚乳杆菌;菌株KLDS1.0207 为筛选出的后酸化较强的保加利亚乳杆菌;菌株KLDS1.1015 为从商业发酵剂分离的弱后酸化保加利亚乳杆菌,后两株均作为对照菌株;MRS培养基、11%(w·v-1)脱脂乳培养基、BCA蛋白质浓度测定试剂盒 购自碧云天公司;NADH、ONPG 购于Sigma公司;SDS、β-巯基乙醇等其他化学试剂 均为分析纯。
Delta 320精密pH计 Mettler Toledo公司;680型酶标仪 美国伯乐;DU-800紫外分光光度计 Beckman公司。
1.2 实验方法
1.2.1 H+-ATPase活性的测定
1.2.1.1 透性细胞的制备 按照Ongol等[5]的方法制备透性细胞,对其中部分步骤进行了修改。
1.2.1.2 H+-ATPase酶活力的测定 细胞膜粗提取物中蛋白质的定量采用BCA蛋白质浓度测定试剂盒检测。H+-ATPase酶的活性用U·mg-1蛋白质来表示[5-7]。
1.2.2 β-半乳糖苷酶活性的测定
1.2.2.1 胞内酶的提取 采用溶菌酶破壁法提取胞内酶[8]。
1.2.2.2 β-半乳糖苷酶活性的测定 采用ONPG比色法测定β-半乳糖苷酶酶活力。一个酶活力单位(U)定义为在 37℃条件下,每分钟释放1μmol ONPG所需要的酶量[9]。
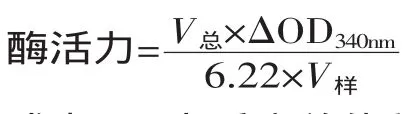
1.2.3 乳酸脱氢酶活性的测定[10]
式中:V总为反应总体积,mL;V样为样品体积,mL;△OD340nm为每分钟光密度的降低值。
1.2.4 蛋白酶活性的测定[11]用蛋白水解力(总游离氨基酸量)反映蛋白酶活力。蛋白水解力测定采用OPA试剂法。
2 结果与分析
2.1 H+-ATPase酶活力的测定
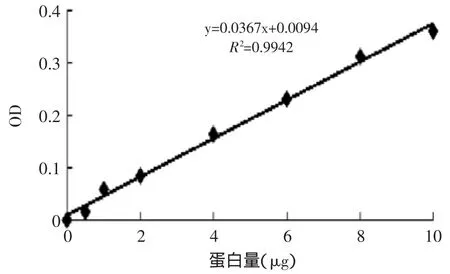
图1 蛋白标准曲线Fig.1 Protein standard curve
采用BCA蛋白浓度测定试剂盒测得牛血清白蛋白(BSA)标准曲线见图1。由图1可知蛋白标准曲线的相关系数为0.9942,说明本标准曲线的线性程度较高,可用于测定H+-ATPase活性过程中蛋白含量。
磷标准曲线如图2所示,在无机磷酸盐浓度为0.03~0.27mmol/L的范围内,相关系数为0.9982,可见本标准曲线的线性程度较高,可用于H+-ATPase活性测定过程中无机磷酸盐含量的定量。
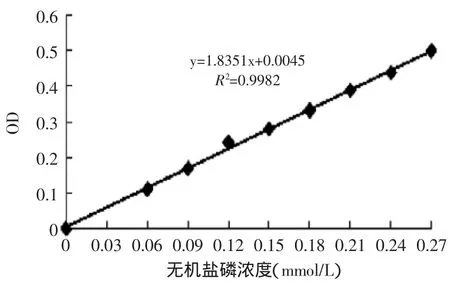
图2 磷浓度标准曲线Fig.2 Phosphorus concentration standard curve
H+-ATPase酶对调节保加利亚乳杆菌的能量代谢[12-13],增强细胞的耐酸性[14],促进乳酸菌营养物质的吸收(糖、氨基酸等)和代谢物质(柠檬酸、乳酸)的输出[15]以及菌株自身的生长及其稳定性都有重要作用,几乎所有的乳杆菌都含有H+-ATPase酶。保加利亚乳杆菌具有很强的产酸能力和耐酸性,这主要是H+-ATPase酶活的作用,当乳酸菌糖酵解产生乳酸导致外界pH降低时,胞内pH也在降低,这时菌体细胞处于酸性环境中,就会影响其正常的新陈代谢[16],而质膜中的质子泵(F1F0-ATPase)可以将胞内质子泵出胞外来提高胞内的pH,从而形成跨膜pH梯度差[17],并产生运输系统需要的质子动力势,使代谢酶的活力不受影响,H+-ATPase的这种pH调控作用增强了细胞耐酸性,采用H+-ATPase缺陷型的保加利亚乳杆菌作为发酵菌株降低酸乳贮存期的后酸化程度已得到证实[5],本实验测定了四株菌的H+-ATPase酶活如表1所示。
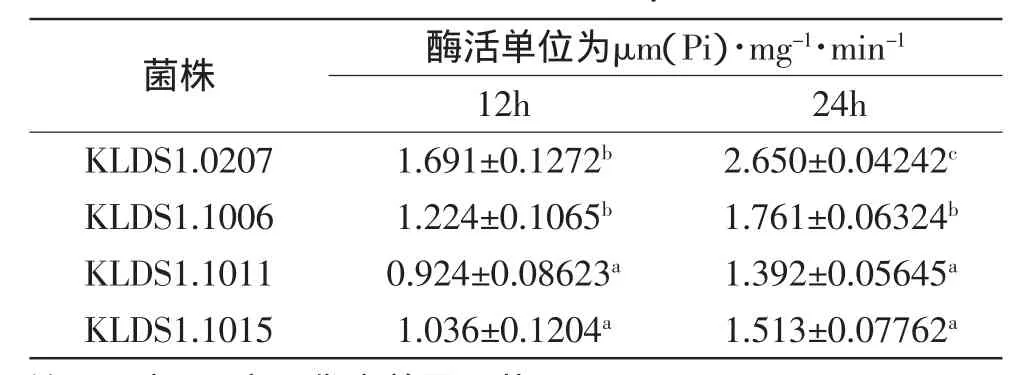
表1 菌株H+-ATPase活力的变化Table 1 The H+-ATPase activity of the strains
本实验中24h菌株的H+-ATPase酶活差异显著,其中后酸化强的KLDS1.0207酶活最高,达到2.6U/mg,而后酸化弱的其他三株菌株KLDS1.1006、1.1011和1.1015的酶活分别为1.76、1.39、1.56U/mg,可见,菌株的H+-ATPase酶活高低与其后酸化强弱之间确实存在紧密的相关性,这主要是由于H+-ATPase酶活低时,菌株代谢能力弱,不能水解足够的ATP维持菌株高强度的新陈代谢,所以菌株的耐酸性及产酸速度都较弱,从而一定程度上减缓了后酸化。可见,H+-ATPase是保加利亚乳杆菌产酸关键酶,其酶活差异可以很大程度上影响菌株的后酸化水平,且H+-ATPase较弱是造成菌株KLDS1.1006和KLDS1.1011弱后酸化的主要原因之一。Ongol等[5]和刘飞等[6]学者指出筛选出低H+-ATPase活性的菌株,可降低其耐酸性,使其生长受到抑制,从而有效减少酸乳的后酸化,本实验得出的结果与其完全相符。
2.2 低温贮存过程中pH及滴定酸度的变化
Donkor在4℃贮藏条件下对酸奶后酸化进行研究[18],认为高质量的酸奶在消费者消费时,其pH应为4.2~4.3,酸奶制品的酸度应为70.0~110.0°T之间。本实验选取4℃为贮存温度,发酵乳均在pH为6.3~6.4左右转入4℃后熟,分别测试在4℃贮藏第1d至第13d的pH和滴定酸度的变化。由图4可知四株德氏乳杆菌保加利亚亚种发酵的酸奶制品在贮存2~4d即发生后酸化,几株菌后酸化情况相差很大,其中菌株KLDS1.1006和KLDS1.1011在贮存13d后,后酸化程度较弱。
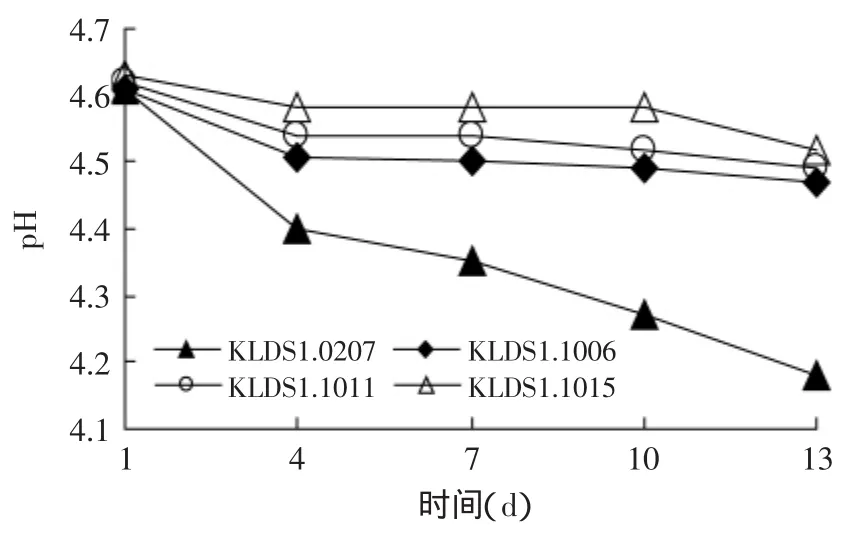
图3 贮存期间四菌株pH变化曲线Fig.3 pH curve of the four strains in the storage duration

图4 贮存期间四株菌的滴定酸度变化曲线Fig.4 Acidity curve of the four strains in the storage duration
由图3和图4可知,菌株KLDS1.1011和KLDS1.1006的后酸化情况与商业弱后酸化菌株KLDS1.1015不相上下,在贮存13d后,pH仍能维持在4.4~4.5之间,滴定酸度在80~88°T之间,增长量不足10°T;在前4d里,酸度升高pH下降趋势明显,而贮存后期变化很平缓,产酸很弱,低温贮存实验再次验证了菌株KLDS1.1011和KLDS1.1006为弱后酸化菌株。
2.3 β-半乳糖苷酶活性的测定
2.3.1 ONP标准曲线的测定 以ONP浓度为横坐标,OD值为纵坐标,绘制标准曲线,相关系数为0.9992,线性良好,结果如图5所示。
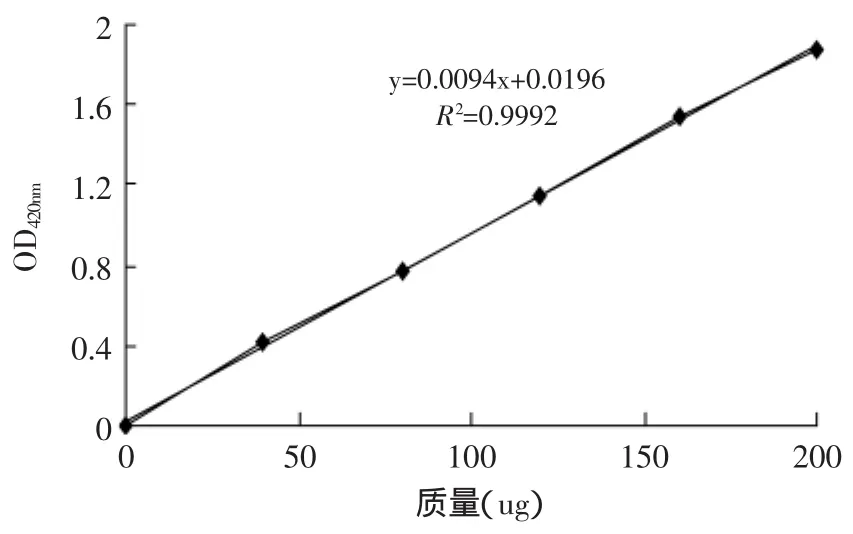
图5 ONP标准曲线Fig.5 ONP standard curve
2.3.2 蛋白标准曲线的测定 以牛血清白蛋白(BSA)为横坐标,吸光度(OD值)为纵坐标绘标准曲线,相关系数为0.9915,结果如图6所示。
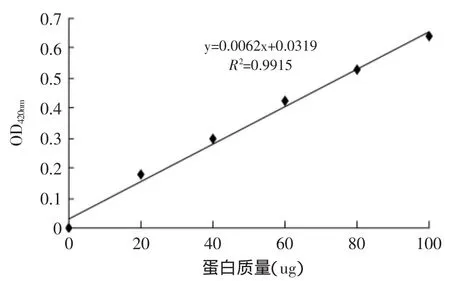
图6 蛋白标准曲线Fig.6 Protein standard curve
2.3.3 酸奶贮存期间β-半乳糖苷酶活力的变化 后酸化强弱程度不同的菌株在代谢乳糖这一步上差异很大,乳糖到葡萄糖到乳酸是产酸的关键途径,后酸化程度强的菌株乳糖代谢多,后酸化程度弱的菌株情况相反,所以分解乳糖的β-半乳糖苷酶作用重大[19]。迄今为止已经有很多通过改变保加利亚乳杆菌β-半乳糖苷酶的活性来控制发酵酸乳后酸化的研究,如令编码β-半乳糖苷酶的基因缺失或是将编码β-半乳糖苷酶的基因进行无意义的突变,或是扰乱乳糖操作子编码序列,从而改变野生菌株中β-半乳糖苷酶活性,从而一定程度上减缓后酸化水平,可见改变菌株的β-半乳糖苷酶活性可有效降低酸奶后酸化水平[20]。
由于菌株在0~2d贮存期内pH下降极快,第4d是真正决定后酸化强弱的关键一天[7],故本实验分别测试在4℃贮藏第1、4、10、13d的β-半乳糖苷酶酶活。结果如表2所示。
由表2可以看出,后酸化不同的菌株的β-半乳糖苷酶活力还是存在较大区别的,并且在贮存期间,β-半乳糖苷酶提供较大活力来代谢糖产酸,其中后酸化强的菌株KLDS-1.0207活力高,后酸化弱的菌株KLDS1.1006、KLDS1.015和KLDS1.1011活力低,对于前4d菌株产酸的关键时期,不同菌株的β-半乳糖苷酶均表现出很高的酶活,说明这时为乳糖代谢产酸的高峰期,也是β-半乳糖苷酶酶活的高峰期,对于乳糖产酸的贡献很大,这与其他学者在关于β-半乳糖苷酶在后酸化产酸过程中为关键酶的报道一致[10]。随着贮存时间的延长,菌体的物质和能量代谢受到影响,乳酸产量增多,反过来抑制了β-半乳糖苷酶的活性,使其活性逐渐下降,在贮存10~13d后,β-半乳糖苷酶酶活已降到很低,但由于环境介质的pH未降到3.5,所以β-半乳糖苷酶活性仍有剩余,仍能缓慢的代谢糖产酸,导致酸度继续增加,β-半乳糖苷酶活活性的变化与贮存期间产酸的趋势完全一致,可见β-半乳糖苷酶是菌株贮存期间的关键酶,这也进一步说明菌株KLDS1.1006和KLDS1.1011后酸化较弱的一个重要原因是贮存期间β-半乳糖苷酶活力较弱导致的。
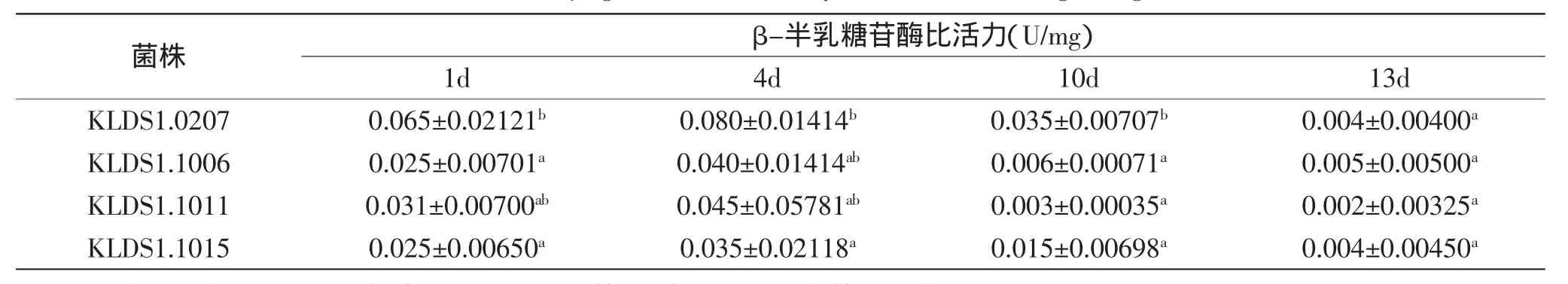
表2 贮存期间β-半乳糖苷酶活力的变化Table 2 The β-galactosidase activity of the strains during storage
有研究表明,β-半乳糖苷酶与H+-ATPase活性一致并且互相影响[6]。在糖酵解过程中,如果β-半乳糖苷酶活性较高,乳糖分解加快,葡萄糖分解为丙酮酸产生ATP的速度也加快,这正给了H+-ATPase提供了能量,从而增加了菌株细胞的代谢活性,向胞外排出更多质子,加重了后酸化。所以本实验中得到后酸化较弱的菌株KLDS1.1006和KLDS1.1011的H+-ATPase和β-半乳糖苷酶都较弱是合理的。
2.4 乳酸脱氢酶活性的测定
几乎所有的保加利亚乳杆菌都存在乳酸脱氢酶,葡萄糖经糖酵解生成的丙酮酸,在乳酸脱氢酶的作用下被分解为乳酸,因此,乳酸脱氢酶被认为是糖酵解中关键酶和限速酶,其中保加利亚乳杆菌中存在依赖于NADH的D-乳酸脱氢酶和L-乳酸脱氢酶,它们以NADH为辅酶,分别催化丙酮酸生成D-乳酸和L-乳酸。酸乳发酵过程,嗜热链球菌主要产L-乳酸,而保加利亚乳杆菌主要产D-乳酸。其中D-乳酸是导致酸乳后酸化的主要因素[21]。
本实验中一个酶活力单位定义为25℃时,每分钟氧化1μmol的NADH所需的酶量。通过对A和时间作图,计算出△A340nm/min均在0.1~0.2之间,符合要求。贮存期间菌株的乳酸脱氢酶活力变化如表3。
由表3可知,随着贮存时间的延长,不同菌株的乳酸脱氢酶的活力变化均不明显,前10d菌株KLDS1.1011和KLDS1.1006的酶活有小幅度的下降趋势,10~13d期间有一定程度的上升,但变化并不是很明显,而菌株KLDS1.0207在前10d内酶活小幅度上升,后期有所下降,且对于产酸最快的前4d来说,LDH并没有提供足够高的酶活以保证高乳酸含量的产生,贮存末期低温和酸度也没有明显的限制LDH的活力,总体来说,后酸化强弱不同的菌株之间酶活没有明显的相关性,在贮存期间糖酵解产酸通量即后发酵产酸过程与乳酸脱氢酶活性变化之间没有一致性。李琦[7]测试了嗜热链球菌单菌发酵乳在低pH贮存过程中乳酸脱氢酶的活性,结果也显示乳酸脱氢酶并不是导致后酸化的关键酶。

表3 贮存期间乳酸脱氢酶活力的变化Table 3 The lactate dehydrogenase activity of the strains during storage
2.5 蛋白酶活性的测定
菌株的蛋白水解力与生长性能有直接关系,蛋白水解力体现了乳酸菌的活力大小,菌株通过蛋白水解为自身代谢提供氨基酸和肽类,且一部分是酸奶中的风味物质或其前体[22],适度的蛋白水解可改善发酵乳的风味和品质,且产生的碱性氨基酸一定程度上可降低后酸化。本实验用蛋白水解力代表蛋白酶活力,菌株贮存期间蛋白水解活力如图7所示。
由图7可以看出,不同乳杆菌的蛋白酶活力差异较大,蛋白酶活随冷藏天数的增加总体呈上升趋势,呈现出一定的规律性,贮存末期达到最大值;其中后酸化最强的菌株KLDS1.0207蛋白水解力较弱,而后酸化较弱的菌株KLDS1.1006和KLDS1.1011蛋白水解力最强,商业发酵剂弱后酸菌株KLDS1.1015蛋白水解力最弱,这说明菌株蛋白酶活力与后酸化强弱之间并没有必然联系,因为蛋白水解受菌株个体差异的影响较大,往往正是因为菌株生物学特性的差异而影响到其蛋白分解能力[23]。
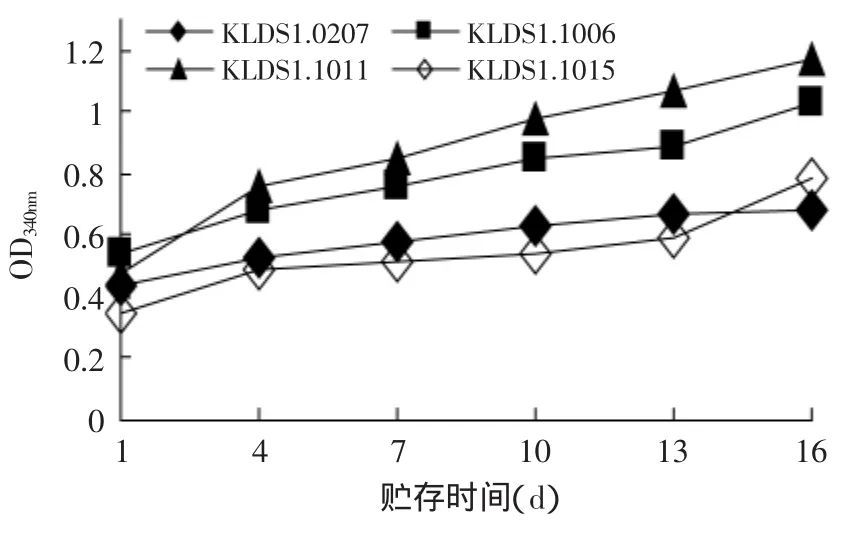
图7 贮存期间蛋白酶活力的变化Fig.7 The The Proteinase activity of the strains during storage
3 结论
3.1 菌株KLDS1.1006和KLDS1.1011后酸化较弱的重要原因就是其H+-ATPase和β-半乳糖苷酶同时较弱,其中H+-ATPase较弱使能量代谢受到影响,降低了菌株的耐酸性和产酸速率;β-半乳糖苷酶较弱可以使贮存期乳糖的代谢速率变慢,从而延长了酸奶的后酸化时间,有效的降低后酸化程度,可见菌株KLDS1.1006和KLDS1.1011可用作降低酸乳后酸化的天然发酵剂菌株,其性状稳定,操作简单,拥有广阔的市场前景。
3.2 菌株KLDS1.1006和KLDS1.1011的乳酸脱氢酶和蛋白酶与其弱后酸化之间没有表现出必然联系,可以认为这两种酶不是影响产酸和后酸化的关键酶,更不是导致菌株KLDS1.1006和KLDS1.1011弱后酸化的关键酶。
[1]徐成勇,吴昊,郑思聪,等.酸乳后酸化影响因子的初步研究[J].食品与发酵工业,2006,32(12):10-14.
[2]郭清泉,张兰威,夏秀芳.酸奶制品发生后酸化主要发酵剂菌确定及性质研究[J].食品与发酵工业,2002,28(4):24-27.
[3]郭清泉.酸奶发酵机理及后酸化控制措施[J].食品与发酵工业,2001,27(2):80-83.
[4]孟昭赫.乳酸菌与人体健康[M].北京:人民卫生出版社,1993:36-42.
[5]Ongol M P,Sawatari Y,Ebina Y,et al.Yoghurt Fermented by Lactobacillusdelbrueckiisubsp.bulgaricus H+-ATPase-Fefective Mutants Exhibits Enhanced Viability of Bifidobacterium breve During Storage[J].International Journal of Microbiology,2007,116:358-366.
[6]刘飞,杜鹏,王玉堂.保加利亚乳杆菌H+-ATPase缺陷型菌株的筛选[J].微生物学报,2009,49(1):38-43.
[7]李琦.低pH条件下嗜热链球菌产酸关键酶及控制研究[D].哈尔滨:哈尔滨工业大学,2010.
[8]NA Creenberg.Production and Characterization ofβgalactosidase from Streptococcus thermophilus[J].Food Sci,1982,47:1824-1835.
[9]郭清泉,张兰威,夏秀芳.普通酸奶制品在贮存过程中发酵剂菌的β-半乳糖苷酶活性测定及变化规律研究[J].食品工业科技,2002,23(3):34-36.
[10]HASSINA BOUMERDASSI.Isolation and Properties of Lactococcus lactis subsp.lactis biovar diacetylactis CNRZ 483 Mutants Producing Diacetyl and Acetoin from Glucose[J].Applied And Environmental Microbiology,1997:223-229.
[11]FRANK C CHURCH.Spectrophotometric Assay Using O-phthaldial dehyde for Determination of Proteolysis in milk Isolated milk proteins[J].Dairy Sci,1983,66:1219-1227.
[12]WU Jing-lan,SE LISK AR Denise M.Salinity adaptation of plasma membrane H+-ATPase in the salt marsh plant spartina patens:ATP hydrolysisand enzyme kinetics[J].Journalof Experimental Botany,1998,49:1005-1013.
[13]EI LIS Osullivan,SEAMUS Condon.Relationship between acid tolerance,cytoplasmic pH,and ATP and H+2-ATPase levels in chemostat cultures of Lactococcus lactis[J].Applied and Environmental Microbiology,1999,65(6):22872-2293.
[14]S A rja,DE LOS REYES-GAVILáN CLARA G,MARGOLLES Abelardo.The F1 F0-ATPase of Bifidobacteriumanimalisis animalis is inv olved in bile tolerance[J].Environ-mental Microbiology,2006,8(10):1825-1833.
[15]YO KOTA A,AMACHI S,ISHII S.Acid sensitivity of a mu-tant of Lactococcus lactis subsp.lactis C2 with reduced mem-brane-bound ATPase activity[J].Bioscience,Biotechnology,and Biochemistry,1995,59(10):2004-2007.
[16]KASHKET E R.Bioenergetics of Lactic acid bacteria:cytopLasmic pH and osmotolerance[J].Federation of European Microbiological Societies Reviews,1987,46:233-244.
[17]R W Hutkins,N L Nannen.pH homeostasis in Lactic Acid Bacteria[J].J Dairy Sci,1993,76(8):2354-2365.
[18]ON Donkor,A Henriksson,T Vasiljevic,et al.Effect of acidification on theactivity of probiotics in yoghurt during cold storage[J].International Dairy Journal,2006,16(10):1181-1189.
[19]郭清泉.引起酸奶制品发生后酸化的主要发酵剂菌及性质[J].食品与机械,2002,87(1):14-15.
[20]BENBADISL,BRIGNON P,GENDREF.Mutant Lactobacillus bulgaricus strains free from β -galactoside activity:US,US6875601 B1[P].2005-04-05.
[21]LE BRAS G,GAREL J.Properties of D-lactate dehydrogenase from Lactobacillus bulgaricus:a possible different evolutionary origin fortheD- and L-lactate dehydrogenases[J].FEMS Microbiology Letters,1991,79(1):89-94.
[22]吕加平,骆承庠,刘凤民.乳酸菌蛋白水解力的测定及研究[J].东北农业大学学报,1999,30(1):68-74.
[23]Samona A,Robinson R K.Enumeration of bifidobacteria in dairy products[J].Journal of the Society of Dairy Technology,1991,44:64-66.
