斑点叉尾鮰鱼皮胶原蛋白的理化特征研究
2013-12-06喻亚丽周运涛
喻亚丽,周运涛,何 力,吕 磊,庞 昆
(1.华中农业大学水产学院,湖北武汉 430070;2.中国水产科学研究院长江水产研究所,湖北武汉430223;3.中国水产科学院淡水渔业研究中心,江苏无锡214081)
胶原蛋白是动物体内含量最多、分布最广的蛋白质,是由三条肽链螺旋形成的纤维状蛋白,是细胞外基质的主要成分[1]。目前已知的超过28种胶原蛋白,多富含于动物的皮肤、骨骼、软骨、肌腱、韧带、血管、角膜中[2],而动物皮肤是胶原蛋白的主要原料来源。I型胶原蛋白由于其特殊的三螺旋结构,具有低抗原性、很好的生物相容性和生物降解性。因此,胶原蛋白在化妆品、生物制药、组织材料、生物医学材料中有着广泛应用[3]。胶原蛋白普遍存在于动物体内,在选用胶原原料来源时,要综合考虑其效能性及安全性。同哺乳动物来源的胶原蛋白相比,水生生物没有疾病传播和饮食的限制,所以人们对其来源的胶原蛋白产生了很大的兴趣[4]。有研究表明,硬骨鱼鱼皮原料具有一定的特殊性,如皮料的韧性和交联程度较低,所以鱼皮胶原蛋白远比猪皮、牛皮的胶原蛋白易于提取[5]。选用鱼类加工中产生的下脚料作为胶原蛋白提取原料,不仅能降低成本、得到更大的附加值,还具备很高的安全性。斑点叉尾鮰(Ictalurus punctatus),又名沟鲶、钳鱼,原产自北美,后在我国广泛的引种养殖。在我国水产品养殖中占有重要的份量,2010年养殖产量达到21万t。作为水产品贸易中主要的出口品种,斑点叉尾鮰一般加工成鱼片出口国外,在此过程中产生大量的下脚料。近几年鱼皮的价值被重视,充分利用鱼皮资源、开发鱼皮制品,已经成为淡水鱼下脚料综合利用的重要方面。本研究提取得到了斑点叉尾鮰鱼皮中的酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC),同时进行理化性质的分析和比较研究,为进一步开发胶原蛋白的应用提供一定的理论基础。
1 材料与方法
1.1 材料与设备
斑点叉尾鮰 武汉华南水产品批发市场;标准I型胶原蛋白、胃蛋白酶(活性3000U/mg) 博美公司;L-羟脯氨酸 索莱宝公司;蛋白标准分子量标准(高) TaKaRa公司;乙酸、HCl、NaCl、AgNO3等试剂 均为分析纯;实验所用水 均为超纯水。
恒温磁力加热搅拌器 江苏金坛市亿通电子有限公司;UV-2802PC型紫外分光光度计 尤尼柯(上海)仪器有限公司;Spetrum 100型傅里叶红外光谱仪 珀金埃尔默仪器有限公司;CR-21型高速冷冻离心机 HITACHI公司;DYY-6C型电泳仪 北京六一仪器厂;Alpha 1-4 LST型冷冻干燥机 德国CHRIST公司;DSC 821e型差式扫描量热仪 瑞士梅特勒公司。
1.2 实验方法
1.2.1 鱼皮胶原蛋白的提取
1.2.1.1 鱼皮前处理 用自来水冲洗斑点叉尾鮰,在冰上剥下鱼皮,剔除皮下结缔组织和脂肪组织。将鱼皮用蒸馏水冲洗干净,剪成0.5cm×0.5cm大小块状,保存于-20℃备用。
取一定量鱼皮,先用蒸馏水冲洗三次,除去鱼皮上残留的杂质。4℃下,以料液比1∶10(W/V)加入0.1mol/L的NaOH搅拌5h,除去鱼皮中非胶原蛋白和色素,然后冰水冲洗鱼皮至中性。加入10%正丁醇(W/V=1∶30),静置24h,以去除脂肪,冰水冲洗鱼皮至中性。
1.2.1.2 酸溶性胶原蛋白(ASC)提取 参考文献[6]的方法,并进行改进。取经过前处理的鱼皮,加入0.5mol/L的乙酸(W/V=1∶40),4℃低速搅拌24h。24h后,在5000r/min离心10min,取上清液,将未提取彻底的鱼皮再次用等量的0.5mol/L乙酸提取。用乙酸提取三次后,混合上清液,加入一定量氯化钠搅拌,至最终盐浓度为0.9mol/L。静置过夜,5000r/min离心10min后弃上清液。再将沉淀溶于0.5mol/L乙酸,8000r/min离心20min除去不溶性杂质。经三次盐析后,将沉淀溶解于0.1%乙酸溶液中,用三蒸水进行透析,直至用10g/L AgNO3检测不到Cl-为止,然后对透析过的胶原蛋白溶液进行冷冻干燥,得到酸溶性胶原蛋白。
1.2.1.3 酶溶性胶原蛋白(PSC)提取 将1.2.1.1前处理过的鱼皮,加入0.5mol/L的乙酸(W/V=1∶40)和0.1%(M/V)胃蛋白酶,4℃低速搅拌24h。5000r/min离心10min,取上清液。依次进行盐析、透析、冷冻干燥得到酶溶性胶原蛋白。
1.2.2 胶原蛋白纯度的测定 参考文献[7]的方法,并进行改进。称取一定量的胶原蛋白,加入6mol/L HCl(W/V=1∶100),于110℃水解24h。取1mL水解液,采用对二甲基氨基比色法[8]测定样品液中羟脯氨酸含量,将羟脯氨酸含量乘以换算系数,即得到实际提取得到的纯胶原蛋白的含量。按下式计算胶原蛋白纯度:
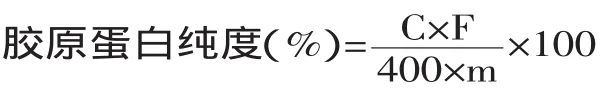
式中:C为羟脯氨酸质量浓度(μg/mL);m为样品质量(g);F为11.1换算系数。
1.2.3 紫外吸收光谱分析 参考郭恒斌等[9]的方法,将一定量的斑点叉尾鮰鱼皮胶原蛋白溶于0.5mol/L的乙酸中,配制成0.05%的胶原乙酸溶液,以0.5mol/L的乙酸作为空白对照。室温下,使用紫外分光光度计,在190~400nm近紫外光区进行扫描。
1.2.4 傅里叶红外光谱分析 在干燥的条件下,取冻干的胶原蛋白样品1mg,经KBr压片,用Spetrum 100红外光谱仪对样品进行红外扫描。扫描范围为4000~550cm-1,扫描次数为32次。
1.2.5 SDS-PAGE电泳测定 参考Laemmli[10]SDSPAGE电泳方法分析胶原蛋白样品,分离胶浓度7.5%、浓缩胶浓度5%。将提取的冻干胶原蛋白,配制成2mg/mL的胶原蛋白溶液。以1∶1的比例,取7.5μL胶原蛋白溶液分别加入7.5μL含有10%(V∶V)β-巯基乙醇的2×样品处理液(将SDS、甘油、溴酚蓝溶于0.5mol/L Tris-HCl缓冲液中)和7.5μL未加β-巯基乙醇的2×样品处理液配成1mg/mL的溶液,100℃煮沸5min。电泳上样15μL,直流稳压,蛋白样品在浓缩胶中时的电压为100V,进入分离胶后调至160V。电泳结束后,将凝胶放入0.2%考马斯亮蓝染液(水∶95%乙醇∶冰醋酸=5∶4∶1,V∶V∶V)进行染色1h;然后在脱色液(医用酒精∶冰醋酸∶水=9∶1∶10,V∶V∶V)中脱色24h,至背景清晰。
1.2.6 热变性温度的测定 使用差式扫描仪测定样品的变性温度。取一定量的冷冻干燥的胶原蛋白以1∶40的料液比,加入0.05mol/L醋酸,使之水化(胶原蛋白水化物变性温度分析时,最多可以在4℃保存2d)。取5~10mg样品放于坩埚中,平铺,加盖密封,以空坩埚作为对照,扫描温度范围为20~50℃,升温速率为1℃/min,样品室氮气流量为20mL/min。DSC谱图中峰值对应的横坐标即为胶原蛋白的热变性温度。
2 结果与分析
2.1 胶原蛋白的纯度测定
胶原蛋白提取过程中,酸性条件会破坏胶原分子间的盐键和Schiff键,引起胶原纤维膨胀、溶解,后通过盐析的方法能够提取得到粗胶原蛋白。由于胶原蛋白分子内和分子间有紧密的交联,延长酸提取的时间可以提高胶原蛋白的溶解量。Elzbieta Skierka[11]的研究中,使用乙酸、乳酸和盐酸进行鱼皮胶原蛋白的提取,发现0.5mol/L乙酸的提取胶原蛋白量较高。本实验中,酸溶性胶原蛋白提取时,每次24h分3次乙酸对斑点叉尾鮰鱼皮进行提取,鱼皮能够全部溶解,得到较高产率的酸溶性胶原蛋白。酶溶性胶原蛋白提取时,由于胃蛋白酶催化水解胶原蛋白的端肽,降低了胶原蛋白分子内部的交联,在酸性条件下24h即可完全溶解得到具有完整三螺旋结构的酶溶性胶原蛋白。提取过程中,鱼皮上的色素也大量溶解于乙酸中,通过多次盐析和提高转速的方法,能够将色素和杂质去除,得到纯度较高的胶原蛋白。
按1.2.2方法测定羟脯氨酸标准样品的吸光度,得其回归方程为:A=0.0679C+0.0003,相关系数R2=0.9996(A代表吸光值,C代表羟脯氨酸浓度)。按回归方程计算得ASC和PSC羟脯氨酸质量浓度为分别为1.677、1.684μg/mL,计算得ASC纯度为93.11%,PSC纯度为93.46%。提取得到的ASC和PSC纯度均高于周爱梅等[12]提取的罗非鱼皮Ⅰ型胶原蛋白纯度的84.61%,而低于林琳[13]提取的鳕鱼皮和鱿鱼皮胶原蛋白纯度的98%。不同的研究中,提取得到的胶原蛋白的纯度具有一定的差异性,这可能是由于提取方法中料液比、提取温度、原料等因素的不同造成的。本实验中提取的胶原蛋白的纯度较高,该结果在紫外吸收光谱分析和SDS-PAGE结果中得到验证。
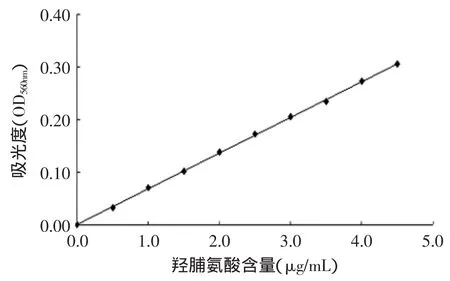
图1 羟脯氨酸标准曲线Fig.1 Standard curve of hydroxyproline
2.2 ASC、PSC紫外吸收光谱
图2为标准I型胶原蛋白的紫外吸收光谱,吸收峰在234nm处;图3为提取得到的ASC和PSC扫描获得的紫外吸收光谱,紫外吸收波峰均在233nm处。斑点叉尾鮰鱼皮胶原蛋白的吸收峰位置和标准I型胶原蛋白相近,初步判断符合I型胶原蛋白的特征[14]。
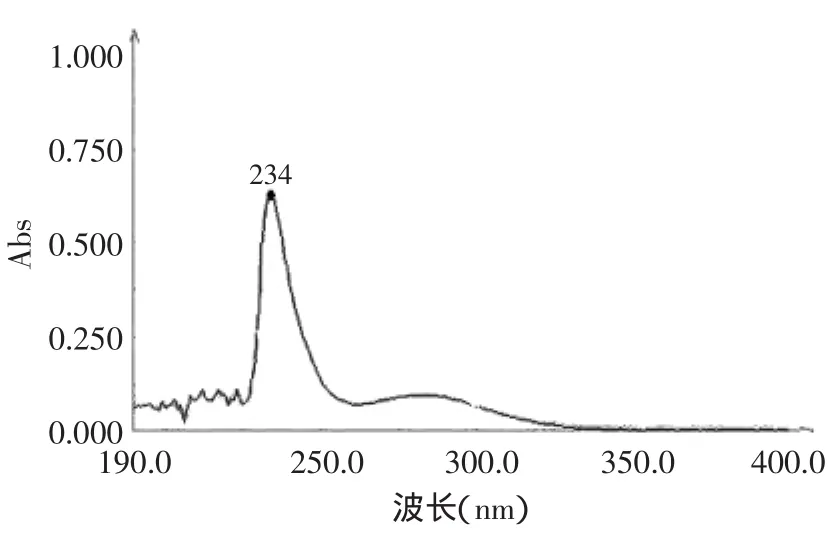
图2 标准I型胶原蛋白紫外吸收光谱Fig.2 UV spectrum of collagen type I
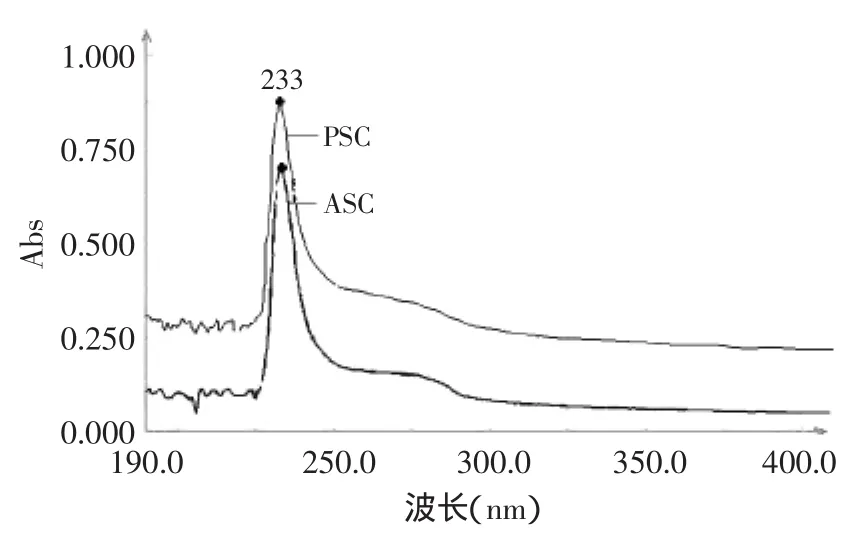
图3 斑点叉尾鮰鱼皮ASC和PSC紫外吸收光谱图Fig.3 UV spectrum of ASC and PSC from channel catfish skin
不同于一般的蛋白质,胶原蛋白组成中由于只含有少量芳香族氨基酸,在280nm处基本无吸收,而胶原肽链所含的C=O、-COOH、CONH2都是生色基团,可在220nm附近产生较强的紫外吸收[15]。提取得到的胶原蛋白在280nm处只有很弱的吸收,说明芳香族氨基酸含量很低。同时,也表明通过该方法提取得到的胶原蛋白杂蛋白含量少,纯度很高。段宙位等[7]研究的罗非鱼尾胶原蛋白的紫外最大吸收峰为232.35nm,辛菲等[16]研究的鲅鱼皮酸溶性胶原蛋白的最大吸收峰为227nm,均与本实验结果一致。由于胶原蛋白来源不同,从而氨基酸种类和含量的差异,使胶原肽链所含的生色基团有所不同,从而导致不同来源的胶原蛋白紫外吸收波峰存在一定的不同。
2.3 ASC、PSC傅里叶红外光谱
由图4和表1可知,斑点叉尾鮰鱼皮酸溶性和酶溶性胶原蛋白的吸收波峰具有一定的相似性。ASC和PSC的酰胺A分别在3301cm-1和3313cm-1处,该条带的出现与N-H伸缩振动有关,也表明了氢键的存在。Doyle等[17]的研究表明,自由的N-H伸缩振动一般在3400~3440cm-1处,当肽键中的N-H基团包含在氢键中时,其振动的波数会下降。酰胺B出现于2927cm-1和2948cm-1,这是胶原蛋白常出现的波数,同Phanat Kittiphattanabawon[18]研究的结果一致。
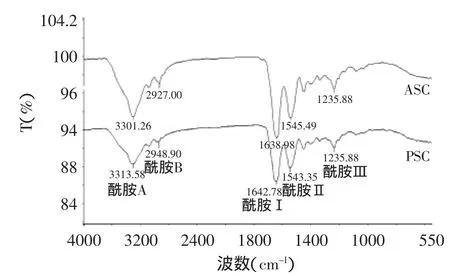
图4 ASC和PSC傅里叶红外吸收光谱Fig.4 FTIR spectra of ASC and PSC from skin of channel catfish skin

表1 斑点叉尾鮰鱼皮ASC和PSC红外光谱特征吸收峰的位置及说明Table 1 Fourier transform infrared spectroscopy spectra peaklocations and assignment of ASC and PSC from channel catfish skin
ASC和PSC的酰胺I出现在1638cm-1和1642cm-1处,表示了C=O的伸缩振动,该条带和蛋白质的二级结构有关。这两种胶原蛋白的酰胺Ⅱ出现在1545cm-1和1543cm-1处,这是由N-H的弯曲振动和C-N的伸缩振动引起的。同时,ASC和PSC的酰胺Ⅲ均在1235cm-1处,该波数同1454cm-1的比值大约为1,表明了三级螺旋结构的存在[19]。ASC和PSC的红外吸收结果部分有所不同,这可能是由胃蛋白酶剪切掉的非螺旋区域引起的。因此,FTIR说明了斑点叉尾鮰鱼皮ASC和PSC具有特殊的三级螺旋结构和相似的二级结构。斑点叉尾鮰鱼皮胶原蛋白的傅里叶红外图谱同易继兵[6]从狮子鱼皮中提取的胶原蛋白的红外图谱相似,但吸收波峰略有不同,这可能是由于原料的不同、提取的胶原蛋白中所含的色素杂质等因素造成,也有可能是在鱼皮胶原蛋白在提取过程中有少部分结构发生变化所致。
2.4 电泳分析
图5电泳图中,ASC和PSC是由α1和α2组成,其中从光密度来看α1和α2的比率为2∶1,因此胶原蛋白的组成应该为(α1)2α2。这种结构符合已知报道的真骨鱼胶原含有两条[20-21]或者三条[22]不同的链,斑点叉尾鮰鱼皮胶原蛋白的电泳图谱同Prabjeet Singh[3]研究的条纹鲶鱼鱼皮的胶原蛋白的电泳图谱相似,可以确定其为I型胶原蛋白。
电泳图5中β为两条肽链的二聚体,γ为三条肽链螺旋在一起的三聚体。ASC的β、γ链亮度强于PSC,而α弱于PSC,表明ASC的分子内和分子间的交联高于PSC[23]。这证明了在低温条件下,胃蛋白酶可以切掉胶原的端肽,从而使胶原分子在电泳的前处理阶段更容易以肽链的形式出现,大部分解旋为α链。ASC和PSC的α链的电泳迁移率相近,表明胃蛋白酶的切割位点靠近原胶原蛋白的非螺旋末端。β、γ链含量较高,也可以充分说明低温下,乙酸法提取和乙酸-胃蛋白酶提取方法均可以较好的保持胶原蛋白的结构完整性。比较ASC和PSC的电泳图谱,两种样品的电泳图一致,是否添加β-巯基乙醇对胶原蛋白的肽链无影响。说明在ASC和PSC在三螺旋区缺乏二硫键,这与胶原蛋白氨基酸组成中缺乏半胱氨酸的结论是一致的。
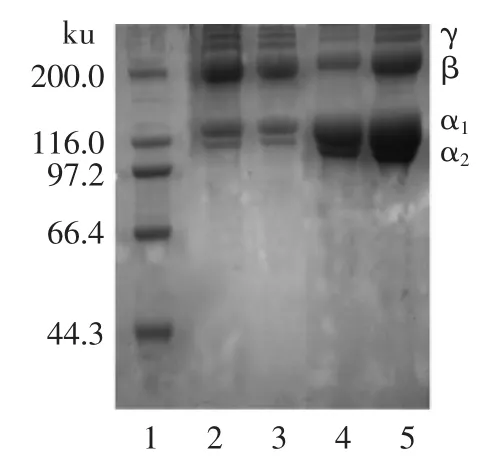
图5ASC和PSC SDS-PAGE图Fig.5 SDS-PAGE patterns of ASC and PSC fromchannel catfish skin
2.5 变性温度测定
斑点叉尾鮰鱼皮胶原蛋白的变性温度见图6。其中ASC的变性温度为34.2℃,PSC为33.9℃。斑点叉尾鮰鱼皮胶原蛋白的变性温度高于虹色金线鱼的33.35℃[2],低于曹军鱼ASC的38.17℃和PSC的36.03℃[24],接近于草鱼皮ASC的33.8℃和PSC的34.5℃[25]。不同来源胶原蛋白的变性温度是由其亚氨基酸、体温和环境温度共同决定的[26]。一般冷水性鱼类的胶原蛋白的羟脯氨酸的含量比暖水性鱼类高,同时热变性温度也较低[27]。本实验中斑点叉尾鮰鱼皮胶原蛋白的变性温度也同该结论相一致。PSC的主要结构是肽链的三螺旋结构,而在ASC中除了包含三螺旋结构还包含有部分非螺旋的肽链[28]。斑点叉尾鮰鱼皮胶原蛋白变性温度测定中,PSC热焓值(△H=0.8759J/g)远远高于ASC(△H=0.1855J/g)。这可能是由于胃蛋白酶的处理切除了PSC末端的肽链,需要更多的能量来使PSC的结构更加有序,所以热焓值也高于ASC。
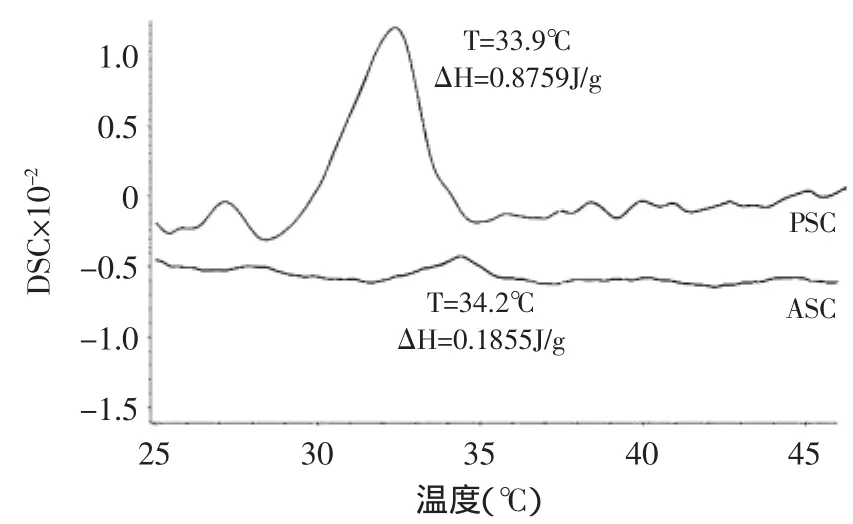
图6ASC和PSC的DSC温度曲线图Fig.6 DSC thermogram of ASC and PSC fromchannel catfish skin
3 结论
本研究中,低温条件下,使用乙酸溶液提取和胃蛋白酶提取的方法,从斑点叉尾鮰鱼皮中提取胶原蛋白并对其理化特性进行分析。
傅里叶红外测定表明,ASC和PSC均在1235cm-1处具有吸收峰,表明其具有完整的三螺旋结构。研究表明胶原蛋白具有低免疫原性,而其免疫原性部分来自于端肽。由于胃蛋白酶催化水解了胶原的端肽非螺旋区,而对螺旋区无作用,这样溶解的胶原仍具有完整的三螺旋结构,更降低了胶原的抗原性,具有良好的生物相容性[1]。酶溶性胶原蛋白在生物医用材料、制药和功能食品等方面具有更好的应用潜能。但是对应用于组织工程领域的胶原材料,则应保留其端肽,目的是保存其交联位点,赋予组织材料所需的完整结构。因此,将ASC和PSC的理化性质进行分析,胶原蛋白生物相容性方面的研究提供一定的理论基础。
目前,在食品工业中水产胶原蛋白应用较多的是鱼皮胶原蛋白,利用鱼皮胶原蛋白可以生产新型的胶原多肽、氨基酸口服液、胶原蛋白饮料等。由于斑点叉尾鮰生长环境温度和鱼皮氨基酸组成的影响,使其变性温度低于猪、牛等哺乳动物胶原蛋白的变性温度,导致其应用受到一定的限制。Sionkowska[29]研究表明较短时间的紫外照射可以使胶原分子之间形成更多的交联结构,提高其热变性温度。任俊莉等[30]研究发现使用戊二醛对胶原蛋白进行交联处理,可使其热稳定性提高。因此,采用一定的物理化学方法对胶原蛋白进行处理,可以提高其热稳定性,使其在食品包装、食品添加剂等方面有更广泛的应用。
[1]汤克勇.胶原物理与化学[M].北京:北京科学出版社,2012:161-168.
[2]Kanokwan Matmaroh, Soottawat Benjakula, Thummanoon Prodpran,et al.Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish(Parupeneus heptacanthus)[J].Food Chemistry,2011,129:1179-1186.
[3]Prabjeet Singh,Soottawat Benjakul,Sajid Maqsood,et al.Isolation and characterisation of collagen extracted from the skin of stripedcatfish(Pangasianodon hypophthalmus)[J].Food Chemistry,2011,124:97-105.
[4]Zunying Liu,Alexandra CM Oliveira,YinCheng Su.Purification and characterization of pepsin-solubilised collagen from skin and connective tissue of giant red sea cucumber(Parastichopus californicus) [J].Journal of Agricultural and Food Chemistry,2010,58(2):1270-1274.
[5]王卫东,李超,孙月娥.鱼皮明胶的制备、特性及应用[J].食品科学,2009,30(20):484-485.
[6]易继兵,李八方,赵雪,等.狮子鱼皮胶原蛋白的提取及理化性质研究[J].食品工业科技,2012,31(4):65-70.
[7]段宙位,申铉日,陈秀明,等.罗非鱼尾胶原蛋白的提取与鉴定[J].食品科学,2012,33(6):59-64.
[8]Phanat Kittiphattanabawona, Soottawat Benjakul, Wonnop Visessanguan,et al.Isolation and Characterisation of collagen from the skin ofbrownbandedbambooshark(Chiloscyllium punctatum)[J].Food Chemistry,2010,119(4):1519-1526.
[9]郭恒斌,曾庆祝,闫磊,等.分光光度法测定鱼皮中羟脯氨酸含量[J].现代食品科技,2007,23(7):81-83.
[10]Laemmli UK.Cleavage of structural proteins during assembly of head of bacteriophage T4[J]:Nature,1970,277:680-685.
[11]Elzbieta Skierka,Maria Sadowska.The influence of different acids and pepsin on extractability of collagen from the skin Baltic cod(Gadus morhua)[J].Food Chemistry,2007,105:1302-1306.
[12]周爱梅,张培丽,刘欣,等.淡水鱼皮胶原蛋白提取优化工艺研究(Ⅱ)[J].食品科技,2007,33(1):113-117.
[13]林琳.鱼皮胶原蛋白的制备及胶原蛋白多肽活性的研究[D].青岛:中国海洋大学,2006.
[14]赵苍碧,黄玉东,李艳辉.从牛腱中提取胶原蛋白的研究[J].哈尔滨工业大学学报,2004,36(4):516-519.
[15]Lin Yung-kai,Liu Deng-cheng.Comparison of physicalchemical properties of type I collagen from different species[J].Food Chemistry,2006,99:244-251.
[16]辛菲,李华,罗星,等.鲅鱼皮酸溶性胶原蛋白提取及分子特性的初步研究[J].新疆农业科学,2012,49(1):122-126.
[17]Doyle B B,Blout E R,Bendit EG.Infrared spectroscopy of collagen and collagen like polypeptides[J].Biopolymers,1975,14(5):937-957.
[18]Phanat Kittiphattanabawon, Soottawat Benjakul, Wonnop Visessanguan,et al.Isolation and Characterization of collagen from the skin of brownbanded bamboo shark(Chiloscyllium punctatum)[J].Food Chemistry,2010,119:1519-1526.
[19]Plepis A M D G,Goissis G,Das-Gupta DK.Dielectric and pyroelectric characterization of anionic and native collagen[J].Polymer Engineering and Science,1996,36(24):2932-2938.
[20]Nagai,Takeshi,Araki,et al.Collagen of the skin of ocellate puffer fish(Takifugu rubripes)[J].Food Chemistry,2002,78:137-177.
[21]Kimura S,OhnoY,MiyauchiY,et al.Fish skin type I collagen:wide distribution of an α3subunit in teleosts[J].Comparative Biochemistry and Physiology,1987,88B(1):27-34.
[22]AOAC.Official methods of analysis(16th Ed)[M].Washington,DC:Association of Official Analytical Chemists,1995.
[23]Nalinanon S,Benjakul s,Visessanguan W,et al.Use of pepsin for collagen extration from the skin of bigeye snapper(Priacanthus tayenus)[J].Food Chemistry,2007,104(2):593-601.
[24]杨树奇.军曹鱼鱼皮胶原蛋白的提取及其功能特性的研究[D].广州:广东海洋大学,2010.
[25]张建忠,安辛欣,王林,等.草鱼皮酸溶性和酶溶性胶原蛋白的提取及性质[J].食品科学,2006,27(12):556-559.
[26]Phanat Kittiphattanabawon, Soottawat Benjakul, Wonnop Visessanguan,et al.Isolation and Characterisation of collagen from the skin of brownbanded bamboo shark(Chiloscyllium punctatum)[J].Food Chemistry,2010,119:1519-1526.
[27]Muyonga J H,Cole C G B,Duodu K G.Characterisation of acid soluble collagen from skins of young and adult Nile perch(Lates niloticus)[J].Food Chemistry,2004,85(1):81-89.
[28]D Hickman,T J Sims,C A Miles,et al.Isinglass/collagen:denaturation and functionality[J].Journal of Biotechnology,2000,79(3):245-257.
[29]Sionkowska A.Thermal denaturation of UV-irradiated wet rat tail tendon collagen[J].International Journal of Biological Macromolecules,2005,35:145-149.
[30]任俊莉,付丽红,邱化玉.胶原蛋白的应用及其发展前景[J].中国皮革,2004,33(1):36-38.
