应用囊胚互补系统从多潜能干细胞再生肾脏
2013-12-06UsuiJ论著黄梁浒编译
UsuiJ 论著 黄梁浒 编译
器官短缺已成为移植的主要瓶颈,而再生医学为可移植器官提供了可能。器官发育过程中细胞之间的相互作用十分复杂,无法在体外进行重复。为了解决这个难题,Usui等曾在Pdx1-/-小鼠体内利用囊胚互补作用,成功将外源多潜能干细胞(pluripotent stem cell,PSC)分化发育形成胰腺。在该新生胰腺中,整个胰腺几乎是外源PSC发育而成。同时,该胰腺能产生包括胰岛素在内的多种激素,从该胰腺分离出来的胰岛能明显降低糖尿病小鼠的血糖。因此,该研究小组进一步假设:通过基因操作技术,将小鼠囊胚制作成一个确定已无法发育成器官的突变小鼠囊胚,并将外源PSC导入其中,通过囊胚中残留发育微环境(niche)的互补作用使得这些外源PSC得以分化发育,重新形成器官。
Sall1是spalt基因(果蝇属)的同源基因,只在哺乳动物中表达。Sall1基因平时处于关闭状态,在胚胎发育时才会打开,只在胚胎期和新生期的肾间质中表达。该基因不仅是肾间质与输尿管芽之间相互吸引、相互作用时必需的,而且是上述两者相互作用后肾间质生长、分化发育所必需的。如果Sall1基因缺陷,则会造成小鼠因肾脏发育不全而出生不久死亡。另一方面,不依赖Sall1基因的组织器官,如输尿管、膀胱等都能正常发育。该研究小组利用该项实验技术,观察将外源胚胎干细胞(embryonic stem cell,ESC)或诱导多潜能干细胞(induced pluripotent stem cell,iPSC)导入 Sall1-/-小鼠囊胚能否再生出新的肾脏。结果令人振奋,除了不受Sall1基因调控的集合管、微血管外,外源小鼠的PSC成功分化发育成新的肾脏,表明囊胚可被用来重新形成肾脏。
该小组首先将外源ESC导入受体小鼠囊胚,结果发现:Sall1+/+小鼠的新生子代肾脏均为红色,表明其来源于DsRed标记的外源ESC;Sall1+/EGFP小鼠的新生子代肾脏为黄色,表明其是由EGFP阳性的受体鼠来源细胞(绿色)与导入的ESC来源细胞(红色)整合而成;而未注入外源ESC的Sall1+/EGFP小鼠的新生小鼠肾脏只出现EGFP阳性的细胞。同时,Sall1EGFP/EGFP小鼠的新生子代肾脏整体显示红色,且大小正常,提示这些细胞均是由DsRed标记的ESC发育而来;但该小鼠的集合管呈绿色,提示由受体鼠囊胚细胞发育而来,且其不表达Sall1基因。以上结果得到流式细胞仪检测分析和PCR基因鉴定的证实。进一步实验说明,Sall1EGFP/EGFP和Sall1+/EGFP小鼠中注入外源ESC后,这些ESC不能发育成肾脏实质细胞,只能发育为肾上腺、输尿管、膀胱、脂肪等非肾脏组织,充分说明Sall1EGFP/EGFP小鼠肾脏是通过外源ESC和受体鼠囊胚的互补共同发育而成。HE和PAM染色结果显示,Sall1EGFP/EGFP小鼠的子代鼠肾组织(外源ESC分化而来)肾小球毛细血管袢和基底膜均发育正常,肾小球足细胞和鲍曼囊(Bowman’s capsule)内皮细胞界限清晰。另外,外源ESC可以分化发育为多种不同的肾组织谱系细胞,表明利用囊胚互补技术是可以将外源性ESC分化发育成肾脏。
其次是用iPSC代替ESC,实验证实也可在受体小鼠囊胚中分化发育形成肾脏。利用Sall1基因敲除小鼠囊胚,将携带EGFP基因的iPSC注入其中,结果发现,Sall1+/-或Sall1+/+新生嵌合小鼠肾脏部分显示绿色荧光,提示这些细胞是由携带EGFP基因iPSC分化而来的细胞和受体鼠囊胚本身细胞共同组成;相反,Sall1-/-新生嵌合小鼠表达更多、更强绿色荧光,表明其肾脏完全由外源iPSC分化而来,同时其肾脏大小、外观基本正常。另外,外源iPSC分化发育而来的膀胱充满尿液,且其紧邻肾脏,表明该肾脏能和膀胱正常相连,功能正常。在导入EGFP-iPSC的Sall1+/-和Sall1-/-嵌合小鼠中,发现这些iPSC还能分化发育成非肾脏组织,包括肾上腺、输尿管、膀胱、肌肉和脂肪组织,外源性iPSC在小鼠胚胎中分化发育成何种组织细胞,依赖于小鼠和iPSC的嵌合程度。对外源性iPSC分化发育成的肾脏进行组织学分析,iPSC + Sall1+/-和Sall1-/-嵌合新生小鼠肾组织中可见正常的肾皮质、髓质结构,荧光显微镜下基本呈绿色(EGFP);肾小球毛细血管袢和基底膜形态正常;肾小球小体结构明晰,开口于球旁尿液连接结构。超微结构显示,肾小球3层结构完整,即有上皮细胞足突层、基底膜层、带过滤孔的血管内皮细胞层。以上结果提示这些小鼠肾脏组织学结构完整,功能正常,进一步显示了通过囊胚的互补作用可以让外源性iPSC分化发育再生出新的肾脏。
为了证实上述结论,作者比较和分析了不同嵌合小鼠的免疫组织化学结果,发现导入外源iPSC的Sall1+/+和Sall1+/-嵌合新生小鼠后肾间质,包括每个肾单位的足细胞,均包含EGFP阳性和阴性2种细胞;贯穿肾脏的整个发育过程,肾单位祖细胞、后肾间质的上皮细胞(凝集间质、前小管聚集体、逗状小体、S形小体和成熟的肾小球、近曲小管、远曲小管)均十分相似。此外,其他后肾间质成份(鲍曼囊、近曲小管、远曲小管的上皮细胞)也显示出为EGFP阳性和阴性2种足细胞的混合状态。对导入外源iPSC的Sall1-/-嵌合小鼠肾组织进行免疫组织化学分析显示,其后肾间质(凝集间质、前小管聚集体、逗状小体、S形小体和发育成熟的肾小球、近曲小管、远曲小管)均来源于iPSC);大部分肾实质(肾皮质、髓质、包膜)也来自iPSC集合管,输尿管则由输尿管芽发育而成,也就是说,这些组织细胞的发育不受Sall1基因所调控。肾皮质、髓质和表达Liv2基因的肾包膜均被外源性iPSC分化发育的EGFP阳性细胞所替代;泌尿脉管系统的所有血管内皮细胞(包括动脉、小动脉、肾小球微动脉、毛细胞血管、小静脉)均显示为嵌合结构状态,肾小球系膜(非血管壁平滑肌细胞)来源于iPSC,但所有血管周围神经均不是iPSC发育成的。这些结果表明:尽管外源iPSC可作为肾实质细胞生长发育的种子细胞,但集合管上皮、肾间质成份(包括血管、神经)是由iPSC和受体小鼠囊胚共同发育而成。
以往该研究小组曾经应用该项技术,将大鼠iPSC导入Pdx1-/-小鼠胚胎后,成功培育出大鼠胰腺。同时作者曾将大鼠iPSC导入Sall1-/-小鼠囊胚,但未能成功发育为肾脏。如果参与小鼠后肾间质和输尿管芽之间作用的关键性分子,并不能在大鼠ESC或iPSC分化发育发挥类似作用,那么寻找一个真正缺失所有和肾脏分化发育相关细胞的小鼠囊胚(受体小鼠)已成为必要。尽管如此,该项研究成功应用受体小鼠囊胚的互补作用,将导入的外源iPSC再生成具有完整功能的小鼠肾脏,该系统为肾脏发育提供了一种新思路,同时也为肾脏发育的细胞与分子机制展示了一个新的视野。
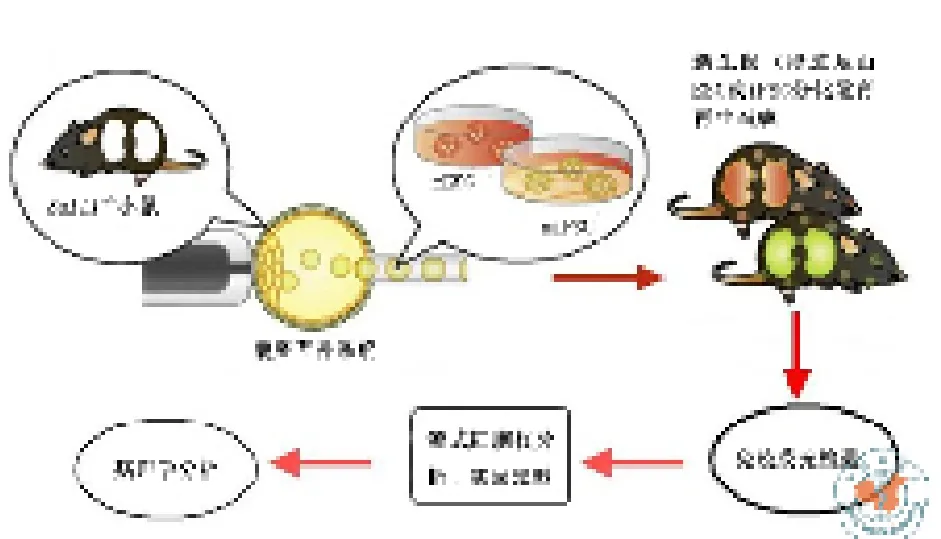
ESC或iPSC导入囊胚系统再生成肾脏示意图
