“毛细管区带电泳同时分离BSA与单链DNA”开放实验
2013-11-23刘弘洋吴景刚
屈 锋,刘弘洋,吴景刚
(北京理工大学 生命学院,北京 100081)
1 实验选题的意义
现代分析化学方法及技术的应用是当今科学技术和经济发展的重要基础,也是衡量一个国家科学技术发展水平的重要标志之一。当今的生物、医学、食品、农业、环境等众多学科领域的前沿研究,无一不是以现代分析化学的方法和技术为基础和手段(如人类基因测序、蛋白质组学研究、食品安全检测、环境保护监测等),因此学习现代分析化学基本方法和实验技能对于多学科基础研究和多行业实际应用具有极其重要的意义[1]。当前,我国分析化学专业的人才大多是通过综合大学的化学学科分析化学专业培养,而大多数生物、医学、食品、农业、环境等专业的学生在本科阶段和研究生阶段都很难有机会深入学习和完整掌握现代分析化学的基本方法和实验技能。他们在解决科研和实际生产中的具体问题时常常面临现代分析化学知识和实验技能的不足。因此,有目的地培养非分析化学专业的学生对现代分析化学新技术、新方法的认知,加强学生实践技能训练、提高学生实际动手能力,并借此培养学生分析问题和解决问题的能力,对于相关学科的研究型人才培养十分必要[2]。
毛细管电泳技术(capillary electrophoresis,CE)作为分析化学学科前沿和热点之一,不仅是微流控芯片技术的基础,也是联系电泳和液相色谱分析方法之间的新型分析技术,在生命科学、环境科学、食品科学等领域具有广泛的应用和发展空间。目前分析化学实验中的仪器分析基础实验大都是经典的光学、电化学、色谱等验证性实验。而生物学专业中,电泳实验是最重要也是最基础的实验,大都只在生物化学实验中有所涉及。毛细管电泳技术作为新型分析技术,与传统电泳和液相色谱技术相比,具有高效、快速、实验成本低、试剂和样品用量少,以及仪器操作简单等突出特点[3]。本文主要介绍以我校生命学院二年级生物工程和生物技术专业本科生为对象,开设蛋白质和核酸同时分析检测的基础型开放实验的内容。
蛋白质和核酸是生命科学研究的基础物质,蛋白质和核酸的分析检测是生物学研究中必不可少的内容[4]。凝胶电泳是蛋白质和核酸分析的经典方法,目前仍广泛应用[5]。凝胶电泳实验是生物学专业本科生的基础教学实验,通常分别使用PAGE或SDSPAGE和琼脂糖凝胶电泳定性检测蛋白质和核酸。本开放实验利用毛细管电泳同时分析蛋白质和核酸,目的是向学生介绍毛细管电泳高效、快速、成本低、试剂和样品用量少、分析模式多样等突出的特点,开阔学生的知识面,了解利用现代毛细管电泳分析技术快速进行蛋白质与核酸的同时定性、定量分析,并且比较毛细管电泳与经典凝胶电泳方法在原理及仪器和实验操作上的差异。
2 实验目的和内容
2.1 实验目的
(1)掌握毛细管电泳的原理,能熟练使用毛细管电泳仪。
(2)了解毛细管区带电泳同时分析蛋白质和核酸的基本原理,了解影响分析效果的因素,学习优化实验条件的方法,确定优化的实验条件。
(3)了解蛋白质和核酸样品的荷电特性,学习利用毛细管区带电泳对蛋白质和核酸标准样品进行定性、定量分析的方法。
(4)学习对实验结果进行正确的总结和讨论,以及对实验过程中出现的问题进行正确分析的方法。
2.2 实验内容
本实验通过毛细管区带电泳法分析牛血清白蛋白(BSA)及单链核酸序列(ssDNA:5’-GGT TGG TGT GGT TGG-3’)标准样品,确定蛋白质和单链核酸的出峰顺序。考察电泳电压、分离温度、电解质溶液的pH值及有机溶剂和线性高分子聚合物添加剂对分析结果的影响。
3 实验部分
3.1 实验仪器
Agilent CE毛细管电泳仪配有DAD检测器及恒温控制系统(Agilent公司);漩涡混合器XW-80A(江苏海门市其林贝尔仪器制造有限公司 );Adventurer电子天平(奥豪斯仪器有限公司);pH 211酸度计(意大利 HANNA 仪器公司);移液器(0.5~10μL,20~200μL,100~1 000μL,dragon公司);超声波清洗器(宁波新芝生物科技股份有限公司);熔融石英毛细管柱(邯郸市鑫诺光纤色谱有限公司)。
3.2 实验试剂
H3BO3(北京化学试剂公司);Na2B4O7·10H2O(北京益利精细化学品有限公司);二甲基亚砜(DMSO)(北京北化精细化学品有限责任公司 )。以上试剂均为分析纯。实验中使用高纯水配制溶液。
BSA购自北京纽朴生物技术有限公司;ssDNA购自生工生物工程(上海)股份有限公司。
3.3 实验条件
75μm内径熔融石英毛细管,长度33.5cm(有效长度 22.5cm),分离电压 10kV,气压进样 50 mbar10s,214nm 紫外检测。50mMol/L H3BO3/Na2B4O7(pH 8.7)作为缓冲溶液,DMSO作中性标记物。新毛细管在使用前用1mol/L NaOH、0.1mol/L NaOH和去离子水依次冲洗30min进行活化;每2次进样之间依次用0.1mol/L NaOH、去离子水、缓冲溶液分别冲洗5min。
4 结果与讨论
4.1 实验原理
毛细管电泳中,由熔融石英毛细管产生的电渗流大小决定溶液中组分的迁移速率,此外,蛋白质和核酸分子还受自身表面电荷和质量(荷质比)的影响。蛋白质与核酸分子因自身性质差异导致其在电泳过程中的迁移速率不同而分离[6]。因此,影响蛋白质和核酸分子分离的主要因素有电场强度、电解质溶液的组成和浓度以及电泳过程中的分离温度。
4.2 蛋白质和核酸峰的确定
以50mmol/L H3BO3/Na2B4O7(pH 8.7)为缓冲溶液,在214nm紫外波长下检测DMSO、BSA和ssDNA;通过单组分进样可以确定,出峰顺序依次为DMSO、BSA、ssDNA(图1),即3种组分的迁移速率为DMSO>BSA>ssDNA。产生这种结果的原因是DMSO为中性分子,不带电荷,电泳过程中作为电渗流的标记分子最先出峰,BSA的等电点为4.9,在pH 8.7电解液中带负电荷,因此迁移较中性分子DMSO慢,ssDNA因大量磷酸基团存在而带更多的负电荷[7],电泳过程中迁移速率最小,迁移时间最短。
图1显示,3种样品混合进样时,当样品中BSA的浓度增加,其峰面积相应有所增加。此外,3种组分3次重复测定结果显示,其迁移时间的RSD值在0.43%~1.06% 之间(见表1)。以上结果表明,该实验条件下,蛋白质和核酸分子可以实现同时分离,且迁移时间的重复性很好。
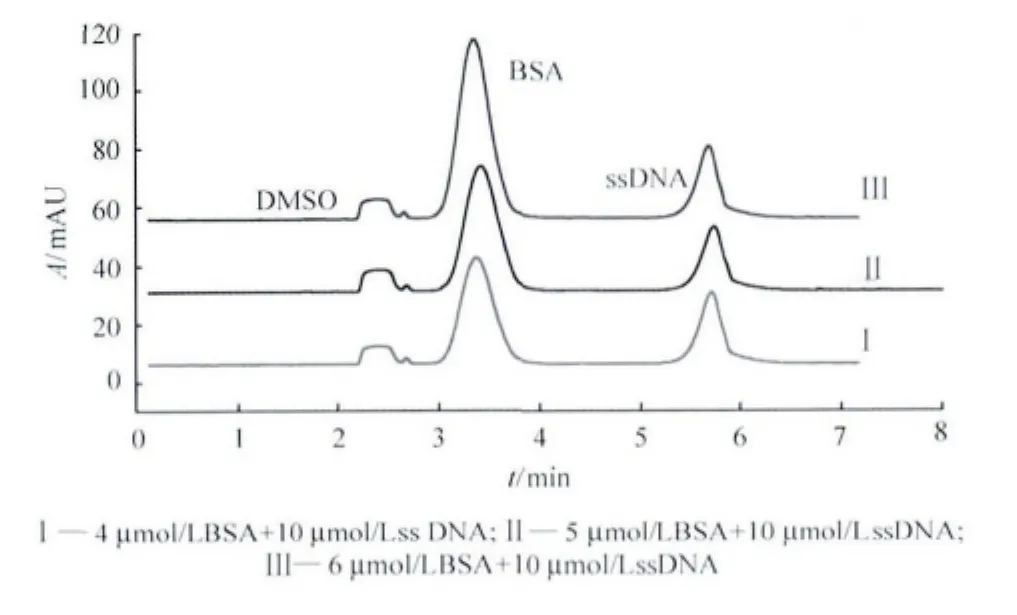
图1 BSA与ssDNA标准样品混合物的电泳图
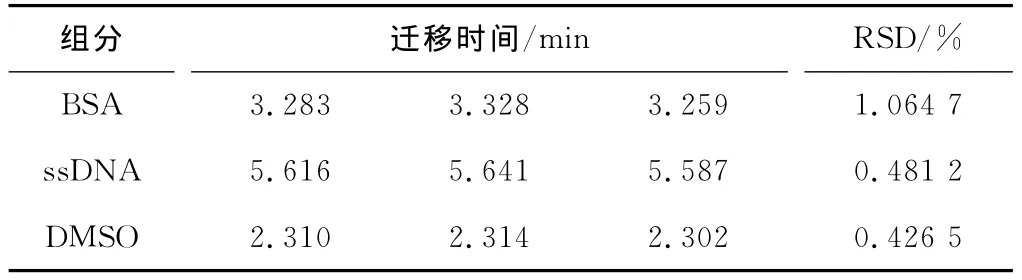
表1 BSA与ssDNA分离的迁移时间重复性(n=3)
4.3 电压对分离的影响
电泳电压影响电渗流和组分的迁移速度,影响组分的迁移时间。迁移速率(v)与工作电压间有一线性关系:v=qE/6(q:样品的有效电荷;E:电场强度;γ:样品的表观液态动力学半径;η:介质的黏度),即当毛细管长度一定时,电渗流速度与工作电压呈正比[8]。
当分离电压为10~20kV时,3组分的表观迁移时间随电泳电压增大而明显加快,迁移时间缩短(见图2)。扣除电压增加导致的电渗流增大等因素,3组分的相对电泳迁移时间基本稳定,其RSD值<3% (见表2),说明相对电泳迁移时间可作为毛细管区带电泳中组分定性的可靠参数[9]。此外,应用高电压可加快电泳分析速度,但也可能使组分的分辨率降低,且产生较大的焦耳热,影响基线稳定和灵敏度[10]。
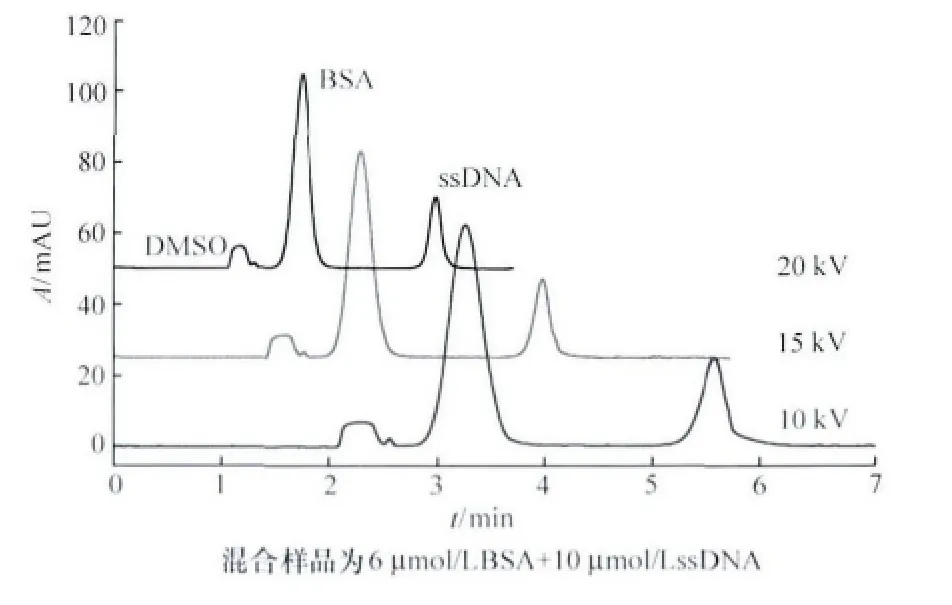
图2 不同电压对分离的影响
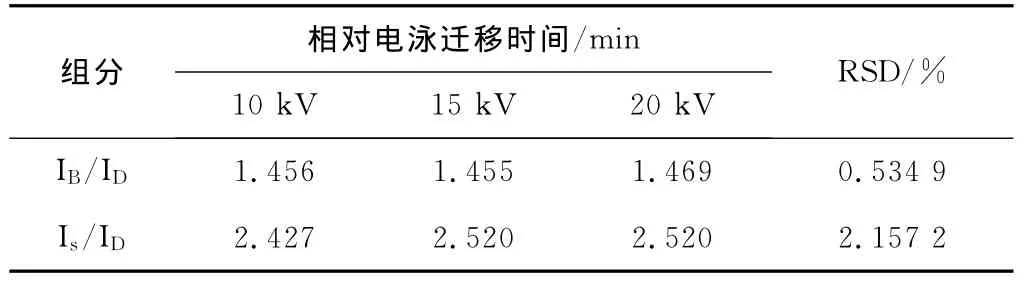
表2 电压对相对迁移时间的影响(IB-BSA,Is-ssDNA,ID-DMSO)
4.4 分离温度的影响
分离过程的温度影响电解质溶液的黏度(温度每变化1,将引起背景电解质溶液黏度变化2%~3%),从而影响电渗流,最终影响组分在电介质中的扩散。另外,由于缓冲液的pH值和蛋白质等电点都可能随温度而变,所以温度还可能影响蛋白质所带的电荷[11]。实验考察15℃、20℃、25℃ 温度下对分离效果的影响,结果见图3。低温时,有利于提高分辨率,如15℃时,核酸出现峰型分裂,可能因样品存在杂质。高温时,溶液黏度降低,电渗流增大,组分迁移时间缩短。故随温度升高,各组分迁移时间相应缩短。
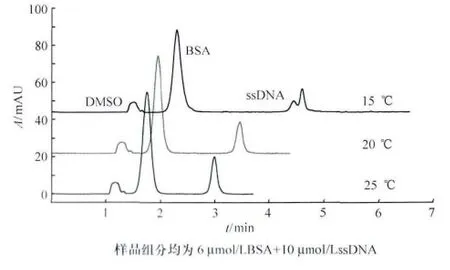
图3 分离温度对迁移时间的影响
4.5 缓冲液pH对分离的影响
电泳溶液的pH不仅影响毛细管内壁表面硅羟基的电离程度[12],而且影响组分的表面电荷,特别是对两性分子蛋白质,其表面电荷受其等电点以及溶液pH影响,从而影响迁移时间。实验比较了缓冲液pH 7.4~8.7对分离的影响,结果见图4。
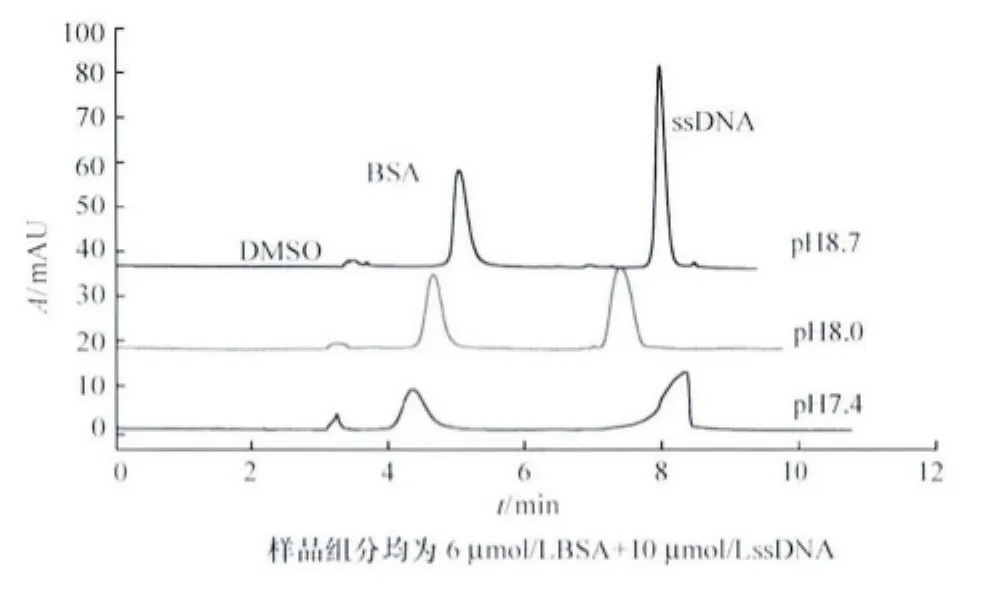
图4 缓冲液pH对分离的影响
适当提高电泳溶液pH,可以增加电渗流,表观淌度增加,相对分离时间缩短,分离效率提高;另一方面,改变电泳溶液pH,可改变溶质所带电荷的性质或数量,使溶质淌度改变,从而改变分离选择性,增加分离度[13]。由图4结果可知,随缓冲液pH增大,BSA和ssDNA峰型尖锐,峰高增大明显,峰的分辨率提高,与理论推断相符。
4.6 其他因素对分离结果的影响(选做)
完成上述实验内容后,还可进一步选作其他条件优化实验,如:电解质浓度的影响;加入有机溶剂的影响;加入高分子聚合物筛分介质的影响等。
5 结束语
本开放实验的目的在于拓宽生物学专业学生对经典教材和实验课教学内容的认知,了解蛋白质和核酸分析的新方法,了解现代分析新技术在生物学研究中的应用潜力。作为开放实验,实验中的很多环节都可由学生自行设计,例如学生可进一步选择感兴趣的蛋白质组分和核酸组分设计实验方案,考察影响蛋白质和核酸混合物分离的主要因素,为CE毛细管电泳法在研究型课题中的应用奠定基础。
(
)
[1]屈锋,刘松南,任肖敏,等.“毛细管电泳快速分析蛋白质”开放实验的实践[J].实验技术与管理,2009,26(4):26-28.
[2]屈锋,宫红梅,李秀珍,等.为生物学专业学生开设毛细管电泳开放实验的探索与实践[J].实验技术与管理,2007,24(12):15-17.
[3]屈锋,覃浩,马文韬.毛细管胶束电动色谱分析饮料中的咖啡因开放实验的实践[J].实验技术与管理,2008,25(12):27-33.
[4]Kraly J,Fazal Md A,Schoenherr R M,et al.Bioanalytical Applications of Capillary Electrophoresis Anal[J].Chem,2006(78):4097-4110.
[5]余和芬,孔璐,候燕芝,等.开设生物化学设计实验,提高学生综合素质[J].实验技术与管理,2006,23(10):18-20.
[6]Learning to learn:An Introduction to Capillary Electrophoresis instrumentation[J].The Chemical Education,1996,l1(6):1-12.
[7]Nelson D L,Cox M M.Lehninger Principle of Biochemistry[M].周海梦,昌增益,译.北京:高等教育出版社,2005.
[8]Tagliaroa F,Manettoa G,Crivellentea F,et al.A brief introduction to capillary electrophoresis[J].Forensic Science International,1998(92):75-88.
[9]张玉奎,陈农,王磊.几种标准蛋白质的毛细管区带电泳的分离及其迁移行为[J].分析化学,1994,22(8):798-800.
[10]陈义.毛细管电泳技术及应用 [M].2版.北京:化学工业出版社,2006.
[11]朱亮,许旭,林炳承.毛细管电泳中的温度效应和温度梯度技术[J].色谱,1999,17(1):21-25.
[12]朱健萍,胡昌勤,刘文英.毛细管电泳迁移时间重现性影响因素的探讨[J].色谱,2006,24(4):396-401.
[13]林炳承.毛细管电泳导论[M].北京:科学出版社,1996.
