含1,2,4-三唑硫醚单元的新型喹唑啉酮类衍生物的合成及其抗菌活性
2013-11-19鲍小平刘军虎邹林波蹇军友
鲍小平, 刘军虎, 张 峰, 邹林波, 蹇军友
(贵州大学 精细化工研究开发中心 教育部绿色农药与农业生物工程重点实验室,贵州 贵阳 550025)
喹唑啉类衍生物具有优良的生物活性,如抗癌[1,2],杀菌[3,4]和抗烟草花叶病毒[5]等。含1,2,4-三唑杂环的化合物也被广泛应用于杀菌[6],杀虫[7]和除草[8]等方面,目前已上市的三唑类杀菌剂有三唑酮,三唑醇,烯唑醇和腈菌唑等。最近,本课题组[9]将1,2,4-三唑席夫碱通过硫醚桥引入到喹唑啉环的4-位,生测结果表明部分化合物表现出较好的抗菌活性。
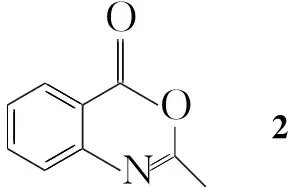
为了筛选出更高效的喹唑啉类杀菌剂,本文采用活性单元拼接法将1,2,4-三唑硫醚单元引入到喹唑啉-4-酮的3-位,合成了10个含1,2,4-三唑硫醚单元的新型喹唑啉酮类衍生物(1a~1j, Scheme 1),其结构经1H NMR, IR,
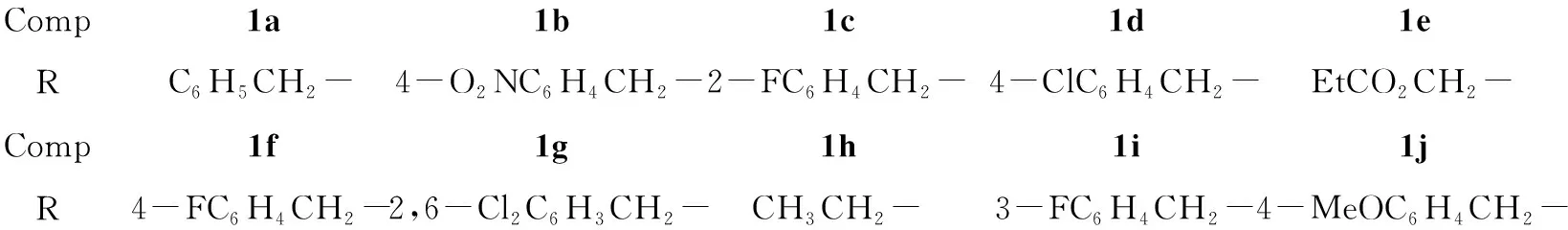
Comp1a1b1c1d1eRC6H5CH2-4-O2NC6H4CH2-2-FC6H4CH2-4-ClC6H4CH2-EtCO2CH2-Comp1f1g1h1i1jR4-FC6H4CH2-2,6-Cl2C6H3CH2-CH3CH2-3-FC6H4CH2-4-MeOC6H4CH2-
Scheme1
MS和元素分析表征。初步生物活性测试结果表明,部分化合物具有一定的抗菌活性,其中1a对小麦赤霉菌的抑制率为40%;1e,1f和1h对水稻纹枯菌的抑制率分别为35%, 34%和34%;1j对半夏立枯菌的抑制率为34%。
1 实验部分
1.1 仪器与试剂
X-4型数字显示熔点仪(温度计未校正); JOEL ECX-500型核磁共振仪(CDCl3为溶剂, TMS为内标);Shimadzu Prestige-21型红外光谱仪(KBr压片);Agilent ESI-MSD Trap(VL)或Agilent 6890/5973 inter GC/MSD型质谱仪;Elementar Vario-Ⅲ型元素分析仪。
2-甲基-4H-苯并[d][1,3]噁嗪-4-酮(2)[5]和3-甲基-4-氨基-1,2,4-三唑-5-硫酮[10]按文献方法合成;其余所用试剂均为分析纯。
1.2 合成
(1) 2-甲基-3-(3-硫酮-5-甲基-1,2,4-三唑-4-基)-喹唑啉-4-酮(3)的合成
在圆底烧瓶中加入2 0.80 g(5 mmol)和3-甲基-4-氨基-1,2,4-三唑-5-硫酮0.65 g(5 mmol),加热至熔化;搅拌下反应1 h。冷却至室温,加入无水乙醇15 mL,过滤,滤饼干燥得黄色固体3 0.58 g,收率42.5%, m.p.>250 ℃;1H NMR(DMSO-d6)δ: 2.34(s, 3H), 2.38(s, 3H), 7.63(t,J=8.0 Hz, 1H), 7.76(d,J=8.0 Hz, 1H), 7.96(t,J=8.0 Hz, 1H), 8.15(d,J=8.0 Hz, 1H), 14.23(s, 1H); IRν: 2 914, 1 718 cm-1。
(2)1a~1j的合成(以1a为例)
在圆底烧瓶中依次加入无水K2CO30.14 g(1.0 mmol),水5 mL和3 0.136 g(0.5 mmol),搅拌下于室温反应5 min;滴加苄氯(4a)63 mg(0.5 mmol)的甲醇(3 mL)溶液,滴毕,反应至终点(TLC监测)。抽滤,滤饼用THF重结晶后得1a。
用类似方法合成1b~1j。
1a: 白色固体,收率83.0%, m.p.120 ℃~121 ℃;1H NMRδ: 2.06(s, 3H), 2.33(s, 3H), 4.33(d,J=13.0 Hz, 1H), 4.58(d,J=13.0 Hz, 1H), 7.22~7.28(m, 3H), 7.33(d,J=6.9 Hz, 2H), 7.56(t,J=8.0 Hz, 1H), 7.70(d,J=8.0 Hz, 1H), 7.86(t,J=8.6 Hz, 1H), 8.24(d,J=8.0 Hz, 1H); IRν: 1 706, 1 610 cm-1; EI-MSm/z: 363(M+); Anal.calcd for C19H17N5OS: C 62.79, H 4.71, N 19.27; found C 62.35, H 4.94, N 18.82。
1b: 白色晶体,收率86.0%, m.p.215 ℃~217 ℃;1H NMRδ: 2.16(s, 3H), 2.33(s, 3H), 4.39(d,J=13.2 Hz, 1H), 4.55(d,J=13.2 Hz, 1H), 7.53(d,J=8.6 Hz, 2H), 7.57(t,J=8.0 Hz, 1H), 7.72(d,J=8.0 Hz, 1H), 7.87(t,J=6.9 Hz, 1H), 8.12(d,J=8.6 Hz, 2H), 8.21(d,J=8.0 Hz, 1H); IRν: 1 712, 1 622 cm-1; ESI-MSm/z: 409.1{[M+H]+}; Anal.calcd for C19H16N6O3S: C 55.87, H 3.95, N 20.58; found C 55.85, H 3.95, N 20.50。
1c: 白色固体,收率50.0%, m.p.163 ℃~164 ℃;1H NMRδ: 2.10(s, 3H), 2.33(s, 3H), 4.40(d,J=13.2 Hz, 1H), 4.56(d,J=13.2 Hz, 1H), 6.99~7.06(m, 2H), 7.22~7.25(m, 1H), 7.43(t,J=7.5 Hz, 1H), 7.55(t,J=7.5 Hz, 1H), 7.71(d,J=8.0 Hz, 1H), 7.85(t,J=8.0 Hz, 1H), 8.24(d,J=7.5 Hz, 1H); IRν: 1 710, 1 610 cm-1; EI-MSm/z: 381(M+); Anal.calcd for C19H16FN5OS: C 59.83, H 4.23, N 18.36; found C 59.65, H 4.40, N 18.03。
1d: 白色固体,收率53.0%, m.p.169 ℃~172 ℃;1H NMRδ: 2.11(s, 3H), 2.33(s, 3H), 4.28(d,J=13.2 Hz, 1H), 4.50(d,J=13.2 Hz, 1H), 7.24(d,J=8.0 Hz, 2H), 7.29(d,J=8.0 Hz, 2H), 7.56(t,J=7.5 Hz, 1H), 7.72(d,J=8.0 Hz, 1H), 7.86(t,J=8.0 Hz, 1H), 8.24(d,J=7.5 Hz, 1H); IRν: 1 718, 1 608 cm-1; EI-MSm/z: 397(M+); Anal.calcd for C19H16N5OSCl: C 57.35, H 4.05, N 17.60; found C 57.25, H 4.48, N 17.60。
1e: 白色晶体,收率15.0%, m.p.129 ℃~130 ℃;1H NMRδ: 1.27(t,J=6.9 Hz, 3H), 2.34(s, 3H), 2.38(s, 3H), 3.92(d,J=16.0 Hz, 1H), 4.17(q,J=6.9 Hz, 2H), 4.28(d,J=16.0 Hz, 1H), 7.57(t,J=7.5 Hz, 1H), 7.76(d,J=8.6 Hz, 1H), 7.88(t,J=8.6 Hz, 1H), 8.26(d,J=7.5 Hz, 1H); IRν: 1 701, 1 610 cm-1; EI-MSm/z: 359(M+); Anal.calcd for C16H17N5O3S: C 53.47, H 4.77, N 19.49; found C 53.57, H 4.99, N 19.28。
1f: 黄色晶体,收率62.6%, m.p.113 ℃~115 ℃;1H NMRδ: 2.11(s, 3H), 2.33(s, 3H), 4.30(d,J=12.5 Hz, 1H), 4.53(d,J=12.5 Hz, 1H), 6.95(d,J=8.6 Hz, 2H), 7.30(d,J=7.5 Hz, 2H), 7.56(t,J=8.0 Hz, 1H), 7.71(d,J=8.6 Hz, 1H), 7.85(t,J=8.0 Hz, 1H), 8.25(d,J=7.5 Hz, 1H); IRν: 1 701, 1 618 cm-1; EI-MSm/z: 381(M+); Anal.calcd for C19H16N5OSF: C 59.83, H 4.23, N 18.36; found C 59.38, H 4.43, N 17.91。
1g: 白色晶体,收率82.7%, m.p.170 ℃~171 ℃;1H NMRδ: 2.28(s, 3H), 2.37(s, 3H), 4.74(d,J=12.0 Hz, 1H), 4.81(d,J=12.0 Hz, 1H), 7.15(t,J=7.5 Hz, 1H), 7.26(d,J=8.5 Hz, 2H), 7.55(t,J=8.0 Hz, 1H), 7.72(d,J=8.0 Hz, 1H),7.86(t,J=7.5 Hz, 1H), 8.25(d,J=8.0 Hz, 1H); IRν: 1 707, 1 624 cm-1; ESI-MSm/z: 432.0{[M+H]+}; Anal.calcd for C19H15N5OSCl2: C 52.78, H 3.50, N 16.20; found C 52.44, H 3.63, N 15.76。
1h: 白色粉末,收率30.6%, m.p.102 ℃~104 ℃;1H NMRδ: 1.42 (t,J=6.0 Hz, 3H), 2.30(s, 3H), 2.34(s, 3H), 3.26(q,J=6.0 Hz, 2H), 7.57(t,J=7.5 Hz, 1H), 7.74(d,J=8.0 Hz, 1H), 7.87(t,J=7.5 Hz, 1H), 8.27(d,J=7.5 Hz, 1H); IRν: 1 712, 1 622 cm-1; ESI-MSm/z: 302.2{[M+H]+}; Anal.calcd for C14H15N5OS: C 55.80, H 5.02, N 23.24; found C 55.91, H 5.41, N 22.82。
1i: 白色固体,收率65.6%, m.p.170 ℃~172 ℃;1H NMRδ: 2.12(s, 3H), 2.33(s, 3H), 4.32(d,J=13.2 Hz, 1H), 4.53(d,J=13.2 Hz, 1H), 6.94(t,J=8.6 Hz, 1H), 7.05(d,J=9.2 Hz, 1H), 7.12(d,J=8.0 Hz, 1H), 7.22(t,J=8.0 Hz, 1H), 7.56(t,J=7.5 Hz, 1H), 7.71(d,J=8.0 Hz, 1H), 7.86(t,J=8.6 Hz, 1H), 8.25(d,J=8.0 Hz, 1H); IRν: 1 714, 1 612 cm-1; EI-MSm/z: 381(M+); Anal.calcd for C19H16N5OSF: C 59.83, H 4.23, N 18.36; found C 59.75, H 4.46, N 17.92。
1j: 白色晶体,收率10.0%, m.p.127 ℃~129 ℃;1H NMRδ: 2.10(s, 3H), 2.33(s, 3H), 3.76(s, 3H), 4.32(d,J=12.6 Hz, 1H), 4.53(d,J=12.6 Hz, 1H), 6.78(d,J=8.5 Hz, 2H), 7.25(d,J=8.5 Hz, 2H), 7.55(t,J=8.0 Hz, 1H), 7.71(d,J=8.0 Hz, 1H), 7.87(t,J=8.6 Hz, 1H), 8.25(d,J=8.0 Hz, 1H); IRν: 1 705, 1 608 cm-1; EI-MSm/z: 393 (M+); Anal.calcd for C20H19N5O2S: C 61.05, H 4.87, N 17.80; found C 61.14, H 5.05, N 17.41。
1.3 抗菌活性测试
采用菌丝生长速率法[4]在马铃薯葡萄糖琼脂培养基上研究了1a~1j对小麦赤霉菌(Gibberellazeae)、辣椒枯萎菌(Fusariumoxysporum)、马铃薯晚疫菌 (Phytophthorainfestans)、水稻纹枯菌(Pelliculariasasakii)、苹果腐烂菌(Cytosporamandshurica)和半夏立枯菌(Rhizoctoniasolani)的抑制活性。普筛用药量为50 μg·mL-1,以商品化药物多菌灵为对照药剂,等量DMSO为空白对照。接菌后置于27 ℃培养箱中培养,待空白对照菌落直径生长至接近培养皿直径的三分之二时,测出相应直径,与空白对照直径相比较,按下式计算抑制率。

抑制率×100%
*A:Gibberellazeae, B:Fusariumoxysporum, C:Phytophthorainfestans, D:Pelliculariasasakii, E:Cytosporamandshurica, F:Rhizoctoniasolani
2 结果与讨论
2.1 波谱分析
1a~1j的三唑环上的CH3质子峰大部分在2.10左右,喹唑啉环上2-CH3的质子峰在2.30附近, SCH2上的两个H为不等价质子,相互耦合且裂分为两组双重峰(J≈13.0 Hz),但R为乙基时(1h)除外。在IR谱图中,1a~1j的喹唑啉4-位酮C=O的伸缩振动峰在1 710 cm-1附近。
2.2 抗菌活性分析
1a~1j的抑菌活性见表1。从表1可见,用药量为50 μg·mL-1时,部分化合物对受试菌种表现出一定的杀菌活性,如1a对小麦赤霉菌的抑制率为40%;1e,1f和1h对水稻纹枯菌的抑制率分别为35%, 34%和34%;1j对半夏立枯菌的抑制率为34%。1a~1j对所测菌种的抑制活性总体不太理想。
[1] Wu X, Li M, Qu Y,etal. Design and synthesis of novel Gefitinib analogues with improved anti-tumor activity[J].Bioorg Med Chem,2010,18:3812-3822.
[2] Noolvi M N, Patel H M, Bhardwaj V,etal. Synthesis and in vitro antitumor activity of sub-stituted quinazoline and quinoxaline derivatives:Search for anticancer agent[J].Eur J Med Chem,2011,46:2327-2346.
[3] Panneerselvam P, Rather B A, Reddy D R S,etal. Synthesis and anti-microbial screening of some Schiff bases of 3-amino-6,8-dibromo-2-phenylquinazolin-4(3H)-ones[J].Eur J Med Chem,2009,44:2328-2333.
[4] 高元磊,林选福,韩菲菲,等.N-[3-(4-喹唑啉基)氨基-1H-吡唑-4-甲酰基]醛腙类衍生物的合成及抗菌活性研究[J].有机化学,2011,31:1648-1652.
[5] 高兴文,蔡学建,严凯,等. 4(3H)-喹唑啉酮类Schiff碱的合成与抗烟草花叶病毒活性[J].有机化学,2008,28:1785-1791.
[6] Almajan G L, Barbuceanu S F, Almajan E R,etal. Synthesis,characterization and antibacterial activity of some triazole Mannich bases carrying diphenylsulfone moieties[J].Eur J Med Chem,2009,44:3083-3089.
[7] 尹凯,蒋历辉,周后相,等. 2-多氟烷基取代和葡萄糖基取代的2,4-二氢-1,2,4-三唑-3-硫酮类席夫碱的合成及其杀虫活性[J].有机化学,2008,28:1016-1023.
[8] 马忠华,刘祖明,陈琼.5,7-二甲基-1,2,4-三唑并[1,5-a]嘧啶双杂环衍生物的合成与生物活性[J].有机化学,2008,28:1965-1970.
[9] 刘军虎,刘勇,蹇军友,等. 含1,2,4-三唑席夫碱的新型喹唑啉类化合物的合成及其抗菌活性研究[J].有机化学,2012,DOI:10.6023/cjoc201209023.
[10] 孙晓红,陶燕,刘源发,等. 3-甲基-4-氨基-1,2,4-三唑-5-硫酮席夫碱的合成及生物活性研究[J].化学学报,2008,66:234-238.
