两种新型A环并吡喃环黄酮的合成
2013-11-19陈诗尧王华林刘雄利
陈 斌, 张 尧, 陈诗尧, 王华林, 刘雄利, 周 英
(贵州大学 生命科学学院 中药天然药研发中心,贵州 贵阳 550025)
黄酮类化合物广泛存在于许多药用植物中,大多具有抗肿瘤、抗心血管疾病、抗病毒、抗炎、抗氧化等多种生理活性[1~3]。特别是A环并吡喃环的黄酮,具有良好的生物活性,例如摩鲁新具有很好的抗HIV活性[4]及显著的抗肿瘤活性[5]。
为了满足生物活性和新药研究开发的需要,根据药物设计原理,本文以间苯三酚和3,3-二甲基烯丙酸为起始原料,通过苄基保护、甲基化、脱保护基、Clemmenson还原、乙酰化、Fries重排、Baker-Venkataraman重排、环化等8步反应,合成了两个新型的A环并吡喃环黄酮化合物——4′,7-二甲氧基-2″,2″-二甲基-3″,4″-2H二氢吡喃-5″,6″ ∶5,6-黄酮(9a)和2′,4′,7-三甲氧基-2″,2″-二甲基-3″,4″-2H二氢吡喃-5″,6″ ∶5,6-黄酮(9b)(Scheme 1),其结构经1H NMR,13C NMR和MS 表征。




Scheme1
1 实验部分
1.1 仪器与试剂
Bruker-DRX500(500 MHz)型和Bruker-AV400(400 MHz) 型核磁共振仪(CDCl3为溶剂, TMS为内标); HP5973型和HP 1100 MSD型质谱仪。
所用试剂均为分析纯;无水溶剂均按标准方法纯化。
1.2 合成
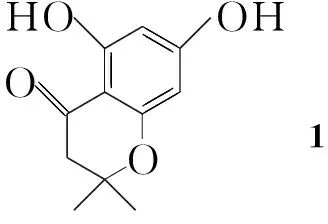
(1) 5,7-二羟基-2,2-二甲基苯并吡喃-4-酮(1)的合成[6]
在反应瓶中依次加入间苯三酚2.52 g(20 mmol), 3,3-二甲基烯丙酸2.40 g(24 mmol)和98%三氟化硼乙醚溶液20 mL,搅拌下回流(70 ℃)反应2.5 h。冷却至室温,倾入冰水中,用10%NaOH溶液调至pH 11,用乙酸乙酯(2×75 mL)洗涤,分液,水相用稀盐酸调至pH 7(析出大量沉淀),过滤,滤饼用蒸馏水洗涤后干燥得淡黄色固体1 3.39 g,收率81.5%;1H NMRδ: 1.44(s, 6H), 2.74(s, 2H), 5.88(m, 2H), 9.55(br s, 1H), 12.14(s, 1H); EI-MSm/z(%): 208(M+, 50), 193(100), 153(50), 124(25)。
(2) 7-苄氧基-5-羟基-2,2-二甲基苯并吡喃-4-酮(2)的合成
在反应瓶中加入1 2.08 g(10 mmol),无水丙酮10 mL, K2CO32.76 g(20 mmol)和溴化苄1.3 mL(11 mmol),搅拌下回流反应3 h(TLC跟踪)。过滤,滤液减压蒸除溶剂,残余物用95%乙醇重结晶得白色针状晶体2 2.58 g,收率86.7%;1H NMRδ: 1.45(s, 6H), 2.68(s, 2H), 5.05(s, 2H), 6.01(s, 1H), 6.08(s, 1H), 7.35~7.40(m, 5H), 12.01(s, 1H); EI-MSm/z(%): 298(M+, 98), 283(80), 243(35), 123(10), 91(100)。
(3) 7-苄氧基-5-甲氧基-2,2-二甲基苯并吡喃-4-酮(3)的合成
在反应瓶中依次加入2 1.49 g(5 mmol),无水丙酮8 mL, K2CO32.07 g(15 mmol)和碘甲烷0.65 mL(10 mmol),搅拌下于室温避光反应48 h(TLC跟踪)。过滤,滤液减压蒸除溶剂,残余物用无水乙醇重结晶得白色结晶3 1.43 g,收率91.7%;1H NMRδ: 1.38(s, 6H), 2.55(s, 2H), 3.78(s, 3H), 5.15(s, 2H), 6.13(d,J=2.0 Hz, 1H), 6.20(d,J=2.0 Hz, 1H), 7.32~7.49(m, 5H); EI-MSm/z(%): 312(M+, 97), 297(20), 256(25), 239(10), 193(10), 137(15), 91(100)。
(4) 7-羟基-5-甲氧基-2,2-二甲基苯并吡喃-4-酮(4)的合成
在反应瓶中依次加入3 1.56 g(5 mmol),冰醋酸10 mL, 5%Pd/C 80 mg,通入氢气,搅拌下于室温反应3 h(TLC跟踪)。过滤,滤液用饱和碳酸钠溶液中和至中性,用乙酸乙酯(2×75 mL)萃取,合并有机相,减压蒸除溶剂,残余物用95%乙醇重结晶得白色针状晶体4 0.89 g,收率80.2%;1H NMRδ: 1.37(s, 6H), 2.53(s, 2H), 3.75(s, 3H), 5.96(d,J=2.0 Hz, 1H), 6.06(d,J=2.0 Hz, 1H), 9.24(s, 1H); EI-MSm/z(%): 222(M+, 80), 207(35), 166(100), 138(50), 123(20), 69(20)。
(5) 7-羟基-5-甲氧基-2,2-二甲基苯并吡喃(5)的合成
在反应瓶中依次加入4 2.22 g(10 mmol),甲醇20 mL,锌粉3.90 g(60 mmol),搅拌下于室温反应15 min;滴加浓盐酸5 mL,滴毕,反应3 h(TLC跟踪)。过滤,滤液加水25 mL,用乙酸乙酯(2×75ml)萃取,合并有机相,用饱和NaCl溶液(50 mL)洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析[洗脱剂:A=V(乙酸乙酯) ∶V(石油醚)=1 ∶10]纯化得白色粉末5 1.73 g,收率83.2%;1H NMRδ: 1.23(s, 6H), 1.69(t,J=6.8 Hz, 2H), 2.47(t,J=6.8 Hz, 2H), 3.72(s, 3H), 5.85(d,J=2.4 Hz, 1H), 5.97(d,J=2.4 Hz, 1H); EI-MSm/z(%): 208(M+, 50), 193(35), 153(100), 140(10), 123(10), 69(15)。
(6) 7-乙酰氧基-5-甲氧基-2,2-二甲基苯并吡喃(6)的合成
在反应瓶中依次加入5 2.08 g(10 mmol),二氯甲烷20 mL和吡啶1 mL,搅拌下滴加乙酰氯0.85 mL(12 mmol),滴毕,于室温反应1 h。加水20 mL和5%盐酸10 mL,用二氯甲烷(2×75 mL)萃取,合并有机相,用饱和NaCl溶液(50 mL)洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1 ∶20)纯化得白色粉末62.26 g,收率90.4%;1H NMRδ: 1.3(s, 6H), 1.74(t,J=6.8 Hz, 2H), 2.26(s, 3H), 2.58(t,J=6.8 Hz, 2H), 3.77(s, 3H), 6.14(s, 1H), 6.18(s, 1H); EI-MSm/z(%): 250(M+, 60), 208(80), 193(40), 153(100)。
(7) 8-乙酰基-7-羟基-5-甲氧基-2,2-二甲基苯并吡喃(7)的合成
在反应瓶中依次加入6 1.00 g(4 mmol),二氯甲烷10 mL和无水三氯化铝1.18 g(8.8 mmol),搅拌下于室温反应4 h(TLC跟踪)。加水(15 mL)淬灭反应,用二氯甲烷(2×100 mL)萃取,合并有机相,用饱和NaCl溶液(50 mL)洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1 ∶25)纯化得黄色粉末7 0.86 g,收率86.5%;1H NMRδ: 1.36(s, 6H), 1.74(t,J=6.8 Hz, 2H), 2.52(t,J=6.8 Hz, 2H), 2.61(s, 3H), 3.81(s, 3H), 5.99(s, 1H), 13.9(s, 1H); EI-MSm/z(%): 250(M+, 45), 235(20), 207(20), 195(100), 179(35)。
(8) 8的合成(以8a为例)
在反应瓶中依次加入7 1.00 g(4 mmol), 4-甲氧基苯甲酰氯697 mg(4.4 mmol), KOH 1.79 g(32 mmol)和吡啶15 mL,搅拌下于室温反应5 h(TLC跟踪)。加入5%盐酸200 mL,用乙酸乙酯(2×100 mL)萃取,合并有机相,用饱和NaCl溶液(50 mL)洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1 ∶15)纯化得黄色粉末1-(7-羟基-5-甲氧基-2,2-二甲基苯并吡喃-8-取代)-3-(4-甲氧基苯基)丙烷-1,2-二酮(8a)1.15 g,收率74.9%;1H NMRδ: 1.06(s, 6H, 酮式), 1.45(s, 3H, 烯醇式), 1.64~1.80(m, 2H+1H, 酮式+烯醇式), 2.47~2.57(m, 2H+1H, 酮式+烯醇式), 3.83~3.86(m, 6H+3H, 酮式+烯醇式), 4.62(s, 2H, 酮式), 6.05~6.06(m, 1H+0.5H, 酮式+烯醇式), 6.95~6.99(m, 2H+1H, 酮式+烯醇式), 7.46(s, 0.5H, 烯醇式), 7.85~7.87(m, 1H, 烯醇式), 7.93~7.96(m, 2H, 酮式), 13.39(s, 0.5H, 烯醇式), 13.76(s, 1H, 酮式), 15.77(s, 0.5H, 烯醇式); ESI-MSm/z: Calcd for C22H24O6{[M+H]+} 385, found 385, 407{[M+Na]+} 。
用类似方法合成黄色粉末1-(7-羟基-5-甲氧基-2,2-二甲基苯并吡喃-8-取代)-3-(2,4-二甲氧基苯基)丙烷-1,2-二酮(8b),收率65.5%;1H NMRδ: 1.16(s, 6H), 1.69(t,J=6.8 Hz, 2H), 2.51(t,J=6.8 Hz, 2H), 3.73(s, 3H), 3.85(m, 6H), 4.59(s, 2H), 6.0(d,J=5.2 Hz, 1H), 6.42(s, 1H), 6.55(d,J=6.7 Hz, 1H), 8.01(d,J=8.9 Hz, 1H), 13.6(s, 1H); ESI-MSm/z: Calcd for C23H27O7{[M+H]+}415, found 415, 437{[M+Na]+} 。
(9) 9的合成(以9a为例)
在反应瓶中依次加入8a192 mg(0.5 mmol),冰乙酸5 mL和浓硫酸30 μL,搅拌下于室温反应45 min。加水10 mL,用二氯甲烷(2×75 mL)萃取,合并有机相,用饱和NaCl溶液(30 mL)洗涤,无水硫酸镁干燥,减压蒸除溶剂,残余物经硅胶柱层析(洗脱剂:A=1 ∶5)纯化得白色粉末9a139 mg,收率76.1%;1H NMRδ(500 MHz): 1.42(s, 6H), 1.81(t,J=6.8 Hz, 2H), 2.64(t,J=6.8 Hz, 2H), 3.87(s, 3H), 3.92(s, 3H), 6.49(s, 1H), 6.65(s, 1H), 6.98(d,J=8.9 Hz, 2H), 7.83(d,J=8.9 Hz, 2H);13C NMRδ(125 MHz): 17.0, 26.4, 31.2, 55.4, 55.8, 75.5, 76.6, 77.0, 77.3, 90.2, 106.9, 114.2, 123.8, 127.7, 128.7, 130.9, 154.7, 158.1, 161.6, 162.0, 177.5; ESI-MSm/z: Calcd for C22H23O5{[M+H]+} 367, found 367, 389{[M+Na]+} 。
用类似方法合成白色粉末9b,收率72.2%;1H NMRδ(500 MHz): 1.42(s, 6H), 1.81(t,J=8.5 Hz, 2H), 2.63(t,J=8.5 Hz, 2H), 3.86(s, 3H), 3.89(s, 3H), 3.94(s, 3H), 6.44~6.59(m, 3H), 7.01(s, 1H), 7.80(d,J=10.9 Hz, 1H);13C NMRδ: 17.0, 26.4, 31.2, 55.4, 55.6, 55.7, 75.3, 90.1, 98.7, 105.0, 106.4, 108.6, 112.3, 113.4, 130.0, 154.5, 158.0, 158.2, 159.4, 161.3; ESI-MSm/z: Calcd for C23H25O6{[M+H]+} 397, found 397, 419{[M+Na]+} 。
2 结果与讨论
由2合成3时,由于2中羟基形成了分子内氢键,降低了反应活性。本文采取了一方面使用较强的甲基化试剂碘甲烷,另一方面延长了反应时间,取得了91%的高收率,这对有分子内氢键化合物的甲基化反应具有借鉴意义。
本文用“一锅法”完成了Baker-Venkataraman重排,在7分别和4-甲氧基苯甲酰氯与2,4-甲氧基苯甲酰氯反应生成8a和8b的反应中,直接采用KOH于室温反应,一步合成了目标化合物,相比文献[7]报道的先在高温下生成酯,再在KOH的作用下重排形成二酮的两步反应更简便、更节约能源、更绿色环保。9a和9b及部分中间体的生物活性研究正在进行中。
[1] 彭芳,陈植和. 黄酮类化合物的生物活性[J].国外医药-植物药分册,1998,13(5):207-209.
[2] 吴立军. 天然药物化学[M].北京:人民卫生出版社,2008.
[3] 钟建青,李波,贾琦,等. 天然黄酮类化合物及其衍生物的构效关系研究进展[J].药学学报,2011,46(6):622-630.
[4] 罗士德, J Nemec,宁冰梅. 桑白皮中抗人爱滋病病毒成分研究[J].云南植物研究,1995,17(1):89-95.
[5] Tsui-Hwa Tseng, Shien-Kai Chuang, Chao-ChinHu,etal. The synthesis of morusin as a potent antitumor agent[J].Tetrahedron,2010,66:1335-1340.
[6] Ya L Garazd, M M Garazd, V P Khilya. Modifide coumarins.13.Synthesis of cyclopentane-annelated pyranocoumarins[J].Chemistry of Natural Compounds,2004,40(5):427-433.
[7] K J Rajendra Prasad, P A Periasamy, C S Vijayalakshmi. A facile synthesis of isopongaflavone,atalantoflavone dimethylether,racemoflavone dimethylether and methylenedioxy isopongaflavone[J].Journal of Natural Products,1993,56(2):208-214.
