通过Heck反应合成3-(2-羧基乙基)-1H-吡咯[2,3-b]吡啶-2-甲酸
2013-11-19别建波徐柏玲
别建波, 周 洁, 徐柏玲
(中国医学科学院 北京协和医学院 药物研究所活性物质发现与适药化研究北京市重点实验室,北京 100050)
果糖-1,6-二磷酸酶是肝脏糖异生途径中的限速酶之一,可将果糖-1,6-二磷酸转变为果糖-6-磷酸,经进一步转化成葡萄糖。因此,抑制果糖-1,6-二磷酸酶的活性,可减少内源性葡萄糖的生成,有望成为新型Ⅱ型糖尿病治疗手段[1~6]。文献[4]报道3-(2-羧基乙基)-4,6-二氯-1H-吲哚-2-甲酸对果糖-1,6-二磷酸酶具有一定的抑制活性。
本文设计并合成了新化合物3-(2-羧基乙基)-1H-吡咯[2,3-b]吡啶-2-甲酸(6),以期发现对果糖-1,6-二磷酸酶有较好抑制活性的化合物。以1H-吡咯[2,3-b]吡啶-2-甲
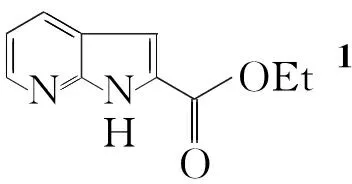

Scheme1
酸乙酯(1)[7]与N-溴代丁二酰亚胺(NBS)发生溴代反应制得1H-吡咯[2,3-b]吡啶-2-甲酸乙酯(2)[8]; 2与TsCl反应[9]得1-Ts-吡咯[2,3-b]吡啶类化合物(3);在Pd(OAc)2/dppf/Et3N催化下,3与丙烯酸乙酯经过Heck偶联反应制得关键中间体E)-1-Ts-3-(3-乙氧基-3-氧代丙基-1-烯基)-1H-吡咯[2,3-b]吡啶-2-羧酸乙酯(4);以Pd(OH)2为催化剂,4经常压催化氢化得5; 5经脱除Ts保护基及酯水解[10]得6(Scheme 1),其结构经1H NMR和 HR-MS表征。并对反应条件进行了优化。
1 实验部分
1.1 仪器与试剂
500D 型熔点仪(温度未校正);Varain Mercury-300型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Agilent LC/MSD TOF型高分辨质谱仪。
1按文献[7]方法合成;硅胶 200 目~300目,青岛海洋化工厂;其余所用试剂均为化学纯或分析纯。
1.2 合成
(1) 2的合成[8]
在反应瓶中加入1 508 mg(2.94 mmol)的DMF(10 mL)溶液,冷却至0 ℃,搅拌下缓慢滴加NBS 523 mg(2.94 mmol)的DMF(10 mL)溶液,滴毕,于室温反应2 h。倒入冰水中,抽滤,滤饼用水洗涤,干燥得白色固体2 630 mg,收率90%, m.p.215 ℃~217 ℃;1H NMRδ: 12.87(s, 1H, NH), 8.50(d,J=3.3 Hz, 1H), 7.99(d,J=7.2 Hz, 1H), 7.26(dd,J=7.8 Hz, 4.2 Hz, 1H), 4.37(q,J=7.2 Hz, 2H), 1.36(t,J=7.2 Hz, 3H); HR-ESI-MSm/z: Calcd for C10H9N2O2Br{[M+H]+} 268.992 0, found 268.991 9。
(2)3的合成[9]
在反应瓶中依次加入2 3.0 g(11.2 mmol)的二氯甲烷(45 mL)和DMF(30 mL)溶液,4-二甲氨基吡啶(DMAP)2.0 g(16.7 mmol)和三乙胺4.5 g(45 mmol),搅拌下于40 ℃缓慢滴加对甲苯磺酰氯(TsCl)6.4 g(33.5 mmol)的二氯甲烷(15 mL)溶液,滴毕,反应6 h。减压蒸除溶剂,加入乙酸乙酯30 mL,依次用饱和NaHCO3溶液和饱和食盐水洗涤,无水MgSO4干燥,经硅胶柱层析[洗脱剂:A=V(石油醚) ∶V(乙酸乙酯)=15 ∶1]纯化得白色粉末33.9 g,收率90%, m.p.121 ℃~122 ℃;1H NMRδ: 8.59(d,J=4.8 Hz, 1H), 8.03~8.07(m, 3H), 7.48~7.52(m, 3H), 4.49(q,J=7.2 Hz, 2H), 2.37(s, 3H), 1.40(t,J=7.2 Hz, 3H); HR-ESI-MSm/z: Calcd for C17H16N2O4SBr{[M+H]+} 423.000 9, found 423.000 8。
(3)4的合成
在反应瓶中依次加入3300 mg(0.71 mmol)的无水DMF(10 mL)溶液, Pd(OAc)232 mg(0.14 mmol), dppf 157 mg(0.28 mmol),三乙胺359 mg(3.55 mmol)和丙烯酸乙酯710 mg(7.1 mmol),氮气保护,搅拌下于85 ℃反应至终点。冷却至室温,减压蒸除溶剂,加入乙酸乙酯20 mL,依次用饱和NH4Cl溶液和饱和食盐水洗涤,无水MgSO4干燥,经硅胶柱层析(洗脱剂:A=15 ∶1)纯化得类白色固体4276 mg,收率88%, m.p.136 ℃~138 ℃;1H NMR(氘代丙酮)δ: 8.56(dd,J=4.5 Hz, 0.9 Hz, 1H), 8.50(d,J=7.8 Hz, 1H), 8.22(d,J=8.1 Hz, 2H), 7.80(d,J=16.5 Hz, 1H), 7.45~7.50(m, 3H), 6.68(d,J=16.5 Hz, 1H), 4.59(q,J=7.2 Hz, 2H), 4.24(q,J=7.2 Hz, 2H), 2.42(s, 3H), 1.48 (t,J=7.2 Hz, 3H), 1.30(t,J=7.2 Hz, 3H); HR-ESI-MSm/z: Calcd for C22H23N2O6S{[M+H]+} 423.000 9, found 443.127 2。
(4)5的合成
在反应瓶中加入4160 mg(0.36 mmol)的三氟乙醇(20 mL)溶液,氢氧化钯32 mg,搅拌下于室温常压氢化反应12 h。过滤,滤液减压蒸除溶剂,加入乙酸乙酯(20 mL),依次用饱和NaHCO3溶液和饱和食盐水洗涤,无水MgSO4干燥,经硅胶柱层析(洗脱剂:A=15 ∶1)纯化得白色固体5100 mg,收率63%, m.p.81 ℃~82 ℃;1H NMR(氘代丙酮)δ: 8.48(d,J=3.9 Hz, 1H), 8.17(d,J=8.1 Hz, 3H), 7.45(d,J=8.1 Hz, 2H), 7.35(dd,J=7.8 Hz, 4.2 Hz, 1H), 4.49(q,J=7.2 Hz, 2H), 4.02(q,J=7.2 Hz, 2H), 3.12(t,J=7.5 Hz, 2H), 2.66(t,J=7.5 Hz, 2H), 2.41(s, 3H), 1.44(t,J=7.2 Hz, 3H), 1.11(t,J=6.9 Hz, 3H); HR-ESI-MSm/z: Calcd for C22H25N2O6S{[M+H]+}445.142 8, found 443.143 0。
(5)6的合成[10]
在反应瓶中加入5210 mg(0.47 mmol)的THF(4 mL)和乙醇(2 mL)溶液,搅拌下滴加1 mol·L-1氢氧化钠溶液(4 mL),滴毕,于90 ℃反应3 h。减压蒸除溶剂,加水15 mL,用乙酸乙酯(2×5 mL)洗涤,分液,水相用1 mol·L-1盐酸调至pH 3(析出固体),过滤,滤饼用水洗涤,干燥得白色固体660 mg,收率65%, m.p.278 ℃~280 ℃;1H NMRδ: 13.63(brs, 1H), 12.00(s, 1H), 8.38(dd,J=4.5 Hz, 1.2 Hz, 1H), 8.14(d,J=7.2 Hz, 1H), 7.11(dd,J=7.8 Hz, 4.5 Hz, 1H), 3.26(t,J=7.5 Hz, 2H), 2.54(t,J=7.8 Hz, 2H); HR-ESI-MSm/z: Calcd for C11H11N2O4{[M+H]+} 235.071 3, found 235.071 5。
2 结果与讨论
2.1 Heck反应条件的优化
合成路线中的关键步骤是在氮杂吲哚的3-位引入丙烯酸酯侧链,其方法主要有3-醛基吲哚的Wittig反应, 3-溴吲哚的Heck反应,钯催化的3-位未取代吲哚的直接官能团化。到目前为止,只有一篇文献[11]报道了3-醛基氮杂吲哚的Wittig反应引入丙烯酸酯侧链。本文探索了采用Heck反应(3→4)在氮杂吲哚的3-位引入丙烯酸酯侧链,并对催化体系中的钯催化剂、配体、溶剂和碱条件进行了优化,结果分别见表1和表2。
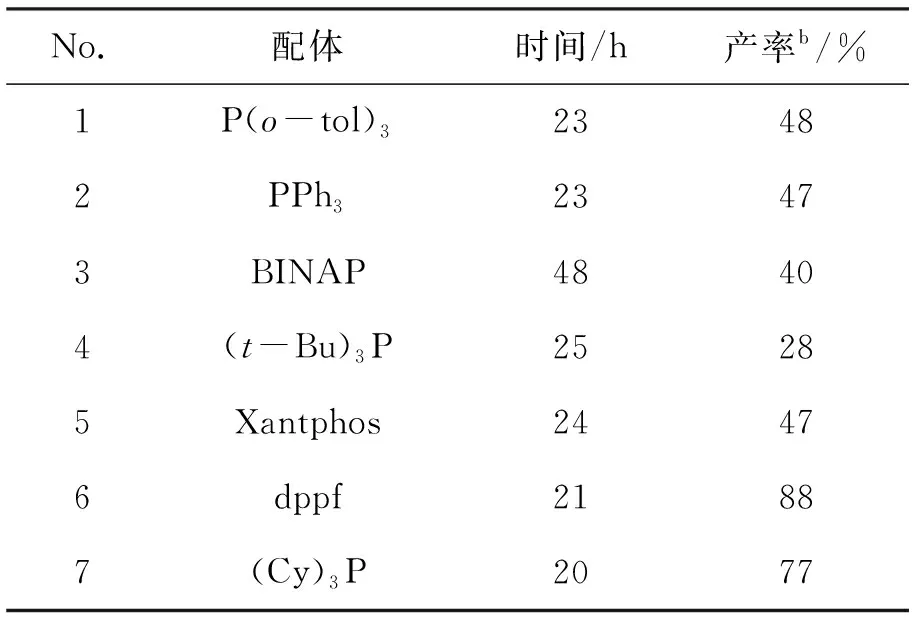
表 1 配体对Heck偶联反应的影响aTable 1 Effect of the ligand on the Heck coupling reaction
a反应条件:n(3) ∶n(丙烯酸乙酯)∶n[Pd(OAc)2] ∶n(配体) ∶n(Et3N)=1.0 ∶10.0 ∶0.2 ∶0.4 ∶5.0, 其余反应条件同1.2(3);b分离收率
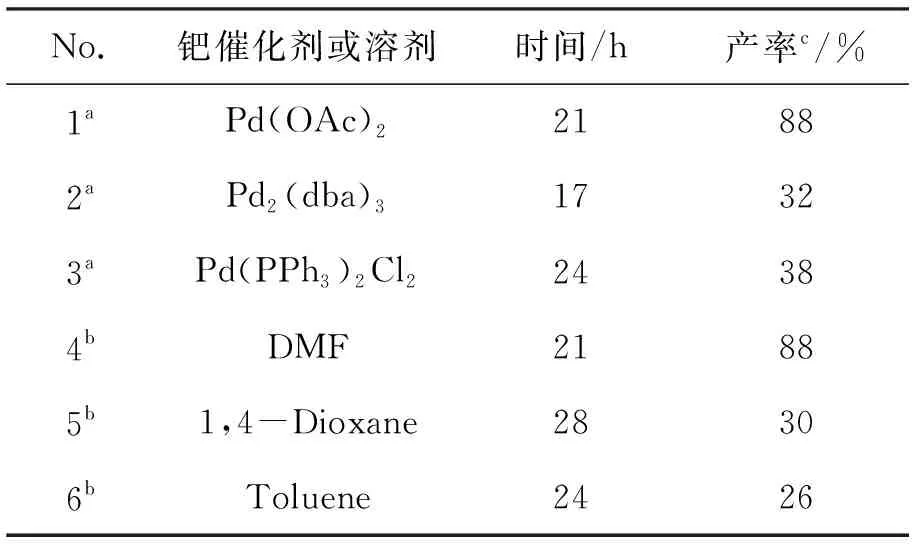
表 2 钯催化剂和溶剂对Heck偶联反应的影响aTable 2 Effect of the palladium and solvent on Heck coupling reaction
a反应条件:n(3) ∶n(丙烯酸乙酯) ∶n(钯催化剂) ∶n(dppf) ∶n(Et3N)=1 ∶10 ∶0.2 ∶0.4 ∶5 in DMF;bn(3) ∶n(丙烯酸乙酯) ∶n[Pd(OAc)2] ∶n(dppf) ∶n(Et3N)=1 ∶10 ∶0.2 ∶0.4 ∶5;c分离产率;其余同表1
从表1可以看出,催化体系中的配体对Heck偶联反应有显著的影响。以DMF为溶剂,Pd(OAc)2为催化剂,三乙胺为碱时,分别以P(o-tol)3, PPh3, BINAP, (t-Bu)3P 或 Xantphos为配体时,收率28%~48%。以dppf(No.6)或(Cy)3P(No.7)为配体时,反应收率显著提高,分别为88%和77%。基于以上结果,以dppf为配体,对钯催化剂、溶剂和碱进一步优化,以期获得更理想的收率。
从表2可以看出,以Pd2(dba)3(No.2)或Pd(PPh3)2Cl2(No.3)替换Pd(OAc)2(No.1), Heck反应收率显著降低,分别为32%和38%。溶剂的性质对反应也有显著影响,以1,4-二氧六环(No.5)或甲苯(No.6)为溶剂时,收率分别为30%和26%,以DMF(No.4)为溶剂可以获得较高的收率(88%)。催化体系中碱的选择也是至关重要的,当采用Cs2CO3, CsF 或者K3PO4等无机碱时,对甲苯磺酰基很容易脱除。
综上所述,最佳Heck反应条件为:以无水DMF为溶剂,Pd(OAc)2为催化剂, dppf为配体和三乙胺为碱,反应收率达88%。
该方法是在氮杂吲哚环3-位引入丙酸侧链的重要方法之一,为合成3-(2-羧基乙基)-1H-吡咯[2,3-b]吡啶-2-甲酸类化合物提供了新的选择。
[1] Maryanoff B E, Reitz A B, Tutwiler G F,etal. Stereoselective synthesis and biological activity of beta- and alpha-D-arabinose 1,5-diphosphate:Analogs of a potent metabolic regulator[J].Journal of the American Chemical Society,1984,106(25):7851-7853.
[2] Wright S W, Hageman D L, McClure L D,etal. Anilinoquinazoline inhibitors of fructose 1,6-bisphosphatase bind at a novel allosteric site:Synthesis,in vitro characterization,and X-ray crystallography[J].Journal of medicinal Chemistry,2002,45(18):3865-3877.
[3] von Geldern T W, Lai C Q, Gum R J,etal. Benzoxazole benzenesulfonamides are novel allosteric inhibitors of fructose-1,6-bisphosphatase with a distinct binding mode[J].Bioorganic and Medicinal Chemistry Letters,2006,16(7): 1811-1815.
[4] Wright S W, Carlo A A, Danley D E,etal. 3-(2-carboxy-ethyl)-4,6-dichloro-1H-indole-2- carboxylic acid:An allosteric inhibitor of fructose-1,6-bisphosphatase at the AMP site[J].Bioorganic and Medicinal Chemistry Letters,2003,13(12):2055-2058.
[5] Heng S, Grynceln K R, Kantrowitz E R,etal. A library of novel allosteric inhibitors against fructose 1,6-bisphosphatase[J].Bioorganic and Medicinal Chemistry,2009,17(11):3916-3922.
[6] Erion M D, Dang Q, Reddy M R,etal. Structure-guided design of AMP mimics that inhibit fructose-1,6-bisphosphatase with high affinity and specificity[J].Journal of the American Chemical Society,2007,129(50):15480-15490.
[7] Casara P, Diguarher T L, Durand D,etal. Tricyclic compounds, a process for their preparation and pharmaceutical compositions containing them[P]. US 2 011 112 104 A1,2011.
[8] Wang Z Q, Vince R. Design and synthesis of dual inhibitors of HIV reverse transcriptase and integrase:Introducing a diketoacid functionality into delavirdine[J].Bioorganic and Medicinal Chemistry,2008,16(7):3587-3595.
[9] MacKay J A, Bishop R L, Rawal V H. Rapid synthesis of theN-methylwelwitindolinone skeleton[J].Organic Letters,2005,7(16):3421-3424.
[10] Takahashi K, Kasai M, Ohta M, et al. Novel indoline-based acyl-CoA: Cholesterol acyltransferase inhibitor with antiperoxidative activity:Improvement of physicochemical properties and biological activities by introduction of carboxylic acid[J].Journal of Medicinal Chemistry,2008,51(15):4823-4833.
[11] Chavan N L, Nayak S K, Kusurkar R S. A rapid method toward the synthesis of new substituted tetrahydro α-carbolines and α-carbolines[J].Tetrahedron,2010,66(10):1827-1831.
