大麦苗总黄酮提取工艺的优化*
2013-11-19张辉乔勇进戚文元
张辉,乔勇进,戚文元
1(上海市农业科学院作物育种栽培研究所,上海,201403)
2(上海理工大学医疗器械与食品学院,上海,200093)3(上海束能辐照技术有限公司,上海,201401)
大麦(Hordeum vulgare),属大麦属(Hordeum),早熟禾科(Poaceae),其嫩苗富含叶绿素、类黄酮、维生素、抗氧化酶及蛋白质等多种功能营养成分[1-2]。据报道大麦苗黄酮类化合物主要有皂草苷(saponarin)和大麦黄苷(lutonarin)[3-4],其自由基清除能力和抗氧化性能显著高于其他植物黄酮和黄酮碳苷[5],具有抗癌、抗炎及防治类风湿关节炎等生理功能[6-7]。目前,天然植物黄酮类化合物提取原料有银杏叶[8]、杜仲叶[9]及玉米须[10]等。以大麦苗为原料进行总黄酮定向提取并对其提取工艺参数进行响应面法优化的研究鲜有报道。大麦苗因其原料具有种植周期短、成本低、产量大、易加工及副产物利用价值大等优点,可作为总黄酮提取的原料。已有研究表明超临界流体萃取、超声波及微波辅助提取可增加植物黄酮类化合物的提取量[11-13],而本文以乙醇溶液为提取溶剂,对大麦苗总黄酮进行常温浸渍提取,采用中心组合试验设计(central composite design,CCD),优化其最佳工艺条件。
1 材料与方法
1.1 材料与试剂
六叶期大麦苗(品种:大中88-91),采收于上海市农业科学院试验田;无水乙醇(分析纯 )、NaNO2(BR)、AlCl3(BR)、NaOH(BR)、芦丁(纯度 >95%),国药集团化学试剂有限公司。
1.2 仪器与设备
1.3 试验设计
1.3.1 叶绿素提取工艺流程
大麦苗鲜样→挑选、清洗、沥干→真空冷冻干燥(预冻温度,-45℃;冷阱温度,-37℃;升华温度,25℃;真空度,170 Pa)→粉碎(100目)→浸提→过滤→滤液→减压浓缩成膏状(水浴温度,30℃;真空度,110 Pa)
1.3.2 单因素试验设计
根据预试验结果,发现乙醇体积分数、液固比和提取时间等3个因素均对大麦苗总黄酮提取量影响较大。故分别取其不同水平进行单因素试验,每组试验均进行3次平行试验,取其平均值进行研究。
1.3.2.1 不同乙醇体积分数对大麦苗总黄酮提取效果的影响
将粉碎干燥后的大麦苗过100目筛,称取麦苗粉约2.50 g,置于250 mL锥形瓶中,按液固比为30∶1(mL∶g)加入乙醇体积分数分别为55%、65%、75%、85%、95%的乙醇溶液,用封口膜将锥形瓶密封并置于摇床中以150 r/min转速摇晃浸提90 min,研究不同乙醇体积分数对大麦苗总黄酮提取效果的影响。
在经历了这样特殊的课程之后,从新加坡中学走出来的学生具有非常敏锐的“批判性思维”和“辩证思维”,他们的逻辑思维能力快速成长,也同样对于他们的学术课程大有助益。
1.3.2.2 不同液固比对大麦苗总黄酮提取效果的影响
将粉碎干燥后的大麦苗过100目筛,称取麦苗粉约2.50 g,置于250 mL锥形瓶中,按液固比分别为10∶1、20∶1、30∶1、40∶1、50∶1(mL∶g)加入乙醇体积分数为95%的乙醇溶液,用封口膜将锥形瓶密封并置于摇床中以150 r/min转速摇晃浸提90 min,研究不同液固比对大麦苗总黄酮提取效果的影响。
1.3.2.3 不同提取时间对大麦苗总黄酮提取效果的影响
将粉碎干燥后的大麦苗过100目筛,称取麦苗粉约2.50 g,置于250 mL锥形瓶中,按液固比为30∶1(mL∶g)加入乙醇体积分数为95%的乙醇溶液,用封口膜将锥形瓶密封并置于摇床中以150 r/min转速摇晃分别浸提 30、60、90、120、150 min,研究不同提取时间对大麦苗总黄酮提取效果的影响。
1.3.3 中心组合试验设计
采用中心组合试验设计对大麦苗总黄酮提取工艺参数进行优化,根据单因素试验结果,确定了CCD的试验水平(表1)。根据试验结果,可建立二次非线性回归模型(式 1)[14]。

式中:Y,总黄酮提取量预测值;Xi,Xj,试验因素的编码值;β0,βii,βij,截距及回归常数(其中,Xi=,式中X为无量纲的编码值,x为变量i的实ii际值,xio为变量i的零水平实际值。Δxi为变量i的步长实际值,即编码值变化一个单位所对应的实际变化值)。
因子贡献率采用式(2)计算[15]:

式中:SSj,因子平方和,SST,模型总平方和。

表1 中心组合试验设计因子及编码水平Table 1 Values factors and their coded levels in central composite experimental design
1.3.4 指标测定
浸提完成后将提取液置于10 000 r/min转速下低温(10℃)离心15 min,取1 mL上清液,采用硝酸铝比色法[16]测定其总黄酮含量。总黄酮提取量采用式(3)进行计算。

式中:Y,大麦苗总黄酮提取量,μg/g;m,提取液中总黄酮含量,μg/mL;M,提取样品质量,g。
1.3.5 数据处理
CCD试验数据处理采用Design-Expert 8.0.6.1(State-Ease,Inc.,USA)、SAS 9.2(SAS Inc.,USA),Origin 8.0(Electronic Arts Inc.,USA)绘制单因素图及效应图。
2 结果与分析
2.1 单因素试验结果
图1表明,大麦苗总黄酮提取量随着乙醇体积分数的增大而增高。乙醇体积分数为95%时,总黄酮提取量最高。这可能是由于大麦苗中黄酮类化合物为弱极性物质,乙醇体积分数越大,其极性越接近大麦苗中黄酮类化合物的极性,导致总黄酮溶出量升高。

图1 乙醇体积分数对总黄酮提取量的影响Fig.1 Effect of ethanol volume fraction on the flavonoids extraction yield
液固比对液相主体和固相主体之间的浓度差,即传质推动力,影响较大。此外,液固比也会影响液固两相的表观传质系数,从而影响传质速率。图2表明,随着液固比的增加,大麦苗总黄酮提取量呈现先快速升高而后增加平缓的趋势。这是因为增加液固比,传质动力增加,黄酮就更容易溶出,损失减少;但液固比大于30 mL/g后增加速度趋于平缓。由于液固比较大会造成提取溶剂的浪费及后期浓缩的困难,从总黄酮提取效果和经济边际效应两方面综合考虑,认为进行大麦苗总黄酮提取时液固比不宜高于40 mL/g。

图2 液固比对总黄酮提取量的影响Fig.2 Effect of liquid-solid ratio on the flavonoids extraction yield
由图3可知,总黄酮提取量随着提取时间的延长呈现先逐渐升高而后降低的趋势。大麦苗总黄酮提取量在提取时间为120 min时达到最大值,而在提取时间为150 min时略微降低。这可能因为延长提取时间使得更多的黄酮类化合物溶出,但一些黄酮类化合物易于氧化,提取时间过长会导致总黄酮的溶出量小于其降解量,从而使得其提取量略微降低。

图3 提取时间对总黄酮提取量的影响Fig.3 Effect of extraction time on the flavonoids extraction yield
2.2 CCD试验结果
2.2.1 回归模型的建立
试验共设20次试验,其中包括14次析因试验及6次中心点试验。所有试验均进行3次平行试验,取其平均值作为响应值,试验按随机顺序进行,其结果见表2。
利用Design-Expert 8.0软件对表2结果进行统计分析,并建立三元二次回归方程(式3):
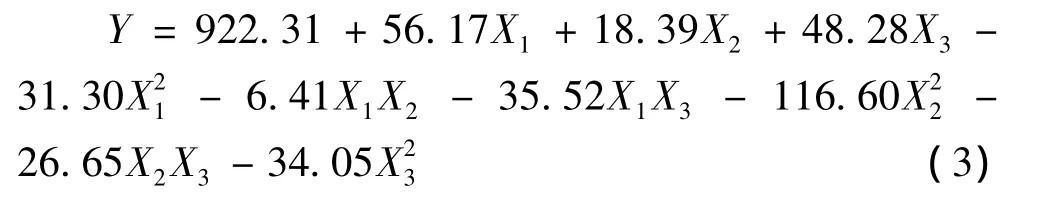

表2 CCD设计矩阵及响应值Table 2 Central composite design matrix and responses
2.2.2 回归模型的统计检验
由表3可知,判定系数(R2)为0.994 3,说明模型相关性较好,试验因子对响应值有较大影响。校正判定系数(adjR2)为0.989 1,表明98.91%的试验数据的变异性可用此回归模型来解释。变异系数(C.V.)为1.66%,表示试验的可信度和精确度较好。本试验精密度(adeq precision)为40.536 >4.0,表明其为一个适宜的信号。模型 F值为192.61,表明其达到极显著水平(P<0.01),即乙醇体积分数、液固比及提取时间等影响因素对总黄酮提取量的共同影响具有差异极显著性,且模型一次项、二次项均达到显著水平。此外,失拟F值为1.54(P=0.323 2>0.05),表明失拟值和纯误差没有显著性关系,即回归模型在被研究的整个回归区域不失拟。综上可知,该所建立模型可用于指导试验。此外,表3还表明,各一次项 、二次项和交互项X2X3、X1X3均对大麦苗总黄酮提取量影响极显著(P<0.01),交互项X1X2对总黄酮提取影响不显著 (P>0.05)。
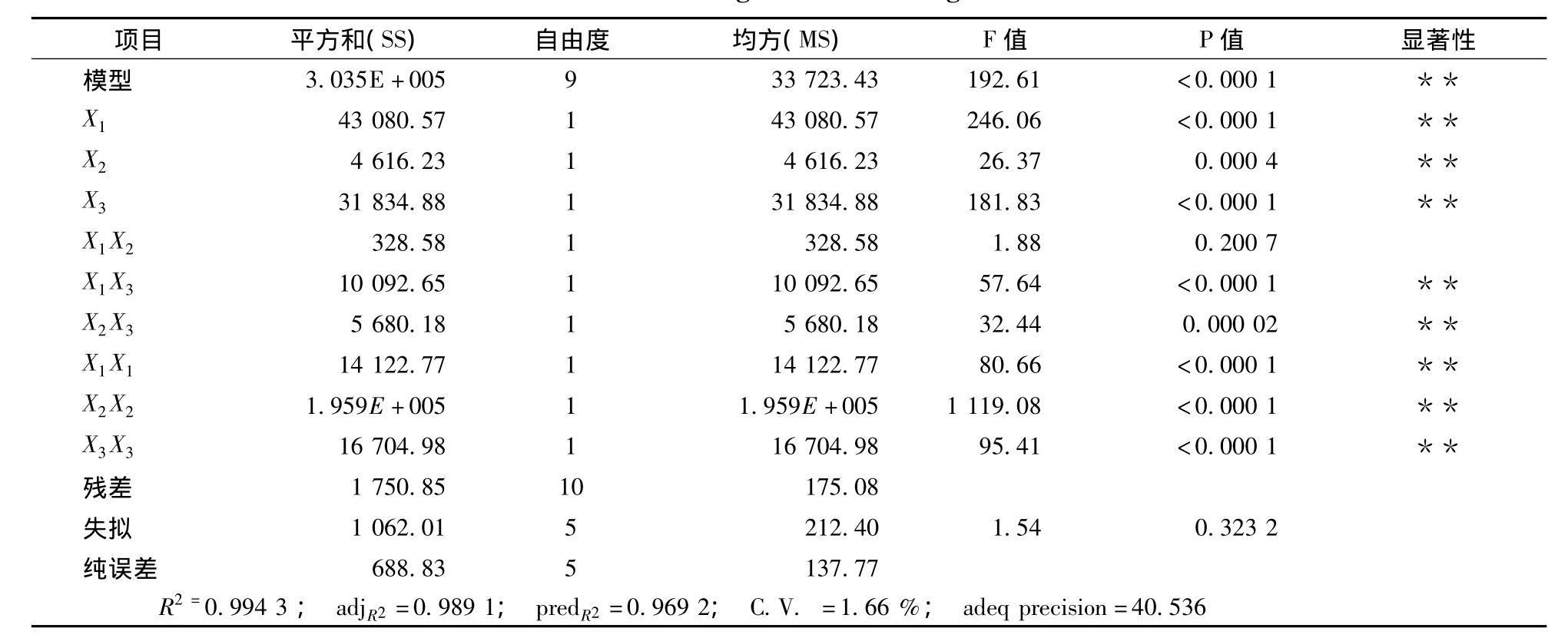
表3 回归模型显著性检验结果Table 3 Results of regression model significance test

图4 因子贡献率Fig.4 Percentage contributions of factors
2.2.3 模型效应分析
2.2.3.1 主效应分析
由于模型存在交互效应,故不宜采用回归系数的绝对值大小来直接比较二次项、交互项作用的大小。因此,本试验均采用因子贡献率来衡量各因子对总黄酮提取量的影响大小。图4-a表明,二次项效应>一次项效应>交互项效应。图4-b表明,模型各项间乙醇体积分数的二次效应影响最显著,其次是其液固比,而乙醇体积分数及液固比与乙醇体积分数的交互作用对黄酮提取量影响最小。3个试验因素的效应大小依次为液固比 >提取时间 >乙醇体积分数。
2.2.3.2 两因素效应分析
由图5-a、5-c知,大麦苗总黄酮的提取量随液固比的增加呈现先快速增长再缓慢增长的趋势。液固比的增加可增加传质动力,有助于总黄酮的溶出,但当液固比达到一定程度时,已溶出大部分总黄酮,若再增加液固比,则总黄酮提取量增加缓慢。由5-a、5-e可看出,总黄酮提取量随着乙醇体积分数的增加呈现先增大而后减小的趋势。这可能是由于在一定范围内,乙醇体积分数的增大减小了提取液极性,使其更接近于总黄酮的极性,从而增加了总黄酮的溶出。但过度增加乙醇体积分数会导致提取液极性过小,从而偏离大麦苗总黄酮极性。5-c、5-e均表明,大麦苗总黄酮提取量随着提取时间的延长曾先前期增加迅速,后期增加缓慢的趋势。这可能是由于前期已溶出大部分黄酮,后期原料自身黄酮较少,故增加缓慢;也可能由于后期有部分黄酮发生降解,但降解速率仍小于溶出速率,从而呈现增长缓慢的现象。图5-b为液固比与乙醇体积分数的等高线图,其接近圆形,表明二者交互作用不显著,图5-d、5-e分别为液固比与提取时间的等高线图及乙醇体积分数与提取时间的等高线图,其均为椭圆形状,表明二者交互效应显著,这均与方差分析结果一致。

图5 总黄酮提取量响应面图及等高线图Fig.5 Response surface plots and contour plots of total flavonoids extraction yield
2.3 反应条件的优化与模型验证
规范分析[17](canonical analysis)能求出响应面的拐点并判断其类型(最大值点、最小值点、马鞍形点)。对试验结果进行规范分析(表4),得到大麦苗总黄酮提取的一个稳定点,该点处理论响应值为950.36。由于变量X2的编码值的特征值为0.02,其较接近零值,在试验区域内可能会存在一个稳定岭系统,故一般需进行岭脊分析。

表4 规范分析结果Table 4 Results of canonical analysis
岭脊分析(aidge analysis)是在以原始设计中心点为球心,以r为半径的超球面与响应面的交点所形成的轨迹范围内探测最佳响应值[17]。岭脊分析结果(表 5)表明当超球面半径(r)为 0.8,X1、X2、X3的特征值分别为 0.728 876、0.021 37、0.329 069 时,响应值达到最大(950.346 3 μg/g),其与规范分析所得的稳定点较一致,故无稳定岭系统的存在,稳定点为理论上的最优点。
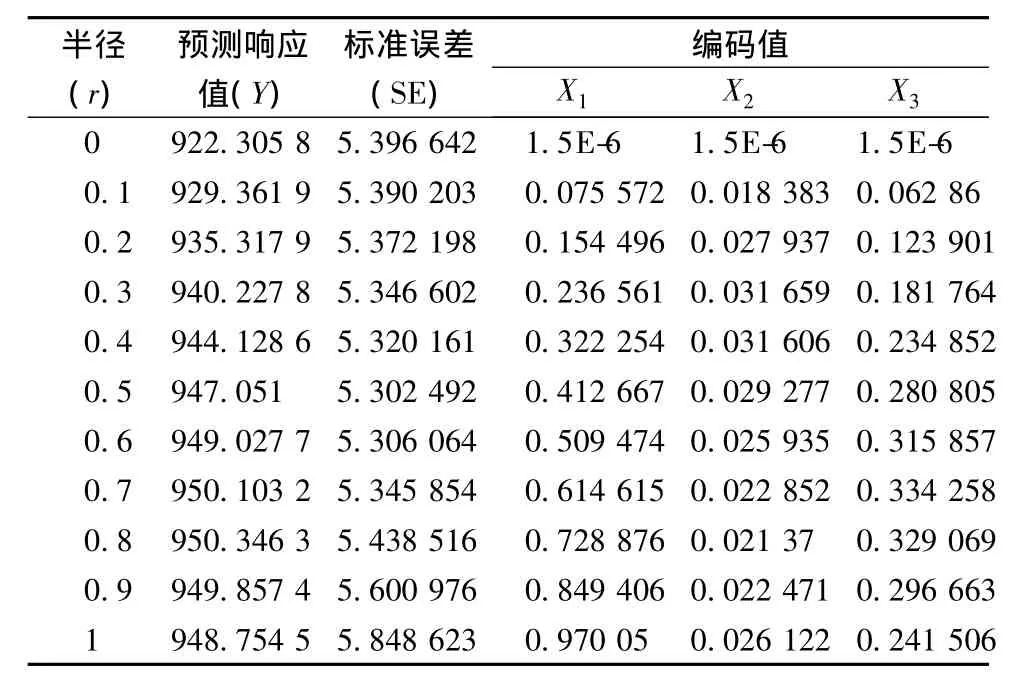
表5 脊岭分析结果Table 5 Results of ridge analysis
考虑到试验操作的便利,将总黄酮提取工艺参数修正为液固比29、乙醇体积分数90% 、提取时间100 min。采用修正后的工艺参数进行3次平行验证试验,试验结果测得大麦苗总黄酮提取量为946.63 μg/g,与模型预测值相差 3.73 μg/g,差异在误差允许范围内。
3 结论
本试验通过CCD试验设计建立了影响因子与大麦苗总黄酮提取量之间的三元二次回归模型,确定了大麦苗总黄酮最佳提取工艺参数为液固比29 mL/g、乙醇体积分数90% 、提取时间100 min,在此工艺条件下,大麦苗总黄酮提取量为946.63 μg/g,其与预测值950.36 μg/g较一致。故该模型能反映大麦苗总黄酮提取过程的内部规律,可较好地预测大麦苗总黄酮的提取情况,并能为黄酮类化合物提取原料的来源、进一步提高大麦嫩苗资源利用率及大麦苗黄酮类化合物工业化生产提供理论参考。
[1] Singh N,Verma P,Pandey B R.Therapeutic potential of organicTriticum aestivumLinn.(wheat grass)in prevention and treatment of chronic diseases:an overview [J].International Journal of Pharmaceutical Sciences and Drug Research,2012,4(1):10-14.
[2] Peeva V N,Tóth S Z,Cornic G,et al.Thermoluminescence and P700 redox kinetics as complementary tools to investigate the cyclic/chlororespiratory electron pathways in stress conditions in barley leaves[J].Physiologia Plantarum,2012,144(1):83-97.
[3] Benedet J A,Umeda H,Shibamoto T.Antioxidant activity of flavonoids isolated from young green barley leaves toward biological lipid samples[J].Journal of Agricultural and Food Chemistry,2007,55(14):5 499-5 504.
[4] Osawa T,Katsuzaki H,Hagiwara Y,et al.A novel antioxidant isolated from young green barley leaves[J].Journal of Agricultural and Food Chemistry,1992,40(7):1 135-1 138.
[5] Kamiyama M,Shibamoto T.Flavonoids with potent antioxidant activity found in young green barley leaves[J].Journal of Agricultural and Food Chemistry,2012,60(25):6 260-6 267.
[6] Ben-Arye E,Goldin E,Wengrower D,et al.Wheat grass juice in the treatment of active distal ulcerative colitis:a randomized double-blind placebo-controlled trial[J].Scandinavian Journal of Gastroenterology,2002,37(4):444-449.
[7] Dey S,Sarkar R,Ghosh P,et al.Effect of Wheat grass Juice in supportive care of terminally ill cancer patients-a tertiary cancer center experience from India[J].J Clin Oncol,2006,24:8 634.
[8] Chen S,Xing X,Huang J,et al.Enzyme-assisted extraction of flavonoids from Ginkgo biloba leaves:Improvement effect of flavonol transglycosylation catalyzed byPenicilliumdecumbens cellulose[J].Enzyme and Microbial Technology,2011,48(1):100-105.
[9] Huang W,Xue A,Niu H,et al.Optimised ultrasonic-assisted extraction of flavonoids from Folium eucommiae and evaluation of antioxidant activity in multi-test systems in vitro[J].Food Chemistry,2009,114(3):1 147 - 1 154.
[10] Liu J,Lin S,Wang Z,et al.Supercritical fluid extraction of flavonoids from Maydis stigma and its nitrite-scavenging ability[J].Food and Bioproducts Processing,2011,89(4):333-339.
[11] Qu Y,Tong G,Wang B,et al.Optimized microwave-assisted extraction of flavonoids from Tamarix chinensis and evaluation of antioxidant activityin vitro[C] //Remote Sensing,Environment and Transportation Engineering(RSETE),2011 International Conference on.IEEE,2011:7 697-7 700.
[12] Zhang Q A,Fan X H,Li T,et al.Optimisation of ultrasound extraction for flavonoids from semen astragali complanati and its identification by HPLC‐DAD‐MS/MS[J].International Journal of Food Science& Technology,2013.doi:10.1111/ijfs.12178.
[13] Shan B,Xie J,Zhu J,et al.Ethanol modified supercritical carbon dioxide extraction of flavonoids fromMomordicacharantiaL.and its antioxidant activity[J].Food and Bioproducts Processing,2012,90(3):579-587.
[14] Maran J P,Manikandan S.Response surface modeling and optimization of process parameters for aqueous extraction of pigments from prickly pear(Opuntia ficus-indica)fruit[J].Dyes and Pigments,2012,95(3):465 -472.
[15] Maran J P,Manikandan S,Thirugnanasambandham K,et al.Box-behnken design based statistical modeling for ultrasound-assisted extraction of corn silk polysaccharide[J].Carbohydrate Polymers,2013,92(1):604-611.
[16] Jia Z S,Tang M C,Wu J M.The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals[J].Food Chemistry,1999,64(4):555-559.
[17] Draper N R.Ridge analysis of response surfaces [J].Technometrics,1963,5(4):469-479.
