江苏啤酒大麦制麦过程中细菌群落结构分析*
2013-11-19王璐梁小刚陆健
王璐,梁小刚,陆健
1(无锡中粮工程科技有限公司,江苏无锡,214035)
2(江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡,214122)
3(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)
我国啤酒产量已连续十多年位居世界之首,啤酒行业对啤酒生产原料的需求还会持续增加[1]。啤酒大麦是啤酒生产的主要原料之一,大麦中复杂的微生物群落(革兰氏阴性、阳性细菌,酵母和丝状真菌)对麦芽制造及啤酒酿造有着非常重要的影响[2]。江苏啤酒大麦在国产啤酒大麦中占有重要的位置,但其收获季节频遇雨季,容易受到各种微生物的侵染,致使麦芽品质有不同程度的下降,甚至影响到啤酒的酿造[3]。真菌微生物能产生各类真菌毒素、啤酒酵母提前絮凝因子等[2,4],国内已经关注啤酒大麦中的真菌群落结构及其对麦芽品质造成的影响[5-7]。由于江苏地理环境与气候等因素的影响,细菌在江苏啤酒大麦中存在的种类与数量很多,对麦芽酿造品质的影响(麦汁过滤速度缓慢、导致啤酒风味改变等)也很突出[2,8-9],因此,有必要详细了解江苏啤酒大麦制麦过程中的细菌群落结构,为进一步研究其对麦芽酿造品质的影响提供依据。
啤酒大麦微生物群落中细菌的数量最多,有研究称一个单一的大麦麦粒上面附着着约50万个细菌,如此多的细菌势必会对制麦过程及麦芽品质造成影响[10]。如想更加清楚地了解江苏啤酒大麦制麦过程中的细菌群落结构,需要选择合理的检测手段。而传统分离培养的方法存在一些弊端,需针对不同细菌种类设计不同的培养基,且需要较长的培养时间,耗费大量的人力物力等[11]。聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术在微生物群落结构的分析方面已得到广泛的应用[5],但国内尚未有利用PCR-DGGE分析江苏啤酒大麦制麦过程中细菌群落结构的报道。将传统分离培养方法与PCR-DGGE技术相结合,会使分析结果更加准确、全面[12]。
本文利用传统平板计数结合PCR-DGGE技术,对江苏目前的主要品种(单二)啤酒大麦制麦过程中的细菌群落进行了较为详细的分析,旨在了解江苏啤酒大麦制麦过程中细菌群落结构,为进一步了解细菌对江苏啤酒大麦麦芽品质的影响打下基础。
1 材料与方法
1.1 实验材料
江苏单二啤酒大麦,在江苏某麦芽企业生产现场(塔式制麦)取样,每个样品都随机取样3次(即在3批次投料过程中分别取样)。制麦工艺如下:锥底浸麦:浸麦水温度14~15℃,湿浸6.5 h,干浸7.5 h;平底浸麦:水温14~15℃,湿浸6.5 h,干浸7.5 h,浸麦度达到41% ~42%;发芽:温度15~16℃,水分含量44% ~46%,时间85~90 h;排潮:温度从57℃逐渐上升至65℃,时间15~16 h;焙焦:温度从75℃逐渐升至83℃(85℃),时间6~7 h,维持83℃(85℃)3 h。
1.1.2 主要试剂
Fast DNA○RSpin Kit For Soil,购自美国 MP Bio-medicals公司;去离子甲酰胺、丙烯酰胺、甲叉双丙烯酰胺、尿素,均购自上海生工生物工程有限公司;Wizard○RGenomic DNA Purification Kit,购自 Promega;PCR所用试剂、DNA Marker、pMD18-T Vector试剂盒、Agarose Gel DNA Extraction Kit,均购自 TaKaRa公司;Gold view,赛百盛生物工程有限公司;SYBR GreenⅠ,北京优尼康生物科技有限公司;其余试剂购自国药集团化学试剂公司,均为分析纯。PCR扩增所用引物,由上海生工生物工程有限公司合成。
1.1.3 主要仪器设备
DCodeTMUniversal Mutation Detection System、Gel Doc XR凝胶成像系统:BioRad公司,USA;Mastercycler nexus gradient梯度PCR仪:德国Eppendorf公司;FastPrep○R快速核酸提取仪(FP120),美国 MPbio 公司;Gene Quant核酸蛋白定量仪GZNQVA,Biochrom,UK。
1.1.4 培养基
Luria-Bertani(LB)培养基,LB选择性培养基,Nutrient Aagar(NA)培养基,MRS培养基等配方,参照文献[13]。
传统新闻报道主要以专业、权威的报道叙述为主,为了适应新媒体语境,各报业机构开办的官方微博、微信增强了亲近性表达方式。例如,人民日报海外版微信公众号“侠客岛”将“岛叔”形象贯穿文本,通过将官媒人格化的方式拉近与用户之间的距离。从报业机构自身来看,其改变了以往高高在上的刻板印象,以更具人性化的形象扩大自身的影响力。而从用户角度来看,增强了其与媒体及其他用户的互动交流,也主动掌握了在新闻事件中的话语权。
1.2 实验方法
1.2.1 传统平板计数
详细步骤参照文献[14]。
1.2.2 啤酒大麦、麦芽总DNA的提取
称取0.1 g粉碎后的样品,用Fast DNA○RSpin Kit For Soil试剂盒进行样品总DNA提取,提取步骤参照说明书,得到的粗DNA进行0.8%的琼脂糖凝胶电泳验证后存于-20℃备用。
1.2.3 PCR扩增
研究中采用嵌套式PCR反应对细菌16S rDNA进行扩增,选用的引物参见表1。PCR反应物(25 μL)中加有模板 DNA 0.5 μL,引物各 0.4 μmol/L,dNTPs 0.2 mmol/L,rTaq酶2.5 U,Tris-HCl(pH 8.3)10 mmol/L,KCl 50 mmol/L,MgCl21.5 mmol/L,ddH2O补足至 25 μL。同时每一次实验都要用ddH2O代替模板DNA做阴性对照。第1轮PCR反应产物稀释50倍后当做第2轮PCR反应中的模板DNA。反应程序如下:27F-1492R:95℃ 5 min;95℃1 min,50 ℃ 1 min,72℃ 1 min,30 个循环;72℃ 10 min;F341(GC)-R518:94℃ 4 min;94℃ 45 s,55℃45 s,72 ℃ 45 s,30个循环;72 ℃ 10 min。各步的PCR产物用1.5%的琼脂糖凝胶电泳进行检测。
1.2.4 DGGE分析
利用DCodeTMUniversal Mutation Detection System进行DGGE分析。电泳条件:8%的聚丙烯酰胺凝胶;变性剂(100%的变性剂浓度为7 mol/L尿素,40%甲酰胺)梯度范围为45% ~65%,电泳时间5.5 h;电泳温度60℃;电压150 V;电泳缓冲液为1×TAE buffer。上样前在60℃,150 V的条件下预电泳30 min。电泳结束后用SYBR GreenⅠ染色45 min,分3次进行,染色结束后用BioRad,Gel Doc XR凝胶成像系统进行拍照,利用Quantity One软件对DGGE指纹图谱进行聚类分析,计算生物多态性指数。DGGE条带鉴定参照文献[15]。
1.2.5 统计分析
利用生物学软件Quantity One(Quantity One 4.6.2,BioRad,USA)对DGGE指纹图谱进行处理分析,其中Phylogenetic Tree的聚类方法为UPGAMA。利用古生物学统计软件Palaeontology Statistics,(http://folk.uio.no/ohammer/past/)进行生物多样性指数的计算和PCA(Principal Component Analysis)分析。

表1 实验中所用的PCR引物Table 1 PCR Primers used in this study
2 结果与分析
2.1 采用分离培养法对江苏啤酒大麦制麦过程中细菌群落进行分析
对各种微生物的计数结果见图1,江苏啤酒大麦制麦过程中细菌数量有明显的变化:锥底浸麦时细菌数量有明显减少,平底浸麦和发芽阶段的细菌数量迅速增加,到发芽结束时细菌数量达到最大,而后随着干燥的进行细菌数量不断减少,但成品麦芽中的细菌数量比大麦还是有所增加。制麦过程的浸麦和发芽阶段是各种微生物迅速增加的两个主要阶段,浸麦阶段大麦的水分不断增加,最终可达43% ~45%,非常适合细菌生长。而干燥阶段的高温会抑制微生物的生长甚至使部分菌群致死。利用一般常用的培养基对制麦过程大麦中的细菌进行分离,只能得到一部分细菌,如果要更加全面地检测出尽可能多的细菌种类,需要配制多种有针对性的培养基进行分离,同时培养条件也要随着菌种的不同而做调整[4]。
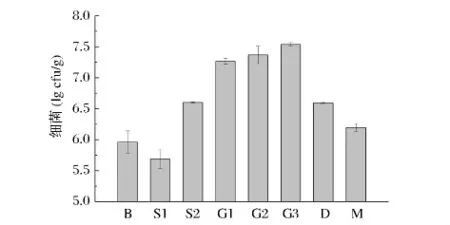
图1 江苏啤酒大麦制麦过程中细菌数量的变化情况Fig.1 Changes of total count of bacteria in malting process of Jiangsu malting barley using culture methods
2.2 nested PCR-DGGE对江苏啤酒大麦制麦过程中的细菌群落进行分析
将样品粉碎后,用Fast DNA Spin Kit For Soil进行总DNA的提取,以样品总DNA为模板,按照1.2.3中的条件对细菌16S rDNA进行嵌套PCR扩增,扩增产物按照1.2.4的条件进行16S rDNA的DGGE分析,DGGE指纹图谱见图2。
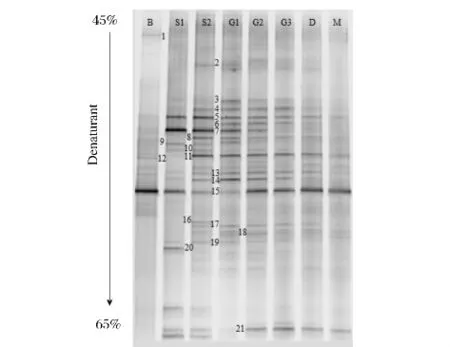
图2 制麦过程细菌16S rDNA PCR产物的DGGE指纹图谱(编号B~M如图1所述)Fig.2 16S rRNA gene DGGE fingerprinting of bacteria communities using the primers GC-F341/R518
图2表明,制麦过程不同样品中细菌条带有明显变化,大麦从浸麦到发芽,细菌种类显著增多,而干燥、焙焦后的成品麦芽中细菌种类又明显减少。其中条带15在制麦过程的各阶段都存在,其在大麦中含量相当丰富,最终麦芽中该细菌的量依然不少。
利用生物学软件Quantity One对单二大麦制麦过程中细菌16S rDNA DGGE指纹图谱(图2)进行分析,得到量化数据及聚类分析图(见图3),利用PAST软件进行生物多样性指数计算(表2)与PCA分析(图4)。从图3可以看出,啤酒大麦在储藏、浸渍、发芽、焙焦等不同阶段的细菌群落特征明显不同,同阶段样品的细菌群落相似度较高,聚类结果非常接近,两种引物的聚类结果略有不同。GC-F341/R518的聚类结果中样品1、7和8分为一组,其余制麦中的样品分为一组。
制麦过程中样品细菌生物多样性指数(表2)反映了大麦在制麦过程中细菌群落的丰富程度,从分析结果可知,大麦及成品麦芽的生物多样性远不及浸麦和发芽阶段的样品,GC-F341/R518引物对中的发芽样品(G2)的物种丰度最高,香浓指数和辛普森指数也是最高,分别达到2.912和0.9409,但其细菌物种均匀性指数不是最高,为0.9198。

图3 制麦过程样品细菌16S rDNA nested PCR-DGGE的聚类分析(编号B~M如图1所述)Fig.3 Cluster analysis of 16S rRNA gene DGGE fingerprinting of bacteria communities using the primers GC-F341/R518

图4 细菌16S rDNA DGGE图谱的PCA分析(编号B~M如图1所述)Fig.4 PCA of the bacteria composition by PCR-DGGE analysis using primer sets GC-F341/R518
GC-F341/R518引物对的PCA分析(图4)结果显示,第一个主成分占44.48%,第二个主成分占29.68%。制麦过程中各样品的分布相对分散,说明其中的细菌群落有明显差异,主成分1最有可能受到样品水分含量等的影响,主成分2主要受制麦工艺的影响。结果表明,制麦过程由于样品水分含量、含氧量等条件的改变,细菌群落不断发生着变化,排潮、焙焦结束后部分细菌被高温环境抑制,细菌种类和数量急剧减少,但与大麦相比依然比较丰富,这与平板分离的结果一致。

表2 制麦过程样品细菌16S rDNA Nested PCR-DGGE的生物多样性指数Table 2 Microbial diversity indices calculated from the DGGE banding patterns shown in Fig.2
表3是制麦过程中各样品细菌16S rDNA DGGE条带的核酸序列分析结果。经分析,江苏啤酒大麦制麦制麦过程中革兰氏阴性细菌有不动杆菌属(Acinetobactersp.)、肠杆菌属(Enterobacter hormaechei)、欧文氏菌属(Erwinia tasmaniensis)、黄杆菌属(Flavobacteriumsp.)、克吕沃尔氏菌属(Kluyverasp.)、泛菌属(Pantoeasp.)、法氏沃氏菌(Wautersiella falsenii),革兰氏阳性细菌有乳杆菌属(Lactobacillussp.)、明串珠菌属(Leuconostoc lactis)、链球菌属(Streptococcussp.)及多种未培养细菌(uncultured bacterium)。其中最主要的革兰氏阴性菌为泛菌属和不动杆菌属,最主要的革兰氏阳性菌为乳杆菌属,革兰氏阴性菌明显多于革兰氏阳性菌。克吕沃尔氏菌属在制麦过程中一直存在且数量较多,其为小的杆状细胞,与肠杆菌属的定义相符。细菌产生的胞外多糖能够造成酿造过程过滤困难,而江苏啤酒大麦制麦过程出现的肠杆菌属、乳杆菌属等细菌很多都会产生胞外多糖,这些细菌快速生长过程产生的胞外多糖可能降低了麦芽的过滤性能。此外,有研究表明泛菌属、欧文氏菌属等细菌会影响麦汁和啤酒的过滤,从而造成啤酒混浊问题[16]。浸麦阶段,好氧细菌会与大麦竞争氧气进而抑制大麦的发芽。此外,大量细菌增值可能造成生物膜,同样会对麦芽的过滤性能造成损害。
啤酒大麦中主要有欧文氏菌属、链球菌属、乳杆菌、克吕沃菌属和不动杆菌属。浸麦阶段,样品水分含量增加,许多其他细菌开始生长,如肠杆菌属和泛菌属细菌,浸麦也会洗掉部分细菌如Acinetobacter johnsonii。发芽阶段样品中的细菌数量达到峰值,细菌种类也是最丰富的。排潮结束样品中细菌种类有所减少,如Pantoea agglomerans和Flavobacteriumsp.。焙焦后成品麦芽中细菌种类较之前有明显减少,但数量仍多于大麦,乳杆菌属、明串珠菌属和链球菌属等细菌均未被检测到。此外,条带16代表Streptococcus iniae只在浸麦后期样品S2中检测到,极有可能是浸麦水带入。
图5是制麦过程中细菌群落的系统进化树,革兰氏阴性菌和革兰氏阳性菌都有很好的亲缘分类,革兰氏阳性菌中最主要的是乳酸菌,革兰氏阴性菌种类较多。图5中肠杆菌属、泛菌属、欧文氏菌属与克吕沃尔氏菌属细菌同属于肠杆菌科,所以在进化树中亲缘关系最近;乳杆菌属、明串珠均属与链球菌属细菌亲缘关系接近;法氏沃氏菌和黄杆菌属细菌同属于黄杆菌科,亲缘关系接近。

表3 制麦过程样品细菌16S rDNA nested PCR-DGGE条带鉴定结果Table 3 Sequencing results of the bands cut from the DGGE gels of the bacteria community
3 结论与讨论
江苏啤酒大麦制麦过程中细菌数量不断发生着变化,浸麦初期细菌数量明显减少,浸麦后期及整个发芽阶段,细菌的数量都在不断增加,发芽结束时达到峰值;干燥阶段细菌数量不断减少,成品麦芽中的细菌数量与最初的大麦相比略有增加。所以,加强制麦过程中洗麦工作对减少细菌数量,降低细菌对麦芽品质的影响至关重要。此外,成品麦芽的储藏条件需要格外关注,一旦储藏条件不合适,将会导致麦芽中微生物数量急剧增加,进而降低麦芽质量。
江苏啤酒大麦制麦过程中主要的细菌有Acinetobacter,Enterobacter,Erwinia,Flavobacterium,Kluyvera,Lactobacillus,Lactococcus,Leuconostoc,Pantoea,Streptococcus,以及Wautersiella。其中Enterobacter,Erwinia和Pantoea是啤酒大麦中最常见的细菌。Laitila曾利用PCR-DGGE对啤酒大麦制麦过程中细菌进行了分析,也鉴定出Enterobacter,Erwinia和Pantoea这3种细菌[11]。Streptococcus在啤酒大麦中并不常见,可能是环境中的细菌,因此制麦过程做好设备环境等卫生工作也非常重要。
另外,还对比了制麦过程中单二大麦与加拿大Metcarlfe大麦的细菌群落结构差异,发现单二大麦制麦过程中细菌数量明显偏高,单胞菌细菌较少,这些差异对单二麦芽品质有着潜在的影响。
通过比较传统平板培养法分离得到的微生物和DGGE分析得到的微生物的种类,发现传统分离得到的大部分微生物均会在DGGE分析中出现,但也有像Lysinibacillus fusiformis这样的细菌并未在分子鉴定中出现,同时DGGE中检测到的很多细菌种类并没有在传统分离培养中获得,这可能有以下原因:DGGE分析中需要得到样品中微生物的基因组才能最终检测到该种微生物,但实际操作中无法非常全面地将所有细菌的DNA提取得到,尤其是原本数量较少的细菌种类;传统分离培养不仅耗时,而且单一的培养基无法适合所有细菌的生长,只能得到少数种类的细菌。传统平板培养法与DGGE分析相结合是比较合适的分析大麦细菌群落结构的。

图5 制麦过程样品细菌16S rDNA序列系统发育树Fig.5 Phylogenetic relationships of 16S rDNA sequences of the bacteria community
[1] 陈明贤,张国平.全球大麦发展现状及中国大麦产业发展分析[J].大麦与谷类科学,2010(4):1-4.
[2] van Nierop S,Rautenbach M.The impact of microorganisms on barley and malt quality-A review[J].Journal of the American Society of Brewing Chemists,2006,64(2):69-78.
[3] 梁刚.啤酒大麦和麦芽微生物对啤酒质量的影响[J].酿酒科技,1999,91(1):56 -57.
[4] Flannigan B.The microbiota of barley and malt.3rd Edition[M].New York:Kluwer Academic/Plenum Publishers.2003:113 -180.
[5] 梁小刚,蔡国林,陆健,等.利用nested PCR-DGGE技术分析江苏啤酒大麦真菌群落结构[J].食品与发酵工业,2012,38(8):1 -6.
[6] 梁小刚.江苏啤酒大麦制麦过程中微生物的研究[D].无锡:江南大学,2013.
[7] 金昭.啤酒酿造过程中脱氧雪腐镰刀菌烯醇的初步研究[D].无锡:江南大学,2009.
[8] 慕钰文.江苏啤酒大麦麦芽中β–淀粉酶对过滤性能的影响[D].无锡:江南大学,2013.
[9] Pavel K,Krizek M.A review of biogenic amines and polyamines in beer[J].Journal of the Institute of Brewing,2003,109(2):123 -128.
[10] Laitila A.Microbes in the tailoring of barley malt properties[D].Helsinki,Finland:University of Helsinki,2007.
[11] Laitila A,Kotaviita E,Peltola P,et al.Indigenous microbial community of barley greatly influences grain germination and malt quality[J] .Journal of the Institute of Brewing,2007,113(1):9 -20.
[12] Tae-Woon Kim,Jun-Hwa Lee,Sung-Eon Kim,et al.A-nalysis of microbial communities indoenjang,a Korean fermented soybean paste,using nested PCR-denaturing gradient gel electrophoresis[J].International Journal of Food Microbiology,2009,131:265 -271.
[13] 周德庆.微生物学实验教程,[M].北京:高等教育出版社,2006.372-374.
[14] 苏红旭,王璐,徐凯,等.制麦过程中微生物菌群的变化[J].食品与生物技术学报,2011,30(5):745-749.
[15] 张中华.绍兴黄酒麦曲中微生物群落结构的研究[D].无锡:江南大学,2012.
[16] Priest FG,Campbell I.Brewing microbiology.3rd Edition[M].New York:Kluwer Academic/Plenum Publishers,2003:113 -132.
