氮源、光照对缺刻缘绿藻总脂、花生四烯酸和色素积累的影响
2013-11-19翟映雪冷云衣尧王振
翟映雪,冷云,衣尧,王振
1(青岛科技大学化工学院,山东青岛,266042)
2(青岛农业大学食品科学与工程学院,山东青岛,266109)
微藻中存在着大量的、结构特殊的有机化合物,如油脂、多不饱和脂肪酸(PUFA)、色素、多糖等[1],且具有生物量积累快,蕴量丰富等特点而备受研究者关注。微藻生物易受胁迫环境条件(如光照、温度和营养盐限制等)的影响,使其生理机能发生变化,从而导致微藻的生化成分发生较大的改变[2]。氮饥饿使藻体中的蛋白质和碳水化合物的比例变化明显,为储存光合作用产生的能量,保护光合作用器官免受光抑制的伤害,藻体细胞合成大量油脂以保证藻体正常生长[3]。光照条件是影响藻类光合作用以及生物量积累的重要因素,PUFA合成、类脂的含量、以及PUFA在总脂中的相对含量都与光照强度有密切的联系[4]。处于不同光照条件下的藻体其色素成分发生改变也是细胞为避免因光照而受到损害的一种保护机制[5]。
缺刻缘绿藻(Parietochloris incisa)是一种单细胞球状绿藻。它不仅具有一般微藻生长繁殖速度快,易于大规模培养等优点,最为有价值的是它的细胞中含有丰富的花生四烯酸(arachidonic acid,AA)[3]。AA是人体必需的高度不饱和脂肪酸,也是中枢神经系统和内循环系统中起重要作用的白三烯和前列腺素的前体、母乳成分[6],具有重要的生物学功能。近年来,国内对缺刻缘绿藻的研究大多是关于分子生物学[6-9]方面的。营养盐缺失条件(如氮、磷)对AA 积累的影响也有较多报道[3,10],但对其油脂和色素影响的报道则很少。为此,本文以缺刻缘绿藻为材料,在氮饥饿能提高该藻AA含量的研究基础上,考虑藻类在胁迫条件下细胞中特殊的有机化合物发生改变,主要研究了氮源和不同光强对缺刻缘绿藻生长,色素,总脂和AA积累的影响,并分析了AA与油脂产量的关系,以期为AA的工业化生产提供参考,为大规模培养提供科学依据。
1 材料与方法
1.1 藻种
缺刻缘绿藻(Parietochloris incisa)H4301,购自布拉格查理大学藻类培训中心(CAUP)。
1.2 培养条件及实验设置
将藻接种于 BG-11培养基[11],培养温度为25℃,荧光灯提供光源,光照和黑暗时间比为12 h∶12 h。向培养基中充入过滤空气,培养至对数期(约14 d)。
实验在直径为6 cm柱状光合生物反应器中进行。离心收集藻体,调整离心机转速为5 500 r/min,离心5 min后将藻细胞转入新鲜的或缺氮(培养基中不添加NaNO3)的BG-11培养基中,分别于35 μmol photons/(m2·s),130 μmol photons/(m2·s),280 μmol photons/(m2·s)光照强度下培养。设置3个重复实验。
1.3 生物量的测定
预先将15 mL离心管干燥并称重。取10 mL培养至16 d的藻液于离心管中,离心去除培养基并用蒸馏水清洗3次,在鼓风干燥器中于95℃下烘干至恒重。称量干燥后含有藻体的离心管并减去空管的质量以得到藻体的干重。
1.4 总脂含量的测定
参照 Zhekisheva[12]的方法进行。准确称取 50 mg冻干藻粉氯仿、甲醇混合溶液(体积比1∶2),超声连续破碎5 min,至藻体发白。5 500 r/min离心10 min后取上清液于离心管中。上清液中加入适量的氯仿和1%NaCl溶液中,使氯仿∶甲醇∶1%NaCl体积比为1∶1∶1,离心分层。取下层于已经干燥、称重的离心管中,50℃氮气吹至恒重。
1.5 花生四烯酸含量分析
将提取的总脂置于10 mL具塞试管中,加入KOH-甲醇溶液5.00 mL,再加20.00 μL浓度为1.50 mg/mL的十九碳酸内标,混匀,充氮气保护,置于60℃水浴环境下皂化60 min。将皂化好的样品取出冷却后加入HCl-甲醇(体积比1∶9)溶液4.0 mL,混匀,在60℃水浴甲酯化20 min,将甲酯化好的样品冷却后加入饱和食盐水3.00 mL,加入正己烷1.00 mL,充分振荡,静置,取正己烷层用无水Na2SO4脱水后进行色谱分析[13]。样品经气相色谱仪分析(安捷伦7890A/5975C),面积归一法计算花生四烯酸的相对百分含量。
1.6 色素含量测定
取50.00 mL藻液,5 500 r/min离心3 min,藻体沉淀加入5.00 mL DMSO放于70℃水浴锅中5 min。8 000 r/min离心2 min取上清液。测定上清液在480 nm、650 nm 和 666 nm 处的吸光度,用 Solovchenko[14]的公式计算叶绿素a、叶绿素b和总类胡萝卜素的含量。
1.7 数据处理
实验结果值为:平均值±标准差(n=3);数据结果选用SPSS17.0软件进行方差分析。
2 结果与分析
2.1 不同光强、氮源对缺刻缘绿藻生长的影响
不同光强、氮源对缺刻缘绿藻生物量的影响如图1。在 35 μmol photons/(m2·s)低光照强度下,有氮源培养基和无氮源培养基中的藻体生长都是相对缓慢的,其藻体最终生物量分别达到2.87 g/L和3.10 g/L。在 135 μmol photons/(m2·s)中等光强下,有氮源培养基中藻体的生物量以平均每天0.46 mg的速度增长,16 d后最终达到6.10 g/L,该藻在无氮源培养基中平均以0.26 mg/d的速度增长,最终生物量为4.28 g/L,有氮源培养基中藻体生物量是相同光强下无氮源培养基的1.43倍。在280 μmol photons/(m2·s)高光照强度下,有氮源培养基中藻体的最大生物量(7.30 g/L)是无氮源培养基中藻体最大生物量(4.18 g/L)的1.75倍。上述结果表明在中、高光照强度下,有氮源的培养基更有利于该藻生物量的增加。
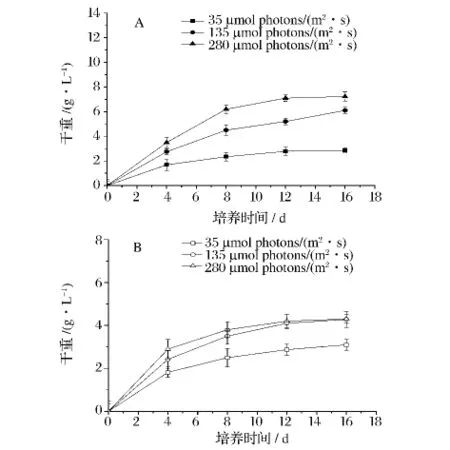
图1 不同胁迫条件下缺刻源绿藻的生物量Fig.1 The biomass of Parietochloris incisa in different stress conditions
2.2 总脂肪酸含量分析
不同光强,氮源对缺刻缘绿藻总脂肪酸含量的影响结果见图2。在有氮源培养基中,低光照强度培养的藻体,总脂肪酸含量仅仅由9.89%增加到10.28%,增加量极为不显著(P>0.05);135 μmol photons/(m2·s)中等光照强度藻体培养至第16天总脂肪酸含量达到19.69%,较初始含量提高了99.09%;相同培养基中,最高的总脂肪酸含量为280 μmol photons/(m2·s)高光照强度下培养的藻体,在培养至第16天后达到32.78%,较初始含量提高了231.44%。无氮源培养基中的藻体,在低、中、高3种光强下总脂肪酸的含量均成上升趋势,在第16天达到最大值,最大值分别为 23.22%,32.75%,38.02%。3者增加的总脂肪酸含量均较为显著(P<0.05),分别为初始含量的1.93倍,2.73倍和3.17倍。

图2 不同胁迫条件下缺刻源绿藻总脂肪酸含量(A:有氮源培养;B:无氮源培养)Fig.2 The total fatty acids of Parietochloris incisa in different stress conditions
2.3 花生四烯酸含量分析
不同光强,氮源对缺刻缘绿藻总脂含量的影响结果见图3。在所有培养条件下,藻体中花生四烯酸的含量都呈上升趋势,同样光照强度下,无氮培养基中产物积累量相对更高。中等光照强度无氮源条件下,获得花生四烯酸产量最高,为16.10%。
在培养大值件中体总脂肪酸增加量呈现相似的趋势花生四烯酸含量与总脂肪酸含量的相关性分析如图4。花生四烯酸含量与总脂肪酸含量呈一定线性关系(P<0.05,r2=0.67),两者有相似的增长趋势。
2.4 色素成分分析
不同光强,氮源对缺刻缘绿藻叶绿素、类胡萝卜素含量的影响结果见图5。在有氮源培养基中,低光照下培养的藻体叶绿素含量呈缓慢上升的趋势;高光照强度下培养的藻体叶绿素含量在第8天达到最大值,最大含量为80.60 mg/L,随后叶绿素的含量逐渐下降;中光照强度下培养的藻体叶绿素含量明显高于前两者(P<0.05),第12天达到最大值,为150.20 mg/L。在无氮源培养基中藻体叶绿素含量均为下降趋势。低、中光照强度培养基中藻体叶绿素含量在培养前4天缓慢地上升随后开始下降,而在高光照强度培养基中藻体叶绿素含量一直呈下降趋势。
在有氮源培养基中,无论光线强弱,类胡萝卜素含量在培养的前12天中均呈上升趋势,中、高光照强度培养基中类胡萝卜素含量增加趋势明显,并在第12天达到最大值,低、中、高光照强度培养基中类胡萝卜素含量的最大值分别为16.52、31.93、24.84 mg/L,随后都呈现下降趋势。无氮源培养基中藻体类胡萝素含量远远低于有氮源培养基中类胡萝卜素含量,无论光照度强弱,其最大类胡萝卜含量均不超过10.00 mg/L。

图3 不同胁迫条件下缺刻源绿藻花生四烯酸的含量(A:有氮源培养;B:无氮源培养)Fig.3 The arachidonic acid of Parietochloris incisa in different stress conditions

图4 缺刻源绿藻总脂肪酸含量与花生四烯酸含量的相关性分析Fig.4 The relationship between total fatty acids and arachidonic acid in Parietochloris incisa

图5 不同胁迫条件下缺刻源绿藻的色素含量Fig.5 The pigment content of Parietochloris incisa in different stress conditions
3 讨论
实验结果表明,光照强度和氮源都是影响缺刻源绿藻生长的重要因素。在高光照有氮源培养基中缺刻源绿藻达到最大的生物量,而在无氮源培养基中,其生长速度较慢且生物量较低。这与Solovchenko[14]的研究结果一致。缺刻源绿藻生物量和脂肪酸积累的数据符合Ahmad[15]做出的假设:绿藻油脂的积累取决于培养基中碳、氮元素的平衡。所以,在低光照和中等光照强度下,培养前3 d生物量快速积累而总脂肪酸含量有下降趋势。在高光照条件下,藻体细胞的碳、氮比例发生改变,即使在无氮源培养基中,油脂均开始积累。殷大聪[16]等报道,光照强度在光饱和点以下,微藻的光合作用随着光强的提高而加强,从而促进生长。本实验中,在无氮源中等光强培养下的藻体光合作用达到饱和点,这使藻体生长停止,在培养的3~4 d后总脂肪酸含量积累。可以认为,光照强度对生长油脂含量油脂产量的影响表现为适宜生长的光强促进油脂积累并提高油脂产量。
本研究对缺刻源绿藻花生四烯酸(AA)的研究表明,处在无氮源培养基中的藻体其含量高于有氮源的藻体中的含量。微藻在缺氮时同化产物多转化为糖类或脂类物质,通常会增加多饱和脂肪酸的含量。KhozinGoldberg[17]等认为缺刻缘绿藻对氮饥饿的第一应答反应是大量积累AA。在氮饥饿条件下,AA的含量可增加到占总脂肪酸的60%。本实验在中等光照缺氮源条件下达到最大 AA含量,为干重的16.10%。Cohen[18]等对紫球藻的研究也发现氮饥饿会导致AA的含量升高。光照是影响光合自养微藻多不饱和脂肪酸(PUFA)合成的重要因素,它不仅影响藻体中类脂的含量,还影响各种PUFA在总脂中的相对含量。就AA百分含量的变化而言,光照强度会对无氮源培养基中的藻体表现出促进效应,但高光照强度并不利于缺刻缘绿藻AA积累,有研究表明,拟微球藻中也发现类似现象发生[19]。还有研究发现[20],低光照下培养的紫球藻脂肪酸中积累较多的AA,但是在高光照下情况刚好相反。高光照强度伴随光损伤现象的发生,单不饱和脂肪酸及饱和脂肪酸百分含量增加可能的原因是其在降低光强带来的损伤以及维持细胞中水分平衡起着一定的作用,但PUFA含量则与前者相反。在缺氮条件下,中等、低光照强度均能提高缺刻缘绿藻AA的百分含量,与Solovchenko 和 Ahmad[14-15]报道的结果一致。本实验证明,在一定范围内控制光强和氮源有利于缺刻源绿藻花生四烯酸的积累。
藻类色素积累受多种环境因素的影响,如光照、营养盐、温度等。本实验在不同光强和氮源的培养基中培养缺刻源绿藻其色素成分和含量都有显著变化。本实验的数据表明藻体在缺氮源培养基中类胡萝素的合成能力受到限制,同时随着光强的增加叶绿素的含量也有所下降。这与Merzlyak[2]等得研究结果基本吻合。在本实验中,中等光强和高光强无氮源培养基中缺刻源绿藻叶绿素含量显著低于有氮源培养中的藻体叶绿素含量,说明叶绿素含量是反映藻类光合强度的重要指标,在一定光强下氮限制使叶绿素的合成受到一定抑制,该结果与硅藻和雪藻的相关研究报道一致[21-22]。这主要是在氮限制条件下类囊体膜上捕光色素蛋白复合物和反应中心复合体受到一定损伤或部分降解,导致转能效率降低。
本实验结果表明,有氮源的培养基和一定光强均有利于缺刻源绿藻的生长,有氮源高光强培养条件下,该藻的生物量达到最大值,为7.23 g/L。无氮源培养基和一定光强度均能不同程度地提高藻细胞总脂肪及花生四烯酸的含量,且在无氮源高光强条件下油脂量最高,约为38.02%;在缺氮源中光强条件下花生四烯酸含量最高,约为16.10%。色素含量在缺氮条件下随着光强的上升而下降,在有氮源中光强条件下达到最大值,约为150.00 mg/L。类胡萝卜素含量无论是在有氮源还是无氮源培养基中,中等光强下含量均较高。
[1] 赵大显.微藻花生四烯酸的研究进展[J].水产科学,2004,23(10):42 -44.
[2] Merzlyak N M,Chivkunova B O,Gorelova A O,et al.Effect of nitrogen starvation on optical properties,pigments,and arachidonic acid content of the unicellular green algaParietochloris incise(Trebouxiophyceae,Chlorophyta)[J].Journal of Phycology,2007,43(4):833 -843.
[3] 童牧,于水燕,欧阳珑玲,等.氮饥饿与磷饥饿促使缺刻缘绿藻花生四烯酸含量增加的比较[J].上海水产大学学报,2011,35(5):763-773.
[4] Recht L,Zarka A,Boussiba S.Patterns of carbohydrate and fatty acid changes under nitrogen starvation in the microalgaeHaematococcus pluvialisandNannochloropsissp.[J].Applied Microbiology and Biotechnology,2012,94(6):1 495-1 503.
[5] Bigogno C,KhozinGoldberg I,Boussiba S,et al.Lipid and fatty acid composition of the green oleaginous algaParietochloris incise,the richest plant source of arachidonic acid[J].Phytochemistry,2002,60(5):497-503.
[6] 李慧,欧阳珑玲,周志刚.缺刻缘绿藻ω3脂肪酸去饱和酶基(ω3FAD)在酿酒酵母中的低温诱导表达[J].农业生物技术学报,2012,20(7):735-744.
[7] 陈思弘,周志刚.缺刻缘绿藻转录组测序及脂质代谢相关基因注释[J].上海海洋大学学报,2012,21(5):662-670.
[8] 刘凡,李慧,李春阳,等.缺刻缘绿藻FAD基因的序列特征及其相对转录量对氮饥饿的响应[J].中国产科学,2012,19(5):729-740.
[9] 于水燕,陈颢,周志刚.缺刻缘绿藻脂肪酸延长酶基因在拟南芥中的表达分析[J].生物技术通报,2011,11(5):88-94.
[10] 罗梦柳,桑敏,张成武,等.氮、磷对缺刻缘绿藻生长、总脂及花生四烯酸积累的影响[J].天然产物的研究与开发,2010,22(3):378-382.
[11] Stanier R Y,Kunisawa R,Mandel M,et al.Purification and properties of unicellular blue-green algae(order Chroococcales)[J].Microbiology and Molecular Biology Reviews,1971,35(2):171- 205.
[12] Zhekisheva M,Boussiba S,KhozinGoldberg I,et al.Accumulation of oleic acid inHaematococcus pluvialis(Chlorophyceae)under nitrogen starvation or high light is correlated with that of astaxanthin esters[J].Journal of Phycology,2002,38(2),325-331.
[13] Cohen Z,Norman H A,Heimer Y M.Potential use of substituted pyridazinones for selecting polyunsaturated fatty acid overproducing cell lines of algae[J].Phytochemitry,1993,32(2):259-264.
[14] Solovchenko A,Mark N,KhozinGoldberg I,et al.Coordinated carotenoid and lipid syntheses induced inParietochloris incisa(chlorophyta,trebouxiophyceae)mutant deficient in Δ5 desaturase by nitrogen stavation and high light[J].Journal of Phycology,2010,46(4):763 -772.
[15] Ahmad A L,Yasin N H,Derek C J C,et al.Microalgae as a sustainable energy source for biodiesel production[J].Renewable and Sustainable Energy Reviews,2011,15(1):584-593.
[16] 殷大聪,耿亚红,梅洪,等.几种主要环境因子对布朗葡萄藻(Botryococcus braunii)光合作用的引影响[J].武汉植物学研究,2008,26(1):64-69.
[17] KhozinGoldberg I,Bigogno C,Shrestha P,et al.Nitrogen starvation induces accumulation of arachidonic acid in the freshwater green algaParietochloris incisa[J].Journal of Phycology,2002,38(5):991-994.
[18] Cohen Z,Vonshak A,Richmond A.Effect of environmental conditions on fatty acid composition of the red algaPorphyridium cruentum:correlation to growth rate[J].Journal of Phycology,1998,24(3):328- 332.
[19] Fabregas J,Maseda A,Dominquez A,et al.The cell composition ofNannochloropsis sp.Changes under different irradiances in semicontinuous culture[J].World Journal of Microbiology and Biotechnology,2004,20(1):31-35.
[20] 温少红,王长海.光照和培养时间对紫球藻细胞脂肪酸含量的影响[J].中国海洋药物,2000,24(1):47-50.
[21] 胡晗华,石岩峻,丛威,等.不同氮磷水平下中肋骨条藻对营养盐的吸收及光合特性[J].应用与环境生物学报,2004,10(6):735-739.
[22] Na Lu,Dong Wei,Feng Chen,et al.Lipidomic profiling and discovery of lipid biomarkers in snow algaChlamydomonas nivalisunder salt stress[J].European Journal of Lipid Science and Technology,2012,114(3):253 -265.
