4种植物缺铁条件下对土壤镉的积累特征
2013-11-12孙铁珩孙丽娜
鲍 桐,孙铁珩,孙丽娜,赵 达
(沈阳大学 区域污染环境生态修复教育部重点实验室,辽宁 沈阳 110044)
土壤重金属污染以及与此相关的生态安全问题已经成为国际上关注的焦点[1].植物修复作为新兴的成本低廉、环境友好的原位修复技术,已成为国内外的研究热点.目前,由于超富集植物生物量小、生长地理环境局限、只富集一种金属和大生物量植物金属的耐性差、累积能力低、在高浓度污染环境下不易成活,导致的重金属污染土壤植物修复周期长已经成为该技术广泛应用的限制性因素[2].成功的植物修复取决于较大的植物生物量和较高的植物吸收、累积重金属的能力,而根际环境下土壤重金属的存在形式和迁移转化过程决定了修复植物吸收金属能力,与土壤组成、植物生理特性、根-微生物-金属相互作用等因素有关[3].铁(Fe)作为植物生长与人类食品必需的营养元素和地壳中含量最为丰富的常量元素(第四位),在土壤中的地球化学行为不但影响植物的生长,同时也影响着地球化学性质相似的重金属的地球化学行为,但通常情况下土壤中铁的生物有效性极低[4].运用强化的矿物营养吸收和积累的植物战略,一方面可以通过平衡植物矿物营养,改进人类健康,另一方面通过植物矿物营养元素的吸收,促进植物的重金属积累,达到修复污染土壤的目的.
植物通过释放与Fe(Ⅲ)强亲和的螯合剂(植物铁载体)进入根际环境,通过与Fe(Ⅲ)络合和专性迁移达到植物对土壤铁的吸收[5].同时,元素的竞争作用可以改变土壤其他重金属的活化性与植物有效性.植物铁载体强化了土壤Cd、Cu、Ni、Zn的植物吸收已有报道.植物根际是受根吸收、代谢分泌影响的,组成十分复杂的非平衡的环境空间,是重要的水-土-根环境界面,是控制能量交换和物质循环的重要场所.根际中土壤组成、性质和根系分泌物、根际微生物特征及其相互作用直接/间接的影响土壤中铁和其他重金属的迁移转化与植物有效性.目前,有关根际下土壤的铁化学与植物吸收、土壤其他重金属的迁移转化、植物有效性及其相互关系研究的很少.因此,系统研究根际下土壤铁与其他重金属的迁移转化、植物有效性及其相互关系,不仅对优化植物生长,降低食品生态风险,而且对修复重金属污染土壤和丰富植物修复技术的内涵具有重要意义.
1 材料方法
1.1 试验材料
供试土壤:草甸棕壤,采自中国科学院沈阳生态实验站,此地块为休耕地,未使用农业化学品已10年,属清洁土壤,采样的深度为0~20cm(表层土壤),其基本理化性质见表1.
种子来源于沈阳大学区域污染环境生态修复教育部重点实验室,分别为龙葵(Solanum nigrum L.),西红柿(Solanum Lycopersicon),玉米(Zea Mays L.),小 麦(Triticum aestivum L.).种子表面用75%酒精浸泡20min,然后用自来水冲洗5次,并放入无菌蒸馏水中用摇床振荡清洗6h,转速144r·min-1.将4种植物的种子均匀散布在不锈钢托盘上并覆上无菌纱布,将托盘放入培养箱中培养,温度控制在28 ℃,湿度60%.当幼苗达到2cm的时候,将幼芽移栽到Hoagland-Arnon培养液中进行培养.

表1 供试土壤基本理化性质及重金属含量Table 1 Basic physical and chemical properties and contents of heavy metals in test soil
1.2 实验设计
试验设4个组,每个组重复3次,各组投加的Cd的质量分数分别为0、1、5和10mg·kg-1,投加的Cd(Ⅱ)以CdCl2·2.5H2O的形式固态加入到土壤中并充分混匀,平衡14d后一次性施入可装2.5kg土的盆中,每盆土2.0kg.
将4种植物的幼苗放置在穿孔的纱布上并置于450mL瓶中,其中含有400mL 营养液,使植物的根浸没在溶液中.配制好的营养液经过高压灭菌处理,并进行了无菌检验.将选好的幼苗第一周在1/4强度的Hoagland-Arnon营养液中培养,第二周将苗子移到1/2强度的营养液中.在接下来的两周中将苗子移到完全营养液中.第五周将一部分苗子转移到缺铁的营养液中进行缺铁适应(-Fe),另一部分苗子继续在完全营养液中(+Fe).每天向营养液中充入空气,营养液1 周更换2次,随时补充去离子水以使所有的处理保持在400mL.所有的溶液的pH 值被调节在6.8~7.0.每一组重复3次.生长五周后,取整齐度一致的幼苗移栽到各处理的盆中.培养期间温度为28℃,以去离子水浇灌,土壤湿度保持在60% 田间持水量.生长一周后收获.
1.3 Cd测定
用蒸馏水洗净叶片表面,将烘干的植物样品磨碎后,分别用电子天平测定生物量,采用HNO3-HClO4法(V(HNO3)∶V(HClO4)=87∶13)消化,原子吸收分光光度计法测定其中的Cd(Ⅱ)含量[6].原子吸收分光光度计法(瓦里安AA-220)测定其含量.
1.4 富集系数和转移系数
富集系数(Bioconcentration factors,BCF)是指植物地上部重金属含量与土壤中该种重金属原有含量的比值,是评价植物富集重金属能力的重要指标之一,它反映了植物对某种重金属元素的富集能力,富集系数越大,其富集能力越强[7].转移系数(Translocation factors,TF)是植物地上部和根部重金属含量的比值,可以体现植物从根部向地上部运输重金属的能力[8].
1.5 数据分析
实验所得数据采用Excel 2000及SPSS 11.5进行数据处理.利用One-way ANOVA 对数据进行分析.
2 结果与分析
2.1 缺铁对植物生物量的影响
4种植物加铁和缺铁的生物量变化见图1.4种植物加铁处理的生物量均高于相应的缺铁处理(p<0.05).总体上看,4种植物无论加铁处理还是缺铁处理,生物量的变化呈现随着Cd(Ⅱ)质量分数升高而逐渐降低的趋势.由图2和图3可知,随着Cd(Ⅱ)质量分数的升高,4种植物的地上部和根部生物量呈现降低的趋势,而且重金属对根部的抑制效应要大于对地上部,这主要是根部直接接触于重金属,对根部产生的伤害较大,所以根部生物量随着Cd(Ⅱ)质量分数升高而降低的趋势更为明显.4种缺铁处理地上部和根部植物生物量低于相应的加铁处理,这主要是因为铁作为植物生长的必需微量元素,轻度缺铁会导致叶绿素合成减少,光合速率降低,严重缺铁时,叶绿素合成停止,新叶变黄,生物量大幅度下降.其中,生物量最大值出现在C+Fe,当w(Cd)为0mg/kg时,达到了2.36g(P<0.05),最小值出现在W-Fe,当w(Cd)为10mg/kg时,仅为0.62g(P<0.05).植物地上部生物量最大值出现在C+Fe,当w(Cd)为0 mg/kg 时,为1.85g(P <0.05);最低值为0.57g,出现在W-Fe,当w(Cd)为10mg/kg时.根部生物量最大值也出现在C+Fe,当w(Cd)为0mg/kg时,达到了0.51g(P<0.05);而最低值出现在W-Fe,M-Fe,当w(Cd)为10mg/kg时,仅为0.05g(P<0.05).

图1 加铁和缺铁植物在不同Cd(Ⅱ)质量分数时的生物干重(m)Fig.1 The biological dry weight of Fe-efficient and Fe-deficient plants in different Cd(Ⅱ)mass fraction(m)
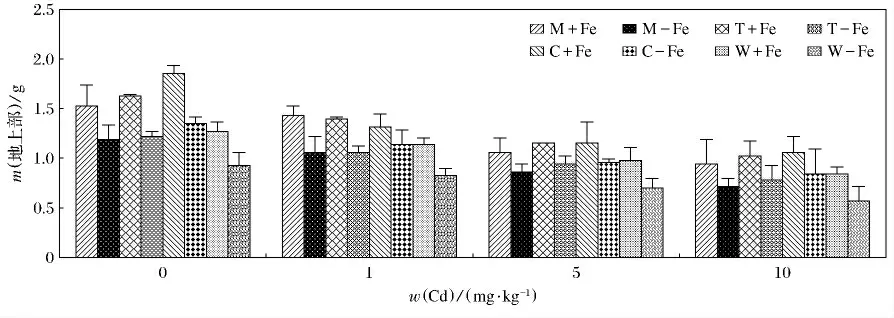
图2 加铁和缺铁植物在不同Cd(Ⅱ)质量分数时地上部的生物干重(m)Fig.2 The shoot biological dry weight of Fe-efficient and Fe-deficient plants in different Cd(Ⅱ)mass fraction(m)
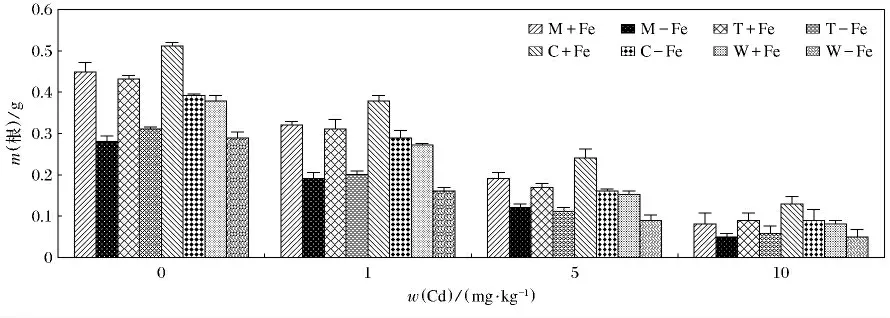
图3 加铁和缺铁植物在不同Cd(Ⅱ)质量分数时根部的生物干重(m)Fig.3 The root biological dry weight of Fe-efficient and Fe-deficient plants in different Cd(Ⅱ)mass fraction(m)
2.2 缺铁对植物吸收Cd(Ⅱ)的影响
图4 表示的是4种植物在加铁和缺铁条件下、不同质量分数Cd中对Cd(Ⅱ)的吸收.经过5周的液体培养,可以看出小麦、玉米、番茄及龙葵对Cd(Ⅱ)均有不同程度的富集.在不同的质量分数Cd中,这4种植物对Cd(Ⅱ)的富集量基本都是随着Cd质量分数的升高而增加,其中,富集量最大值出现在M-Fe,当w(Cd)为10mg/kg时,达到了145.3mg/kg(P<0.05);最低值出现在W+Fe,w(Cd)为0mg/kg时,仅为3.6mg/kg(P<0.05).4种植物在Cd不同质量分数下缺铁处理富集Cd(Ⅱ)的含量均高于相应的加铁处理(P<0.05).

图4 加铁和缺铁植物在不同Cd(Ⅱ)质量分数中对Cd(Ⅱ)的吸收量Fig.4 The contents of Cd(Ⅱ)accumulated by Fe-efficient and Fe-deficient plants in different Cd(Ⅱ)mass fraction
4种植物地上及地下部分对Cd(Ⅱ)的富集见图5,图6.可以看出这4种植物的地上及地下部分中Cd(Ⅱ)的质量分数各不相同.无论是地上还是地下部分对Cd(Ⅱ)的吸收都有随着Cd(Ⅱ)质量分数的升高而升高的趋势.4种植物缺铁处理地上部富集的Cd(Ⅱ)显著高于相应的加铁处理(P<0.05).对与根部积累的Cd(Ⅱ)来说,变化较为复杂.缺铁处理的4种植物在w(Cd(Ⅱ))为0mg/kg,w(Cd(Ⅱ))为1mg/kg 时,富集的Cd(Ⅱ)显著高于加铁处理(P <0.05).在w(Cd(Ⅱ))为5mg/kg 时,缺铁处理龙葵、番茄、玉米富集的Cd(Ⅱ)高于加铁处理,但是差异不显著,而缺铁处理的小麦富集的Cd(Ⅱ)低于相应的加铁处理.在w(Cd(Ⅱ))为10mg/kg时,缺铁处理龙葵、番茄、小麦富集的Cd(Ⅱ)显著低于加铁处理(P<0.05),缺铁处理玉米富集的Cd(Ⅱ)显著高于加铁处理(P<0.05).其中M-Fe地上部在w(Cd(Ⅱ))为10mg/kg时,富集Cd(Ⅱ)最高(143.76mg/kg),最低出现在W+Fe,当w(Cd(Ⅱ))为0mg/kg时(1.56mg/kg)(P<0.05);W+Fe地下部在w(Cd(Ⅱ))为10mg/kg时,富集Cd(Ⅱ)最高(190.75mg/kg)(P<0.05),W+Fe地下部在w(Cd(Ⅱ))为0mg/kg时,富集Cd(Ⅱ)最低,仅为10.38mg/kg(P<0.05).
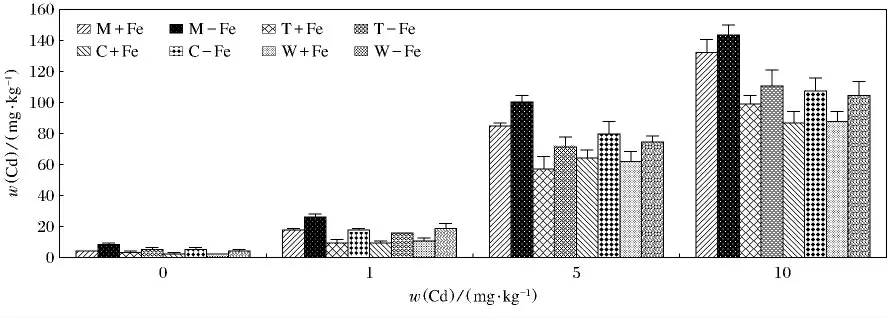
图5 加铁和缺铁植物地上部对Cd(Ⅱ)的吸收量Fig.5 The contents of Cd(Ⅱ)accumulated by shoots of Fe-efficient and Fe-deficient plants
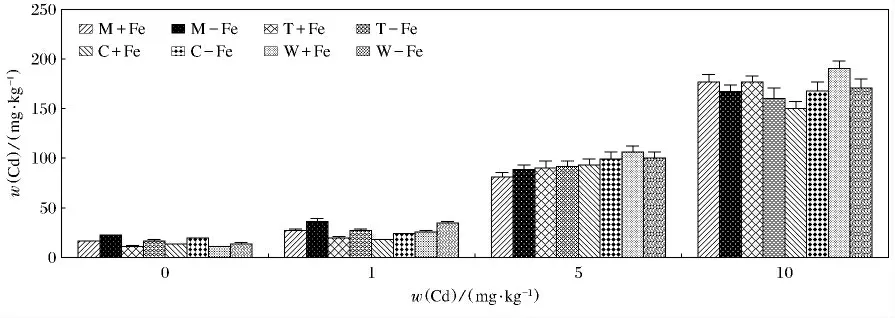
图6 加铁和缺铁植物根部对Cd(Ⅱ)的吸收量Fig.6 The contents of Cd(Ⅱ)accumulated by roots of Fe-efficient and Fe-deficient plants
2.3 缺铁对富集系数与转移系数的影响
图7描述的是4种植物在加铁和缺铁条件下Cd富集系数(BCF)的变化.从富集系数上看,小麦、玉米、番茄及龙葵对Cd(Ⅱ)的富集能力有很大差异,而且随着w(Cd(Ⅱ))的升高,4种植物的变化没有一致的趋势,4种植物的缺铁处理BCF值均显著高于相应的加铁处理(P<0.05).缺铁处理龙葵与番茄随着w(Cd(Ⅱ))的升高而呈现逐渐降低的趋势(P<0.05),而在不同质量分数的Cd中加铁处理的几乎没有变化.加铁与缺铁处理的玉米和小麦在w(Cd)为5mg/kg处理中,BCF达到最大值,而且加铁与缺铁处理的玉米和小麦随着w(Cd(Ⅱ))升高变化较为复杂.M-Fe在w(Cd(Ⅱ))为0 mg/kg 时,BCF值最高(34.59)(P <0.05),W +Fe 在w(Cd(Ⅱ))为0mg/kg时,BCF值最低(6.48).
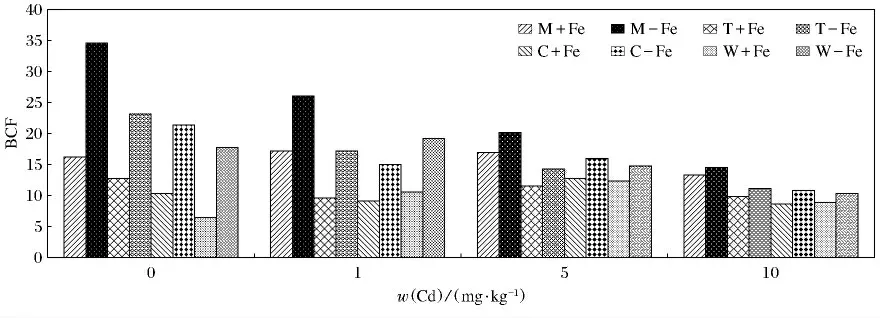
图7 加铁和缺铁植物对Cd(Ⅱ)的富集系数(BDF)Fig.7 The BCF values of Cd(Ⅱ)in Fe-efficient and Fe-deficient plants
图8描述的是4种植物在加铁处理和缺铁处理条件下Cd转移系数(TF)的变化.无论是加铁处理和缺铁处理,4种植物TF的变化趋势是一样的,均呈现出先升高后降低的趋势,在w(Cd)为5mg/kg处理4种加铁和缺铁处理的植物分别达到最大值,然后降低.4种植物的缺铁处理TF值均显著高于相应的加铁处理(P<0.05).MFe在w(Cd)为5mg/kg时,TF 值最高为1.13(P<0.05),W-Fe在w(Cd)为0mg/kg时,TF值最低为0.15(P<0.05).

图8 加铁和缺铁植物对Cd(Ⅱ)的转移系数(TF)Fig.8 The TF values of Cd(Ⅱ)in Fe-efficient and Fe-deficient plants
3 讨 论
4种植物缺铁处理低于加铁处理是由于镉的毒性和缺铁处理的共同结果.镉是光合作用的一种有效抑制剂,Cd(Ⅱ)进入植物体内,首先影响光合色素,使叶绿素总含量下降,进而影响光合功能.Cd(Ⅱ)污染对水稻不同发育时期的光合作用影响非常明显,并且光合强度随着Cd(Ⅱ)增高而降低[9].铁是最早发现的植物必需营养元素,位居植物必需微量元素的首位.轻度缺铁会导致叶绿素合成减少,光合速率降低;严重缺铁时,叶绿素合成停止,新叶变黄,生物量大幅度下降.因此,缺铁处理的地上部和根部的生物量均低于相应的加铁处理.
铁的营养状况对植物吸收镉有一定的影响[10].在金属转移到植物根系的过程中土壤溶液起了重要的作用.通过配合阳离子,可溶性根分泌物可能会促进根附近的金属的可溶性.由于它们的相对分子质量低,分泌物可以在土壤中移动,在它们释放之后,可以通过扩散作用从根表移至根际某一小的范围,可能会作为金属载体.禾本科植物缺铁时,根系可分泌麦根酸类植物铁载体[11],这类物质对难溶性铁有极好的配合能力,能与Fe3+形成稳定性很高的配合物,从而增加植物对铁的吸收[12].然而这种活化机制并不具备元素专一性,缺铁条件,难溶性锰化合物例如MnO2也能被溶解[13].其他元素如Cd也可能被溶解使其有效性增强,因而也促进了对Cd(Ⅱ)的吸收.因此,作为禾本科植物的小麦和玉米,在缺铁条件下富集Cd(Ⅱ)的量高于加铁处理.
在缺铁胁迫条件下,耐缺铁植物的根系分泌物在种类和数量上都会有所增加,并形成一些特异性的根系分泌物.对于双子叶和非禾本科单子叶的龙葵与番茄来说,根系细胞原生质膜上的H+-ATPase因缺铁而诱导激活,大量H+被释放到根际,导致根际pH 值下降[14].此外,缺铁条件下大量的根系分泌物,也可以改变土壤的氧化还原状况,进而降低重金属的毒性,促进植株对重金属的大量吸收.因此,土壤中溶液的Cd(Ⅱ)可交换态会随pH的降低而增加,所以缺铁处理的龙葵与番茄富集的Cd(Ⅱ)量高于加铁处理.
缺铁条件下培养的4种植株地上部Cd(Ⅱ)含量均高于正常供铁的植株,这可能是缺铁活化了根际污染元素Cd的缘故.例如,在供铁充足时,由于水稻根分泌的植物铁载体很少甚至没有,根际可溶性微量元素如Mn、Zn 和污染元素Cd的数量较低,仅靠缓慢的扩散作用进入植物根细胞膜表面,故吸收量较少.Mench 用铁高效的Coker 227和铁低效的TAM0-312燕麦品种进行的试验结果表明,植物铁载体能够使Coker 227根际中Zn、Cd和Ni的水平升高,并且植物地上部重金属元素的含量也相应升高,而铁低效的TAM0-312没有激活这种机制,所以植株地上部的金属含量也没有升高[15].
从转移系数来看,缺铁处理的TF 高于相应的加铁处理,这主要是由于根际环境的变化促进了植物对重金属的吸收.例如,根系分泌的有机酸可以促使土壤pH 和Eh的变化,有效态Cd的含量分别随着pH的降低和Eh的增高而增高[16].但是,随着在w(Cd)为10mg/kg处理时,加铁和缺铁处理的TF 低于w(Cd)为5mg/kg,这主要是高浓度的Cd对植株造成了严重伤害所致,降低了植株对重金属吸收与积累.富集系数的变化较为复杂,这可能是BCF 值也随重金属种类和浓度,植物生理特性及环境因素的变化而不同.但是,缺铁处理的BCF 高于加铁处理,这主要归因于缺铁处理,使植株的根系分泌物及其根际环境的变化,有利于根际环境中的重金属Cd的迁移转化.
4 结 论
4种植物的生物量及其地上部和根部生物量随着Cd(Ⅱ)升高呈现降低的趋势,并且缺铁处理的生物量低于相应的加铁处理;4种植物对Cd(Ⅱ)的富集量基本都是随着w(Cd(Ⅱ))的升高而增加,并且缺铁处理富集的Cd(Ⅱ)显著高于相应的加铁处理,重金属Cd(Ⅱ)主要富集在根部;由富集系数和转移系数可以看出,富集系数基本随重金属质量分数的增加而减小.缺铁处理转移系数与富集系数高于加铁处理,转移系数呈现先升高后降低的趋势.
[1]赵其国,骆永明,滕应.中国土壤保护宏观战略思考[J].土壤学报,2009,46(6):1140-1145.(Zhao Qiguo,Luo Yongming,Teng Ying.Strategic Thinking on Soil Protection in China[J].Acta Pedologica Sinica,2009,46(6):1140-1145.)
[2]Hinsinger P,Plassard C,Tang C,et al.Origins of Rootinduced pH Changes in the Rhizosphere and their Responses to Environmental Constraints:A Review[J].Plant Soil,2003,248,43-59.
[3]Hinsinger P,Gobran G R,Gregory P J,et al.Rhizosphere Geometry and Heterogeneity Arising from Root-mediated Physical and Chemical Processes[J].New Phytologist,2005,168(2):293-303.
[4]张福锁,申建波,冯固,等.根际生态学-过程与调控[M].中国农业大学出版社,2009:27-34.(Zhang Fusuo,Shen Jianbo,Feng Gu,et al.Rhizosphere Ecology:Process & Management[M].China Agricultural University Press,2009:27-34.)
[5]张福锁.根分泌物及其在植物营养中的作用[J].北京农业大学学报,1992,18(4):353-357.(Zhang Fusuo.The Root Exudation and its Role in Plant Nutrition[J].China Agricultural University Press,1992,18(4):353-357.)
[6]Wei S H,Zhou Q X.Identification ofWeed Species with Hyperaccumulative Characteristics of Heavy Metals[J].Prog.Natl.Sci.,2004,14(6):495-503.
[7]Salt D E,Prince R C,Pickering I J,et al.Mechanisms of Cadmium Mobility and Accumulation in Indian Mustard[J].Plant Physiol,1995,109(4):1427-1433.
[8]Stoltz E,Greger M.Accumulation Properties of As,Cd,Cu,Pb and Zn by Four Wetland Plant Species Growing on Submerged Mine Tailings [J].Environmental and Experimental Botany,2002,47(3):271-280.
[9]王焕校.污染生态学基础[M].昆明:云南大学出版社,1990:91-108.(Wang Huanxiao.Pollution Ecology Basis [M].Kunming:Yunnan University Press,1990:91-108.)
[10]Rodecap K D,Tingey D J,Lee E H.Iron Nutrition Influence on Cadmium Accumulation by Arabidopsis Thaliana(L.)Heynh[J].J.Environ.Qual,1994,23(2):239-246.
[11]Takagi S,Kamei S,Yu M H.Efficiency of Iron Extraction from Soil by Mugineic Acid Family Phytosiderophores[J].J.Plant Nutr.,1988(11):643-651.
[12]Rmheld V,Marschner H.Mobilization of Iron in the Rhizosphere of Different Plant Species[J].Adv.Plant Nutri.,1986(2):155-204.Marschner H.Mineral Nutrition of Higher Plants[M].New York:Academic Press,1986:235-242.
[13]Lim TT,Tay J H,Teh C I.Contamination Time Effect on Lead and Cadmium Fractionation in a Tropical Coastal Clay[J].J.Environ.Qual.,2002,31(3):806-812.
[14]Mench M J,Fargues S.Metal Uptake by Iron-efficient and Inefficient Oats[J].Plant Soil,1994,165(2):217-223.
[15]Collins R N,Merrington G,Mclauglin M J,et al.Organic Ligand and pH Effects on Isotopically Exchangeable Cadmium in Polluted Soils[J].Soil Sci Soc Am J,2003,67(1):112-121.
