桦褐孔菌多糖IOP3a体内抗肿瘤活性及其机制
2013-11-09陈义勇黄友如刘晶晶郑丽雪
陈义勇, 黄友如, 刘晶晶, 郑丽雪, 徐 兵
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
桦褐孔菌(Inonotus obliquus)是一种生长在寒带的药用真菌,寄生于白桦树、银桦等树干或树皮下,主要生长区域为北美、波兰、俄罗斯、中国的黑龙江和吉林、日本北海道等国家和地区[1]。国内陈义勇等[2-3]研究表明,桦褐孔菌多糖对Jurkat荷瘤具有抗肿瘤活性;金光等[4]研究表明,桦褐孔菌多糖对小鼠S180肉瘤具有较强的抑制作用;张慧丽等[5]研究发现,桦褐孔菌多糖对肝癌SMMC7721细胞株增殖具有抑制作用,且表现出浓度相关性。国外Kim等[6-7]认为,桦褐孔菌多糖对BDF1鼠黑色素瘤生长有明显抑制作用,桦褐孔菌菌核多糖直接通过抑制肿瘤细胞生长和蛋白质合成而产生抗癌作用。通过查阅文献发现,桦褐孔菌多糖的抗肿瘤活性主要停留在粗多糖研究层面,而桦褐孔菌多糖单一组分的抗肿瘤活性及其作用机制还未见报道。
笔者前期分离得到一个桦褐孔菌多糖单一组分IOP3a,经过活性筛选,发现IOP3a具有较强的体外抗肿瘤活性,但是体内抗肿瘤活性及其作用机制还需进一步研究。所以作者以IOP3a为研究对象,通过建立移植型裸鼠淋巴瘤细胞Jurkat模型,通过研究荷瘤裸鼠的指标(如移植瘤体积变化、抑瘤率、脾指数、外周血白细胞和淋巴细胞、巨噬细胞产生细胞因子TNF-α和L-1β)以及裸鼠瘤块组织病理学观察,探讨IOP3a的体内抗肿瘤活性,通过蛋白质印迹技术检测IOP3a处理后不同组荷瘤裸鼠的肿瘤组织中抑癌基因Bcl-2蛋白和促癌基因Bax蛋白的表达情况,分析桦褐孔菌多糖IOP3a可能的体内抗肿瘤作用机制,旨在为其治疗肿瘤及其开发利用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 桦褐孔菌多糖IOP3a样品 本实验室前期分离纯化自制,经HPLC测定IOP3a相对分子质量为44265 Da,单糖由鼠李糖、阿拉伯糖、葡萄糖和半乳糖组成,其摩尔比为 2.5∶4.6∶1∶2.6。
1.1.2 Jurkat细胞 人T淋巴细胞白血病细胞株,购自中国人民解放军军事医学科学院。
1.1.3 Balb/c-nu/nu裸鼠 购自中国人民解放军军事医学科学院实验动物中心,许可证号:SCXK-(军)2002-001。
1.2 主要试剂
5-氟尿嘧啶(5-Fu),上海利铂化学技术有限公司提供;RPMI1640培养液,北京万域美澜科技有限公司提供;白细胞介素-1β(L-1β)、肿瘤坏死因子-α(TNF-α)检测试剂盒,上海酶联生物科技有限公司提供;鼠抗人Bcl-2,上海亿欣生物科技有限公司提供;Bax单克隆免疫组化试剂盒,上海谷研科技有限公司提供;辣根酶标记的山羊抗兔IgG,杰兰尔试剂上海分公司提供;羊抗人β-肌动蛋白多克隆抗体,上海今迈生物科技有限公司提供;二氨基联苯胺(DAB)显色试剂盒,天津百浩生物科技有限公司提供;其它试剂均为国产分析纯。
1.3 主要仪器
RM2135石蜡切片机,德国Leica公司产品;DYCZ-25D型电泳仪,北京市六一仪器厂产品;36XB光学显微镜,上海光学仪器厂产品;LH750全自动血细胞分析仪,美国Beckman Coulter公司产品;GelDoc-IT TS2凝胶成像系统,美国UVP公司产品。
1.4 实验方法
1.4.1 Jurkat裸鼠荷瘤模型的建立 Balb/c-nu/nu裸鼠,雄性,3~5 周龄,体质量(20±2)g,放置在空气净化室饲养,室度(25±2)℃,实验过程达到无特定病原体(Specific Pathogen Free,SPF)条件,自由摄入无菌水和灭菌标准饲料一周后,裸鼠经Co60照射(剂量250 Gcy)3 d后,在每只裸鼠背部皮下接种0.2 mL Jurkat细胞(1×107cells/mL),每只裸鼠两个注射点,每天观察裸鼠肿瘤形成情况,裸鼠皮下5 d后出现结节隆起约5 mm,成瘤率达到100%。成功建立的Jurkat裸鼠荷瘤模型见图1。
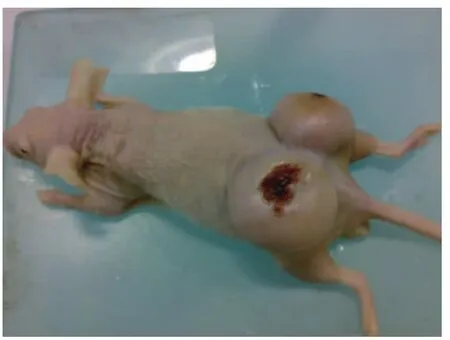
图1 Jurkat裸鼠荷瘤模型Fig.1 Cancer nude mice transplanted jurkat tumor
1.4.2 动物分组及给药 造模后的Balb/c-nu/nu裸鼠随机分为5组,包括空白对照组、5-Fu阳性对照
组(20 mg/(kg·d)、IOP3a 大剂量组(30 mg/(kg·d)、中剂量组(20 mg/(kg·d)和小剂量组(10 mg/(kg·d),每组5只。空白对照组每只裸鼠注射0.2 mL生理盐水,5-Fu阳性对照组每只裸鼠注射0.2 mL 5-Fu,调节药物浓度使药量达到20 mg/kg,采用灌胃法给药,每天一次,连续28 d。
1.4.3 荷瘤裸鼠移植瘤体积变化 每组裸鼠从给样品后开始,用游标卡尺分别在第7、14、28天作一次活体肿瘤大小(包括最大长径a和横径b)测量,根据公式
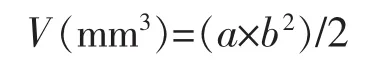
计算肿瘤体积(V),以每组裸鼠瘤体积平均值为纵坐标,处理时间为横坐标,绘制移植瘤生长曲线。参见文献[8]。
1.4.4 IOP3a对荷瘤裸鼠的抑瘤作用 实验第29天后处死裸鼠后称重,摘取瘤块,用生理盐水洗涤,然后用滤纸吸干称重,根据公式

1.4.5 IOP3a对荷瘤裸鼠脾脏的影响 实验第29天后处死裸鼠,摘取脾脏,用生理盐水洗涤,然后用滤纸吸干称重,根据公式

计算脾脏指数。
1.4.6 IOP3a对荷瘤裸鼠外周血白细胞和淋巴细胞的影响 实验第29天后通过裸鼠眼眶取血,经全自动血细胞分析仪计算白细胞和淋巴细胞数。
1.4.7 IOP3a对裸鼠巨噬细胞产生细胞因子的影响详见文献[9]。
1)小鼠腹腔巨噬细胞的制备:裸鼠颈椎脱臼处死,酒精消毒,腹腔注射5 mL RPMI1640培养液,轻揉腹腔3 min,收集腹腔液,2 000 r/min离心5 min,弃上清液,用RPMI1640培养液调整细胞浓度至2×109/L。将巨噬细胞悬液接种于96孔细胞培养板中,每孔100 μL,37℃条件下在5%CO2培养箱中孵育3 h,吸弃培养液,用RPMI1640培养液洗去未贴壁的细胞,即得纯化的裸鼠腹腔巨噬细胞。
2)L-1β和TNF-α含量的测定:将96孔培养板中的裸鼠腹腔巨噬细胞分为阴性对照组、阳性对照组和不同剂量的IOP3a多糖给药组,吸弃上清液,阴性对照组加入150 μL的RPMI1640培养液,阳性对照组加入150 μL含5-Fu的 RPMI1640培养液(质量浓度10 mg/L),给药组每孔分别加入150 μL含IOP3a多糖的RPMI1640培养液 (质量浓度分别为 50、100、200 mg/L), 每组设 6个复孔,37 ℃培养48 h后,吸取上清液,用双抗夹心ELISA法测定培养上清液中L-1β和TNF-α的水平,操作步骤按检测试剂盒中的说明书进行。
1.4.8 瘤块组织切片病理学观察 取裸鼠Jurkat瘤块组织,用体积分数10%甲醛固定24 h,通过常规脱水、石蜡包埋、切片(厚度4 μm)、苏木精-伊红染色,对裸鼠Jurkat瘤块组织进行病理学观察。
1.4.9 蛋白质印迹法检测Jurkat肿瘤组织中Bcl-2和Bax蛋白表达 称取肿瘤组织0.3 g,4℃条件下用磷酸盐缓冲液(PBS)洗涤4次,将组织剪碎后加入5 mL预冷组织裂解液,冰上裂解60 min,裂解产物在4℃条件下5 000 r/min离心20 min)后得到细胞蛋白上清液,采用Bradford法测定蛋白质浓度,根据蛋白质含量测定结果每孔加入20 μg蛋白质,在待测细胞蛋白上清液中加入等体积的加样缓冲液,然后混合,在沸水浴中加热5 min,进行SDSPAGE凝胶电泳分离,电泳结束后用去离子水漂洗凝胶,冰浴条件下将蛋白电转移至硝酸纤维素膜上,用PBST(质量分数0.02%Tween-PBS)配制的质量分数5%脱脂奶粉溶液在37℃条件下膜封闭2 h,然后分别加入一抗(1∶200稀释)鼠抗人 Bax、Bcl-2和β-Actin(β-肌动蛋白),确定上样量的一致性,室温下反应2 h后用PBST清洗3次,每次15 min,再与辣根酶标记的山羊抗兔IgG二抗(1∶800稀释)室温下反应1 h,用PBST充分洗涤后,DAB室温下显色,利用凝胶成像系统分析免疫组化图片。
1.4.10 数据统计分析 采用SAS软件AVOVA程序进行显著性分析,Duncan程序进行多重比较。
2 结果与讨论
2.1 荷瘤裸鼠移植瘤生长曲线
荷瘤裸鼠移植瘤生长曲线如图2所示。可知,与对照组比较,IOP3a大剂量组瘤体积增长最慢,而对照组裸鼠移植瘤体积持续增长,说明IOP3a具有较好的抑制荷瘤裸鼠肿瘤生长的作用。
2.2 IOP3a对裸鼠Jurkat肉瘤的抑制作用
裸鼠连续给药28 d后,各组荷瘤裸鼠的瘤质量、抑瘤率等见表1。统计学分析表明:与阴性对照组的瘤质量相比,IOP3a高、中剂量组瘤质量均有显著性差异 (p<0.05), 抑瘤率分别为 69.28%和57.62%,随着多糖剂量的增加,裸鼠移植性肿瘤质量下降显著,并存在明显的剂量—效应关系,5-Fu阳性对照组瘤质量与阴性对照组的瘤质量相比差异显著(p<0.05),发现裸鼠的进食量、行为状态等状况明显差于IOP3a组,这主要是因为5-Fu会对裸鼠的免疫器官造成一定的损害,而桦褐孔菌多糖IOP3a对裸鼠的免疫没有损害。
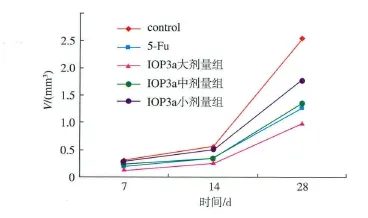
图2 荷瘤裸鼠移植瘤生长曲线Fig.2 Growth curve of nude mice transplanted jurkat tumor
表1 IOP3a对裸鼠Jurkat肉瘤的抑制作用(,n=5)Table 1 Anti-tumor activities of IOP3a against tumorbearing nude mice(,n=5)

表1 IOP3a对裸鼠Jurkat肉瘤的抑制作用(,n=5)Table 1 Anti-tumor activities of IOP3a against tumorbearing nude mice(,n=5)
注:与阴性对照组比较,a: p<0.05。
?
2.3 IOP3a对荷瘤裸鼠免疫器官的影响
桦褐孔菌多糖IOP3a对荷瘤裸鼠免疫器官脾脏的影响见表2,可知:与阴性对照组相比,5-Fu阳性组脾脏指数明显降低(p<0.05),表现出一定的毒副作用,IOP3a治疗组的脾脏指数与阴性对照组均无显著性差异,无明显毒副作用,并且明显高于5-Fu组(p<0.01),随着剂量的增加,脾脏指数有逐步增加的趋势。
表2 IOP3a对荷瘤裸鼠脾脏指数的影响Table 2 Effect of IOP3a on spleen index of tumorbearing nude mice(,n=5)
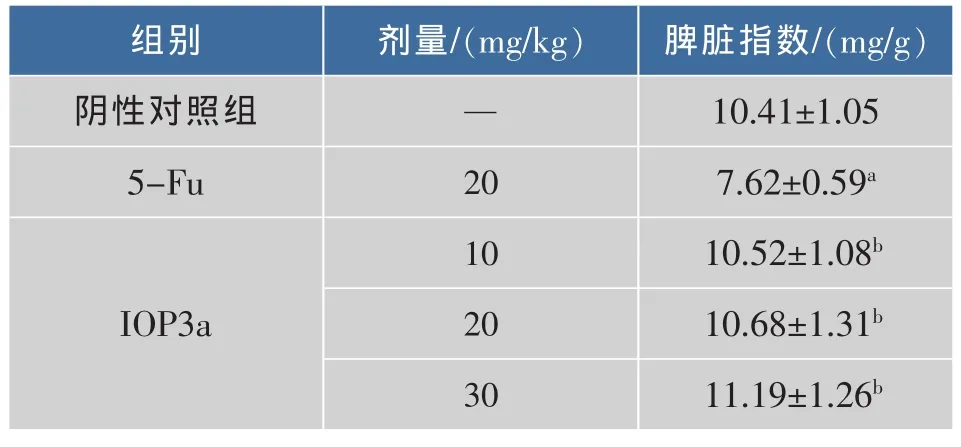
表2 IOP3a对荷瘤裸鼠脾脏指数的影响Table 2 Effect of IOP3a on spleen index of tumorbearing nude mice(,n=5)
注:与阴性对照组比较,a:p<0.05;与阳性对照组比较b: p<0.01。
?
2.4 IOP3a对荷瘤裸鼠外周血白细胞和淋巴细胞的影响
桦褐孔菌多糖IOP3a对荷瘤裸鼠外周血白细胞和淋巴细胞的影响见表3,可知:与阴性对照组相比,5-Fu组白细胞和淋巴细胞数均明显降低 (p<0.05);与5-Fu阳性对照组相比,IOP3a作用的荷瘤裸鼠的白细胞和淋巴细胞数高于阳性对照组 (p<0.01),说明IOP3a具有一定的升高裸鼠白细胞和淋巴细胞的功能。
表3 IOP3a对荷瘤裸鼠外周血白细胞和淋巴细胞的影响(,n=5)Table3 EffectofIOP3a on whiteblood celland Lymphocyte of nude mice(,n=5)

表3 IOP3a对荷瘤裸鼠外周血白细胞和淋巴细胞的影响(,n=5)Table3 EffectofIOP3a on whiteblood celland Lymphocyte of nude mice(,n=5)
注:与阴性对照组比较,a:p<0.05;与阳性对照组比较b: p<0.01。
?
2.5 IOP3a对裸鼠巨噬细胞产生细胞因子的影响
IOP3a对裸鼠巨噬细胞产生细胞因子L-1β和TNF-α的影响见表4。可以看出,与阴性对照组相比,IOP3a多糖对巨噬细胞产生的细胞因子TNF-α和 L-1β 均有明显的促进作用 (P<0.01,P<0.05),且IOP3a多糖对TNF-α的促进作用具有剂量依赖关系,在IOP3a多糖质量浓度为200 mg/L时最为显著,培养上清液中TNF-α的质量浓度达 (279.35±36.24)ng/L,而IOP3a多糖对L-1β的促进作用无剂量依赖关系,在IOP3a多糖质量浓度为100 mg/L时最为显著,培养上清液中L-1β的质量浓度达(49.32±12.09)ng/L,与阳性对照5-Fu相比无明显差异。
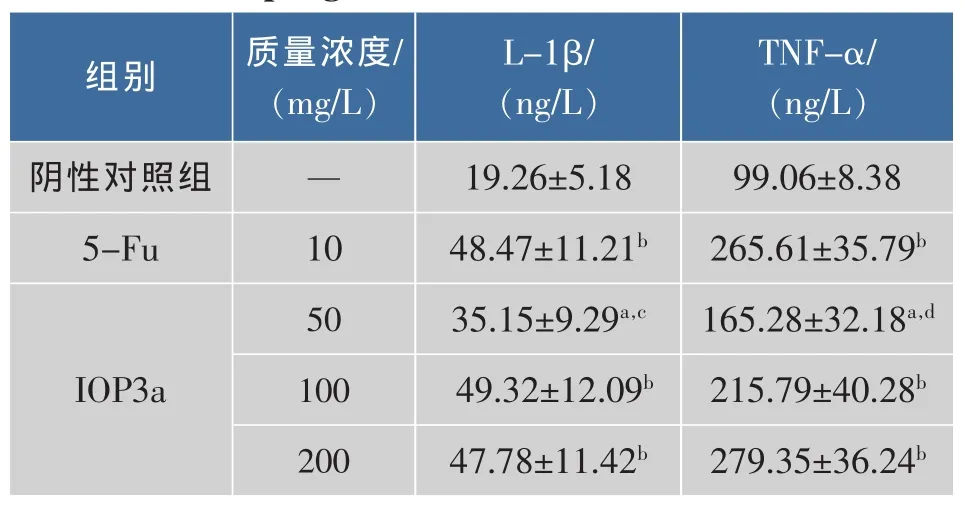
表4 IOP3a对裸鼠巨噬细胞产生细胞因子的影响Table 4 Effect of IOP3a on generation of cytokines from macrophage of nude mouse
2.6 组织病理学观察
裸鼠连续给药28 d后,裸鼠Jurkat肉瘤病理组织学观察见图3。可以看出:阴性对照组肿瘤结构无明显改变,生长旺盛,IOP3a组、5-Fu组肿瘤体积明显小于阴性对照组,瘤块组织松脆,IOP3a组瘤组织出现坏死,有明显的肿瘤坏死灶,5-Fu阳性组瘤组织大面积坏死,结构不清。
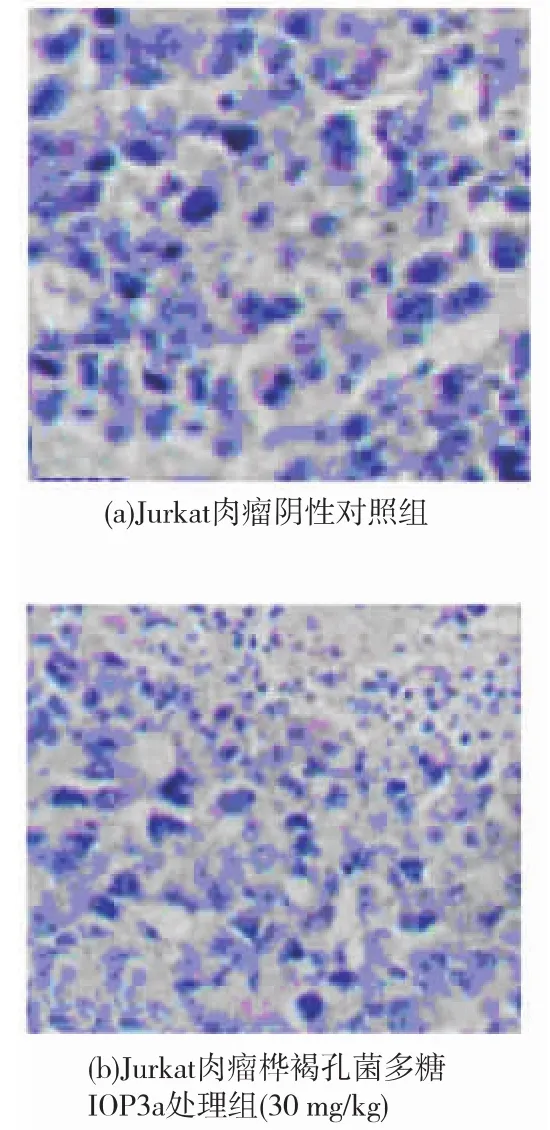
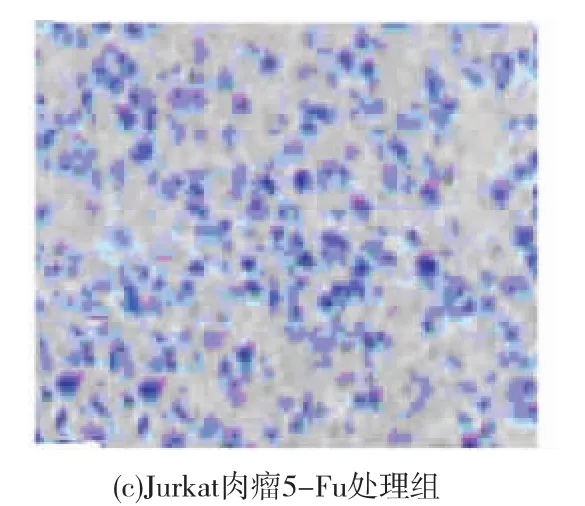
图3 裸鼠Jurkat肉瘤病理组织学(400×)Fig.3 Histopathology of tumors from transplanted tumor nude mice(400×)
2.7 IOP3a对裸鼠Jurkat肿瘤组织中Bax和Bcl-2基因蛋白表达的影响
Bcl-2家族蛋白根据其功能分为两类:一类以Bax、Bad、Bak、Bid 为代表,促进细胞凋亡;另一类以Bcl-2、Bcl-xl为代表,抑制细胞凋亡,Bcl-2家族蛋白通过二聚体网络形式相互作用,调控细胞的凋亡[10-11]。IOP3a对裸鼠 Jurkat肿瘤组织中 Bax和Bcl-2基因蛋白表达的影响结果见图4和表5。
由图4可知:β-Actin(β-肌动蛋白)基因表达量不随药物处理变化,呈现稳定的表达,随着IOP3a处理浓度的增大,Jurkat肿瘤组织细胞中Bax基因表达条带变宽、变深,光密度值与阴性对照组相比不断增大,差异显著(p<0.05),见表 5,明显抑制Bcl-2基因的表达(p<0.05)。5-FU组显著地促进肿瘤组织细胞中Bax基因蛋白的表达,同样明显抑制Bcl-2基因的表达(p<0.05)。表明 IOP3a通过促进肿瘤组织细胞中Bax蛋白表达、抑制Bcl-2表达起到抗肿瘤作用。
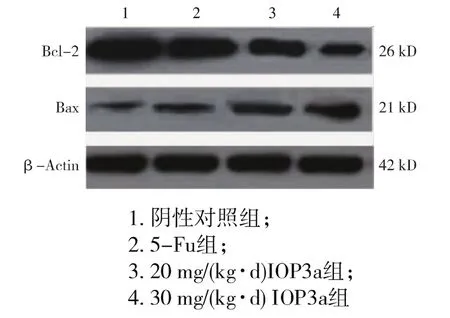
图4 IOP3a对裸鼠Jurkat肿瘤组织中Bax和Bcl-2基因蛋白表达的影响Fig.4 Effect of IOP3a on expression of Bax and Bcl-2 in Jurkat tumors from the transplanted tumor nude mice through immunohistochemical analysis

表5 不同组Bax、Bcl-2基因蛋白表达定性分析Table 5 Quantitative analysis of the expression of Bax and Bcl-2 proteins
3 结语
通过对IOP3a体内抗肿瘤作用及其机制进行研究,得出如下结论:
1)通过建立裸鼠Jurkat模型评价IOP3a的体内抗肿瘤效果,IOP3a可以明显地抑制荷瘤裸鼠肿瘤体积,具有很好的抑制肿瘤生长的作用。IOP3a高、中剂量组瘤质量与阴性对照组的瘤质量相比均有显著性差异(p<0.05),肿瘤抑制率分别为69.28%和57.62%,有明显的剂量—效应关系,随着剂量的增加,脾脏指数有逐步增加的趋势,具有升高裸鼠白细胞和淋巴细胞的功能,IOP3a多糖对巨噬细胞产生的细胞因子TNF-α和L-1β均有明显的促进作用,组织病理学观察表明,IOP3a可使肿瘤组织中呈现明显肿瘤坏死灶、瘤组织出现坏死的现象。
2)免疫组化表明,IOP3a通过促进肿瘤组织细胞中Bax蛋白表达、抑制Bcl-2表达起到抗肿瘤的作用。
[1]陈义勇,顾小红,汤坚.桦褐孔菌多糖IOP3a的分离纯化及其体外抗肿瘤活性研究[J].食品科学,2010,31(15):91-94.CHEN Yi-yong,GU Xiao-hong,TANG Jian.Isolation,purification and anti-tumor activity of a polysaccharide,IOP3a from Inonotus obliquus[J].Food Science,2010,31(15):91-94.(in Chinese)
[2]陈义勇,顾小红,汤坚.桦褐孔菌多糖的抗肿瘤活性研究[J].食品与生物技术学报,2011,30(1):65-69.CHEN Yi-yong,GU Xiao-hong,TANG Jian.Study on anti tumor activities of polysaccharides from Inonotus obliquus[J].Journal of Food Science and Biotechnology,2011,30(1):65-69.(in Chinese)
[3]Chen Y Y,Gu X,Huang S Q,et al.Optimization of ultrasonic/microwave assisted extraction (UMAE)of polysaccharides from Inonotus obliquus and evaluation of its anti-tumor activities[J].International Journal of Biological Macromolecules,2010,46:429-435.
[4]金光,杨恩月,金晴昊,等.桦褐孔菌多糖的抗肿瘤作用实验研究[J].延边大学医学学报,2004,27(4):257-259.JIN Guang,YANG En-yue,JIN Qing-hao,et al.Studies on antitumor activities of Fuscoporia obique polysaccharide[J].Journal of Medical Science Yanbian University,2004,27(4):257-259.( in Chinese)
[5]张慧丽,杨松,李玉,等.桦褐孔菌多糖的提取及对肝癌细胞SMMC7721的抗增殖的研究[J].中国食用菌,2006,25(2):31-33.ZHANG Hui-li,YANG Song,LI Yu,et al.Extraction of inonotus obliquus polysaccharide and the effect of anti-proliferation on SMMC7721 cells of lung cancer[J].Edible Fungi of China,2006,25(2):31-33.(in Chinese)
[6]Kim Yong Ook,Hanb Sang Bae,Lee Hong Woen,et al.Immuno-stimulating effect of the endo-polysaccharide produced by submerged culture of Inonotus obliquus[J].Life Sciences,2005,77:2438-2456.
[7]Kim Yong Ook,Park Hae Woong,Kim Jong Hoon,et al.Anti-cancer effect and structural characterization of endopolysaccharide from cultivated mycelia of Inonotus obliquus[J].Life Sciences,2006,79:72-80.
[8]Liu Jun-Jen,Huang Tien-Shang,Hsu Ming-Ling,et al.Antitumor effects of the partially purified polysaccharides from Antrodia camphorata and the mechanism of its action[J].Toxicology and Applied Pharmacology,2004,201:186-193.
[9]杜小燕,侯颖,覃华,等.绞股蓝多糖的抗肿瘤作用及其机制研究[J].科学技术与工程,2009,20(9):5968-5972.DU Xiao-yan,HOU Ying,QIN Hua,et al.Studies on the anti-tumor activity of polysaccharide from Gynostemma pentaphyllum and its mechanism[J].Science Technology and Engineering,2009,20(9):5968-5972.(in Chinese)
[10]Hale A J,Smith C A,Suthefiand L C,et al.Apoptosis:molecular regulation of cell death[J].European Journal of Biochemistry,1996,236:17-26.
[11]Lindsten T,Ross A J,King A,et al.The combined functions of proapoptic Bcl-2 family members Bak and Bax are essential for normal development of multiple tissues[J].Molecular Cell,2000(6):1389-1399.
