碱提杏鲍菇多糖PEAP-1的结构初探及形貌观察
2013-11-09张力妮张化朋刘阿娟
梁 涛, 张 静, 张力妮, 张化朋, 张 鹏, 刘阿娟
(1.陕西师范大学 食品工程与营养科学学院,陕西 西安710062;2.陕西师范大学 物理学与信息技术学院,陕西西安 710062)
杏鲍菇(Pleurotus eryngii)俗称刺芹侧耳、雪茸、鲍鱼菇、或干贝菇等[1],为真菌界(Mycota)、真菌门(Eumycota)、担子菌亚门(Basidiomycotina)、层菌纲(Hymenomycetes)、 同 担 子 菌 亚 纲(Homobasidiomycetes)、伞菌目(Agaricales)、侧耳科(Pleurotaceae)、侧耳属(Pleurotus)珍稀食用菌。主要分布于西欧国家以及南亚、中东一带和我国的新疆、青海、四川地区,是高山、草原以及沙漠地带的一种品质优良的大型肉质伞菌,也是我国的珍稀名贵野生食用菌。现代临床研究表明,杏鲍菇具有抗氧化[2]、抗肿瘤[3]、抗肝损伤和降血脂[4]、抗血管生成[5]等生物活性和药理作用。
对杏鲍菇水提多糖的研究目前已有报道。杨立红[6]等,从杏鲍菇子实体中分离纯化出两种杏鲍菇多糖,利用紫外光谱检测,表明两种多糖均不含核酸和蛋白质;红外光谱测定结果表明,两种多糖均为含有葡萄糖醛酸的葡聚糖;小鼠实验结果表明,杏鲍菇多糖对力竭小鼠具有明显的抗氧化作用,对肝脏、骨骼肌有明显抗损伤作用。Jung[3]等,对杏鲍菇多糖进行硫酸化修饰,并研究硫酸化的程度对杏鲍菇多糖的结构和生物活性的影响。结果表明,硫酸化修饰能够加强杏鲍菇多糖的生物活性。然而对杏鲍菇碱提多糖的研究鲜见报道。利用稀碱溶液浸提,可以分离一些新颖的多糖组分,多糖的得率也大大提高[7]。由于稀碱液有助于解除植物细胞壁分子间的化学和物理作用,且碱提多糖具有一定的生物活性[8]。因此,笔者采用 DEAE-52纤维素和Sephadex G-150凝胶柱层析对碱提杏鲍菇粗多糖进行分离纯化,获得均一多糖PEAP-1,并综合采用高效液相色谱(HPLC)、气相色谱(GC)、IR、刚果红实验、原子力显微镜(AFM)、环境电镜扫描(SEM)等方法,分析其构象和分子外貌,为今后碱提杏鲍菇多糖的研究及开发利用提供了结构信息和科学依据。
1 材料与方法
1.1 试验材料
1.1.1 试剂 DEAE-52纤维素,Whatman公司提供;SphadexG-150,Pharmacia公司提供;标准葡聚糖、标准单糖,Sigma提供;其它试剂均为AR级。
1.1.2 仪器 北京普析TU-1810型紫外可见分光光度计;Christ Alphal-4型真空冷冻干燥机;Waters1525型高效液相色谱仪 (Water2414型示差折光检测器,色谱柱:Shodex Ohpak SB-804 HQ,流动相:超纯水);Agilent气相色谱仪;FEI Quanta200型环境扫描电子显微镜;岛津SPM-9500J3型原子力显微镜,Bruker Tensor27型红外光谱仪。
1.1.3 杏鲍菇 陕西杨凌金麒麟生物科技有限公司提供。
1.2 杏鲍菇多糖的提取、分离及纯化
1.2.1 提取及分离纯化 杏鲍菇粗多糖参照文献[9]的方法提取,提取率为8.6%。取粗多糖0.3 g溶于蒸馏水10 mL中,离心,上清液经DEAE-52型纤维素柱层析分离,依次用蒸馏水,0.1、0.3及0.5 mol/L NaCl溶液洗脱,体积流量为0.6 mL/min,DBS-100型收集器进行收集,每管8 mL,苯酚-硫酸法检测,收集各组分洗脱液,减压浓缩后冷冻干燥。主峰多糖组分为0.1 mol/L NaCl溶液洗脱所得组分,命名其为PEAP1,取PEAP1 30 mg溶于蒸馏水5 mL中,离心,上清液再经Sephadex G-150型凝胶过滤柱层析纯化,蒸馏水为洗脱液,体积流量为0.3 mL/min,每管收集3 mL,苯酚-硫酸法检测,收集洗脱液,冷冻干燥得到多糖PEAP-1。
1.2.2 PEAP-1的纯度和相对分子质量测定 采用高效液相色谱法(HPLC)对PEAP-1多糖进行纯度鉴定。称取PEAP-1适量,配制2 mg/mL质量浓度多糖溶液,进行HPLC分析。色谱条件:Waters1525型高效液相色谱系统,色谱柱为Shodex Ohpak SB-804 HQ,流动相为超纯水,体积流量为0.8 mL/min,Waters2414型示差折光监测器,柱温30℃,进样量为20 μL,以洗脱峰的保留时间为横坐标,已知葡聚糖标品相对分子质量的对数值为纵坐标,绘制标准曲线。
1.2.3 PEAP-1的单糖组成分析 多糖的水解参照文献[10]的方法进行,水解物制备多糖的糖睛乙酸酯衍生物[11],衍生物进行GC分析。色谱条件:Thermo TR-5石英毛细管柱 (30 m×0.32 mm ID×0.25 μm),FID 检测器,程序升温:150 ℃(7 ℃/min)→190℃(15℃/min)→250℃;进样口温度280℃,检测器温度260℃;载气:N2体积流量30 mL/min,H2体积流量50 mL/min,空气体积流量300 mL/min;进样量0.1 μL;内标:肌醇六乙酸酯。对照用标准单糖为:D-葡萄糖、D-半乳糖、D-木糖、L-阿拉伯糖、D-甘露糖、L-鼠李糖。
1.2.4 PEAP-1的IR分析 称取适量PEAP-1与适量干燥的KBr粉末混合研磨后压片,在4 000~400 cm-1范围内进行红外扫描。
1.2.5 PEAP-1的刚果红实验 2 mL质量浓度为0.5 mg/mL的PEAP-1溶液,与2 mL质量浓度为50 μg/mL的刚果红溶液,及1 mL不同浓度NaOH溶液(依次配成不同浓度0.05~0.5 mol/L)混合并摇匀,在25℃反应10 min,用紫外分光光度仪进行400~600 nm扫描,依次测定混合液在不同浓度NaOH溶液中最大吸收波长的变化。同时以2 mL刚果红溶液和1 mL不同浓度NaOH溶液混合作为对照组。参见文献[12]。
1.2.6 PEAP-1的原子力显微镜 将干燥的样品1 mg溶于1 mL去离子蒸馏水中,封管在85℃水浴中加热1 h,冷却至室温;再稀释,直至样品质量浓度为10 μg/mL。置于磁力搅拌器持续搅拌24 h后,通过加热使样品溶解完全且减少聚集体的存在。取样品溶液5 μL滴在新剥取的云母表面,常温常压下空气干燥,再滴加无水乙醇固定,防止多糖从云母片上脱落,样片干燥后即可进行AFM观测。图像在Contact模式下获得,测试在室温和大气环境中进行,湿度为 50%~60%,探针为 Si3N4,用 200 μm 长的微悬臂,力弹性常数为0.12 N/m。
1.2.7 PEAP-1的环境扫描电镜 取多糖样品粘着于样品台上,置真空喷镀仪内喷金镀导电层,采用Quanta200型环境扫描电镜进行扫描;模式:高真空模式;电子枪加速电压:20 kV[13]。
2 结果与分析
2.1 PEAP-1的理化性质分析
杏鲍菇碱提多糖PEAP-1是一种浅黄色海绵状固体,易溶于水,不溶于乙醇、丙酮、氯仿、乙酸乙酯等有机溶剂。紫外全波长扫描显示,在260、280 nm和可见区处均无吸收,说明PEAP-1不含核酸、蛋白质和色素,在190 nm处有多糖的特征吸收峰。与碘-碘化钾溶液反应为阴性,说明其不含淀粉及纤维素;与菲林试剂反应呈阴性,说明其不含还原糖。
2.2 PEAP-1纯度和相对分子质量测定
如图1所示,PEAP-1在HPGPC中呈现单一对称尖峰,表明其为均一多糖。根据标准葡聚糖系列Dextran T-2000、T-500、T-70、T-40、T-10 制作标准曲线:lgMW=-0.665 0tR+9.995 8。式中,MW为标准葡聚糖的已知相对分子质量,tR为其保留时间。根据HPLC的保留时间tR=6.524,根据标准曲线确定其相对分子质量约为450 kDa。

图1 PEAP-1高效液相色谱图Fig.1 HPLC of PEAP-1
2.3 PEAP-1的单糖组成分析
将PEAP-1完全水解物进行糖腈乙酸酯衍生化,衍生物进行GC分析。通过与标准品GC图谱保留时间相比较,确定其单糖组成为葡萄糖和半乳糖,如图2所示,并计算出单糖摩尔比为16.9∶0.37,说明PEAP-1是一种以葡萄糖为主的多聚糖。

图2 PEAP-1气相色谱图Fig.2 GC of PEAP-1
2.4 IR分析
PEAP-1的红外光谱从 400~4 000 cm-1,如图3所示,3 365 cm-1为 (—OH官能团)O—H的伸缩振动,2 932 cm-1为(-CH2-官能团)C—H的伸缩振动,1 747 cm-1为(—COOH、—CHO或—COOR官能团)C=O伸缩振动,1 629 cm-1为 (—C=O或—CHO官能团)C=O的伸缩振动,1 442 cm-1为(—COOH官能团)C—O的弯曲振动,1 382 cm-1为(—COOH官能团)C=O的对称伸缩振动,1 110 cm-1为(—C—O—C—官能团)C—O的伸缩振动[14-15]。919 cm-1为(D-葡萄糖)的反对称环振动[16],832 cm-1为(D-半乳糖)C—H的弯曲振动[17]。600~950 cm-1为异头区域,586 cm-1为吡喃糖环的骨骼模型[17-18]。
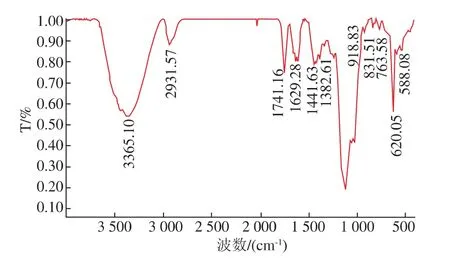
图3 PEAP-1红外光谱图Fig.3 IR of PEAP-1
2.5 刚果红
刚果红(Congo red)是一种酸性染料,能溶于水和乙醇。有研究表明[19],具有抗肿瘤活性的β-(1→3)葡聚糖,其构象一般为三股螺旋构象,而且有三股螺旋的β-(1→3)葡聚糖与刚果红复合后,在0~0.2 mol/L NaOH溶液范围内,在可见光区的最大吸收波长(λmax)具有向波长(500 nm)方向移动的特点,因此在碱性介质中,研究多糖刚果红复合物的λmax可以得到多糖构象的有关信息。
杏鲍菇碱提多糖PEAP-1的刚果红实验曲线如图4所示,随着NaOH浓度的增高,杏鲍菇碱提多糖与刚果红的最大吸收波长相应减小,但相对于刚果红本身最大吸收波长减小明显缓慢,虽然络合物与刚果红本身相比发生了红移,但并未表现出具有三股螺旋结构的多糖与刚果红形成的络合物在不同浓度的NaOH溶液中所表现出的亚稳区,说明杏鲍菇碱提多糖不具有三股螺旋结构。
2.6AFM表征
图5(a)(b)分别为 10 μg/mL PEAP-1 不同放大倍数的原子力显微镜图。从图5(a)中可以看到,在云母表面,PEAP-1呈分子链形态并有少量的聚集体存在,这可能是由于多糖中含有糖醛酸而带有负电荷,云母片本身也带负电荷,所以云母片会和多糖样品产生排斥,从而使多糖分子聚集成团[20]。为了更清晰地观察到多糖的真实形态,提高放大倍率,从图5(b)中可以看见PEAP-1的无规则分子链形态,无三股螺旋结构,这与刚果红实验结果相符。用AFM附带软件测得多糖单链的高度在0.13~1.2 nm之间,宽度在20~59 nm范围内。多糖分子单链直径理论值在0.1~1 nm之间[21],PEAP-1分子单链直径与理论值相符,而宽度远大于单链分子的估算值,这是由于有限大小的针尖,在扫描时不同的部位与分子链作用,导致增宽效应在DNA的AFM观测中也发现类似的现象[22]。

图4 PEAP-1刚果红反应Fig.4 Congo red reaction of PEAP-1

图5 PEAP-1(10 μg/mL)原子力显微镜图Fig.5 AFM of PEAP-1(10 μg/mL)
2.7 环境电镜扫描
图6(a)(b)分别是杏鲍菇碱提多糖试样不同放大倍数的扫描电镜图像,扫描结果表明:在低倍率下(500×),样品堆积 A、B、C 3 种形貌结构,依次为光滑片状、长杆状和网状,如图6(a)所示,不能获得多糖聚集体的微观形貌信息。因此,提高放大倍率(5 000×),针对每一种类型多糖形貌进行扫描,图6(b)分别是高倍率下A、B和C的形貌。片状结构(A)表面紧密,较为平整,说明分子间相互作用较强,这与其较大相对分子质量特性相吻合;长杆状结构(B)在空间上相互缠绕,相互支撑,排列松散,这很好地解释了多糖在宏观下“海绵”状的形貌;网状结构(C)表面粗糙,网孔分布杂乱,大小不一,这可能是由于在冷冻干燥过程中冷肼制冷不足而使多糖表面未彻底冻结而引起的。这些形貌也可能与提取过程中碱液浓度过高或处理时间过长而引起多糖结构的破坏有关。
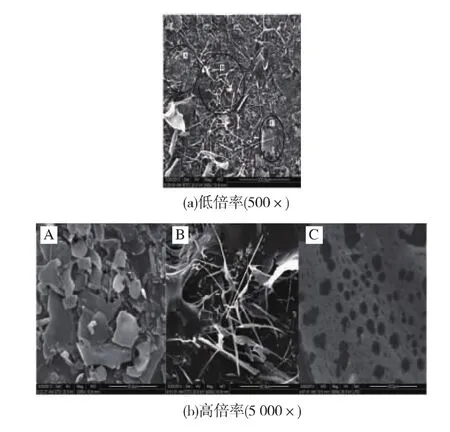
图6 PEAP-1环境扫描电镜Fig.6 SEM of PEAP-1
3 讨论
长期以来,多糖界公认多糖的活性在很大程度上取决于其相对分子质量的大小,Lee等[23]从蛹虫草培养菌丝中分离出一种相对分子质量为210 kDa的高分子量多糖CPMN FrⅢ,其具有抗免疫特性。Gomaa等人[24]从炭疽菌的培养液中分离出相对分子质量约为670 kDa的高分子葡聚糖,其具有抗肿瘤活性。同样,杏鲍菇碱提多糖PEAP-1也是一种大分子量多糖,相对分子质量达到450 kDa,其所具有的活性有待进一步研究。
本课题中研究的多糖PEAP-1不具有三股螺旋结构。虽有研究表明[19],具有抗肿瘤活性的β-(1→3)葡聚糖,其构象一般为三股螺旋构象,但W Blaschek等人[25]从腐霉菌中提取出两种大分子量的葡聚糖,都具有抗肿瘤活性但没有螺旋结构。Gomaa等人[24]从炭疽菌的培养液中分离出相对分子质量约为 670 kDa 的高分子的 β-(1→3)-D-葡聚糖,其抗肿瘤活性与有序结构无关。这说明不具有三股螺旋结构的多糖不一定没活性。
多糖生物活性与化学结构的关系不仅建立在多糖分子的一级结构上,而且还与多糖分子的高级结构有关。AFM是一种新型的生物大分子高级结构分析方法,由于其操作性好,灵敏度高,分析范围可达到纳米级等众多优势,因而被广泛应用于分析生物大分子的高级结构。蔡林涛等[23]在国内首次采用AFM分析多糖结构,结果表明虫草多糖分子链呈分枝结构。孙润广等[26]用AFM观察到甘草多糖的分子链呈多股紧密的螺旋结构。本课题研究中AFM分析结果表明,PEAP-1多糖分子链呈无规则链状且具有多分支结构,多糖单链的高度在0.13~1.2 nm之间,宽度在20~59 nm范围内。
多糖的结构分析较蛋白质结构分析复杂,这是因为组成多糖的单糖品种繁多,而且即使只有一种单糖,单糖残基的组成、排列序列与连接方式等,因异头物的构型(α或β)、单糖基的构型(L或D)、糖基环化方式(五元环或六元环)、有无侧链、糖基上的羟基是否被取代(如硫酸基、磷酸基、酰基和氨基等)、相邻单糖基相连糖苷键的位置 (1→2,1→3,1→4,1→6 等)等的不同而不同,若多糖是由不同的单糖基所组成的杂多糖,其结构还包括多糖基连接的顺序[27]。本课题研究中IR分析结果表明,PEAP-1中存在D-葡萄糖和D-半乳糖吡喃糖环结构。单糖残基异头物的构型(α或β),有条件将进一步利用核磁表征多糖的结构,这是今后需进一步做的研究工作。
[1]杜敏华,田龙.微波辅助法提取杏鲍菇多糖研究[J].食品科技,2007(3):117-119.DU Ming-hua,TIAN Long.Study on extraction of polysaccharide of pleurotus eryngii via microwave-assisted route[J].Food Science and Technology,2007(3):117-119.(in Chinese)
[2]Liu Xiao-nan,Zhou Bo,Lin Rong-shan,et al.Extraction and antioxidant activities of intracellular polysaccharide from Pleurotus sp.mycelium[J].International Journal of Biological Macromolecules,2010,47(2):116-119.
[3]Jung H Y,Bae I Y,Lee S,et al.Effect of the degree of sulfation on the physicochemical and biological properties of Pleurotus eryngii polysaccharides[J].Food Hydrocolloids,2011,25(5):1291-1295.
[4]Chen Jing-jing,Mao Dong,Yong Yang-yang,et al.Hepatoprotective and hypolipidemic effects of water-soluble polysaccharidic extract of Pleurotus eryngii[J].Food Chemistry,2012,130(3):687-694.
[5]Shenbhagaraman R K,Jagadish L,Premalatha K,et al.Optimization of extracellular glucan production from Pleurotus eryngii and its impact on angiogenesis[J].International Journal of Biological Macromolecules,2012,50(4):957-964.
[6]杨立红,史亚丽,王晓洁,等.杏鲍菇多糖的分离纯化及生物活性的研究[J].食品科技,2005(6):18-21.YANG Li-hong,SHI Ya-li,WANG Xiao-jie,et al.Isolation and purification of polysaccharides of Pleurotus eryngii and its bioactive[J].Food Science and Technology,2005(6):18-21.(in Chinese)
[7]丁重阳,张笑然,梁张,等.姬松茸胞内多糖碱提取工艺的研究[J].生物加工过程,2008,6(5):21-26.DING Chong-yang,ZHANG Xiao-ran,LIANG Zhang,et al.Alkaline extraction process of intracellular polysaccharides from Agaricus blazei Murill[J].Chinese Journal of Bioprocess Engineering,2008,6(5):21-26.(in Chinese)
[8]苏红,李青连,魏磊,等.真菌多糖水提及化学辅助提取方法研究进展[J].微生物学通报,2010,37(3):426-432.SU Hong,LI Qing-lian,WEI Lei,et al.Research progress in water extraction method and chemical assisted extraction method of fungal ploysaccharides[J].Journal of Microbiology,2010,37(3):426-432.(in Chinese)
[9]Palacios I,Garcia-Lafuente A,Guillamon E,et al.Novel isolation of water-soluble polysaccharides from the fruiting bodies of pleurotus ostreatus mushrooms[J].Carbohydrate Research,2012,358(1):72-77.
[10]杨延超,徐德平.大麦多糖的降血糖活性及结构解析[J].食品与生物技术学报,2012,31(10):1087-1092.YANG Yan-chao,XU De-ping.Hypoglycemic effect and structural determination of polysaccharides from barley malt[J].Journal of Food Science and Biotechnology,2012,31(10):1087-1092.(in Chinese)
[11]Chen Dan,Yao Wei-juan,Han Xiao-qiang,et al.Effects of Gekko sulfated polysaccharide-protein complex on human hepatoma SMMC-7721 cells:Inhibition of proliferation and migration[J].Journal of Ethnopharmacology,2010,127(3):702-708.
[12]YiYang,Zhang Ming-wei,Liao Sen-tai,etal.Effectsofalkailidissociation on themolecularconformation and immunomodulatory activity of longan pulp polysaccharide(LPI)[J].Carbohydrate Polymers,2012,87(2):1311-1317.
[13]倪德江,陈玉琼,谢笔钧,等.乌龙茶多糖OTPS2-1的光谱特性、形貌特性及热特性研究[J].高等学校化学学报,2004,25(12):2263-2268.NI De-jiang,CHEN Yu-qiong,XIE Bi-jun,et al.Spectrum,morphological and thermal characteristics of OTPS2-1 in polysaccharides from Oolong tea[J].Chemical Journal of Chinese Universities,2004,25(12):2263-2268.(in Chinese)
[14]Yi Yang,Zhang Ming-wei,Liao Sen-tai,et al.Structural features and immunomodulatory activities of polysaccharides of longan pulp[J].Carbohydrate Polymers,2012,87(1):636-643.
[15]Yi Yang,Liao Sen-tai,Zhang Ming-wei,et al.Physicochemical characteristics and immunomodulatory activities of three Polysaccharide-Protein complexes of longan pulp[J].Molecules,2011,16(7):6148-6164.
[16]Cui Heng-xiang,Liu Qin,Tao Yong-zhen,et al.Structure and chain conformation of a (1→6)-α-D-glucan from the root of Pueraria lobata (Willd)Ohwi and the antioxidant activity of its sulfated derivative[J].Carbohydrate Polymers,2008,74(4):771-778.
[17]Yang Li-qun,Zhang Li-ming.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers,2009,76(3):349-361.
[18]Song Guang-lei,Du Qi-zhen.Structure characterization and antitumor activity of an α β-glucan polysaccharide from Auricularia polytricha[J].Food Research International,2012,45(1):381-387.
[19]张安强,马新,何荣军,等.硫酸酯化猴头菌多糖的结构与构象分析[J].食品与发酵工业,2009,35(3):64-67.ZHANG An-qiang,MA Xin,HE Rong-jun,et al.Structure and conformation analysis of sulfated polysaccharide from the fruiting bodies of Hericium erinaceus[J].Food and Fermentation Industries,2009,35(3):64-67.(in Chinese)
[20]韩铨.茶树花多糖的提取、纯化、结构鉴定及生物活性的研究[D].杭州:浙江大学,2011.
[21]Wang Yuan-feng,Yu Lan,Zhang Jia-chen,et al.Study on the purificatin and characterization of a polysaccharide conjugate from tea flowers[J].International Journal of Biological Macromolecules,2010,47(2):266-270.
[22]蔡林涛,李萍,陆祖宏.原子力显微镜观察虫草多糖分子的结构形貌[J].电子显微学报,1999,18(1):103-105.CAI Lin-tao,LI Ping,LU Zu-hong.Observation of the structure morphology of cordyceps polysaccharide by atomic force microscope[J].Journal of Chinese Electron Microscopy Society,1999,18(1):103-105.(in Chinese)
[23]Lee J S,Kwon J S,Yun J S,et al.Structural characterization of immunostimulating polysaccharide from cultured mycelia of Cordyceps militaris[J].Carbohydrate Polymers,2010,80(4):1011-1017.
[24]Gomaa K,Kraus J,Franz G,et al.Antitumour and immunological activity of a β1→3/1→6 glucan from Glomerella cingulata[J].Journal of Cancer Research and Clinical Oncology,1992,118(2):136-140.
[25]Blaschek W,Kasbauerm J,Kraus J,et al.Pythium aphanidermatum:Culture,cell wall composition,and isolation and structure of antitumor storage and solubilised cell-wall(1→3),(1→6)-β-D-glucans[J].Carbohydrate Research,1992,231:293-307.
[26]孙润广,张静.甘草多糖螺旋结构的原子力显微镜研究[J].化学学报,2006,64(24):2467-2472.SUN Run-guang,ZHANG Jing.A study of helical structure of glycyrrhiza polysaccharides by atomic force microscope[J].Acta Chimica Sinica,2006,64(24):2467-2472.(in Chinese)
[27]李小定.灰树花多糖的结构及其生物活性[D].武汉:华中农业大学,2002.
