亚麻醉剂量氯胺酮对机械性刺激作用脑区的影响
2013-11-08王海燕叶铁虎
邹 亮,王海燕,原 皓,徐 磊,孙 莉,叶铁虎
1中国医学科学院 北京协和医学院 肿瘤医院麻醉科,北京100021
2中国医学科学院 北京协和医学院 北京协和医院麻醉科,北京100730
脑功能成像技术包括正电子发射计算机断层(positron emission tomography,PET)、功能磁共振成像(functional magnetic resonance imaging,fMRI)等。已有PET研究证实,疼痛可激活特殊脑区[1],而fMRI的相关研究较少,且多局限于慢性疼痛[2]及阿片类药物成瘾方面的研究[3]。氯胺酮作为临床应用较广的镇痛药[4],其中枢作用脑区研究非常少,有研究结果显示100 ng/ml氯胺酮具有镇痛作用[5],而笔者前期临床研究显示靶控输注氯胺酮100 ng/ml没有镇痛作用[6]。本研究拟在3.0 T fMRI下,探讨100 ng/ml氯胺酮对机械性刺激作用脑区的影响。
对象和方法
对象于北京协和医院临床药理中心受试者库中选取健康受试者13名,纳入标准: (1)男性,年龄20~40岁,18 kg/m2<体重指数<25 kg/m2;(2)右利手[7];(3)初中以上文化程度; (4)既往无任何其他严重疾病史,无手术麻醉史,无精神及神经系统疾病,无疼痛病史;(5)无精神及神经系统用药史,无滥用药物、酒精史;(6)无使用影响中枢神经系统和试验结果的用药史。排除及中止试验标准:(1)阿片类药物过敏史;(2)幽闭恐怖症者;(3)试验期间出现呛咳、头动,不能与研究人员合作者;(4)试验期间有明显呼吸抑制,经鼻导管吸氧,SpO2<92%者;(5)经磁共振解剖扫描发现脑部有异常者。本研究经北京协和医院伦理委员会审查和批准,向志愿者详细解释并获得知情同意。
给药及试验方法开放受试者左肘前静脉。嘱受试者平卧于功能磁共振扫描床上安静休息30 min,闭目、放松,不思考问题,戴眼罩、耳塞;以海绵垫塞紧头部两侧并以胶布固定头部,以防头部运动造成脑皮层伪激活。鼻导管吸纯氧 (3 L/min)。磁共振系统提供的监护仪 (multigas monitor 9500,Medrad公司,美国)监测血压、心率 (heart rate,HR)和脉搏血氧饱和度 (SpO2)。避免超过安全范围,安全终末点:呼吸频率 (respiratory rate,RR)<8次/min至少1 min,SpO2<92%,平均动脉压 (mean artery pressure,MAP)<60 mmHg(1 mmHg=0.133 kPa),HR<50 bpm至少1 min。采用静脉单管靶控注射泵TCI-Ⅱ (北京思路高高科技有限公司),以血浆靶控输注方式,利用Domino模型,血浆靶浓度设定为0及100 ng/ml,达到稳态后,即血浆浓度及效应室浓度均达到设定浓度,进行机械痛刺激。
疼痛刺激方法选择受试者左足心直径约2cm的圆形区域为刺激区,在此区域内的不同部位来回给予刺激。因为不同受试者对机械痛刺激的反应可存在明显差异,通过预实验选择不同弗莱探针 (von Frey filaments,vFFs)进行刺激,证实300 g为阈上刺激。采用组块设计方法,扫描流程包括解剖扫描和功能扫描。功能扫描流程为:4 min 10 s的机械性刺激扫描P(300 g)→12 min的给药扫描→重复4 min 10 s的刺激扫描P。采用300 g vFFs进行刺激,静息态 (off)与刺激态 (on)交替,时间共 4 min 10 s=10 s+[(20 s on+20 s off)×6次]。扫描初始的10 s是采集信号数据作为基线,数据并不列入统计。然后进入6次的组块序列:每个刺激态内单次刺激 (on)持续20 s,每个静息态 (off)持续20 s,反复循环6次,全面扫描时间为 4 min 10 s。给药扫描共12 min=4 min空白平衡扫描 +8 min给药后扫描 (图1)。
图像分析和统计学处理首先采用MRIconvert软件将图像格式转化为img/hdr格式,然后用SPM2软件(http://www.fil.ion.ucl.ac.uk/spm/)对fMRI数据进行分析。整个数据处理过程可分两个阶段:空间预处理和统计分析。本试验数据的预处理包括以下几个步骤:头动校正、标准化、与空间滤波、高斯平滑 (FWHM=8 mm)。个体统计得到每两个contrast的con-文件,包括condition-baseline,以及condition之间的比较;然后进行组分析。数据分析中,设定的统计阈值概率最高为P<0.001(未校正),激活体积阈值设定为10个体元,即连续激活体元达到上述数值以上的脑区考虑为有意义激活区。采用Talairach坐标分析脑区解剖位置。

图1 扫描设计Fig 1 Scan design
结 果
正式试验时有6名受试者退出,共7名受试者参与,退出原因主要由于对药物输注的恐惧。由于功能磁共振采集数据及处理完全可以对单个样本进行比对,因此本试验不受样本量的影响。受试者平均年龄(33.2±4.9)岁,平均体重 (60.9±5.7)kg,平均体重指数 (22.4±1.0)kg/m2。试验过程中两种药物浓度(0、100 ng/ml)时平均动脉压 [(80.4±10.3)mmHg比(77.5±7.0)mmHg),P>0.05]、心率 [(73.2±9.9)bpm比 (72.4±9.4)bpm,P>0.05]、血氧饱和度 [(98.7±1.1)%比 (98.3±1.3)%,P>0.05]差异无统计学意义。

表1 比较不同氯胺酮浓度下疼痛刺激激活脑区Table 1 Comparison of the activated brain regions by pain stimulus at different concentrations of ketamine
清醒时300 g vFFs刺激和氯胺酮100 ng/ml时300 g vFFs刺激疼痛评分分别是5.0(3.5,7.3)和4.0(3.0,6.5)[M(p25,p75)],差异无统计学意义 (P>0.05)。清醒时300 g vFFs刺激与氯胺酮100 ng/ml时300 g vFFs刺激比较,多激活的脑区为小脑后叶以及胼胝体,这些部位可能是氯胺酮抑制的脑区,而反向比较即氯胺酮激活的脑区主要是额叶、顶叶、枕叶、边缘叶、以及小脑后叶 (表1,图2、3)

图2 0 ng/ml氯胺酮300 g vFFs-100 ng/ml氯胺酮300 g vFFs刺激激活脑区Fig 2 Activated brain regions in response to 300 g vFFs stimulation after ketamine(0-100 ng/ml)infusion
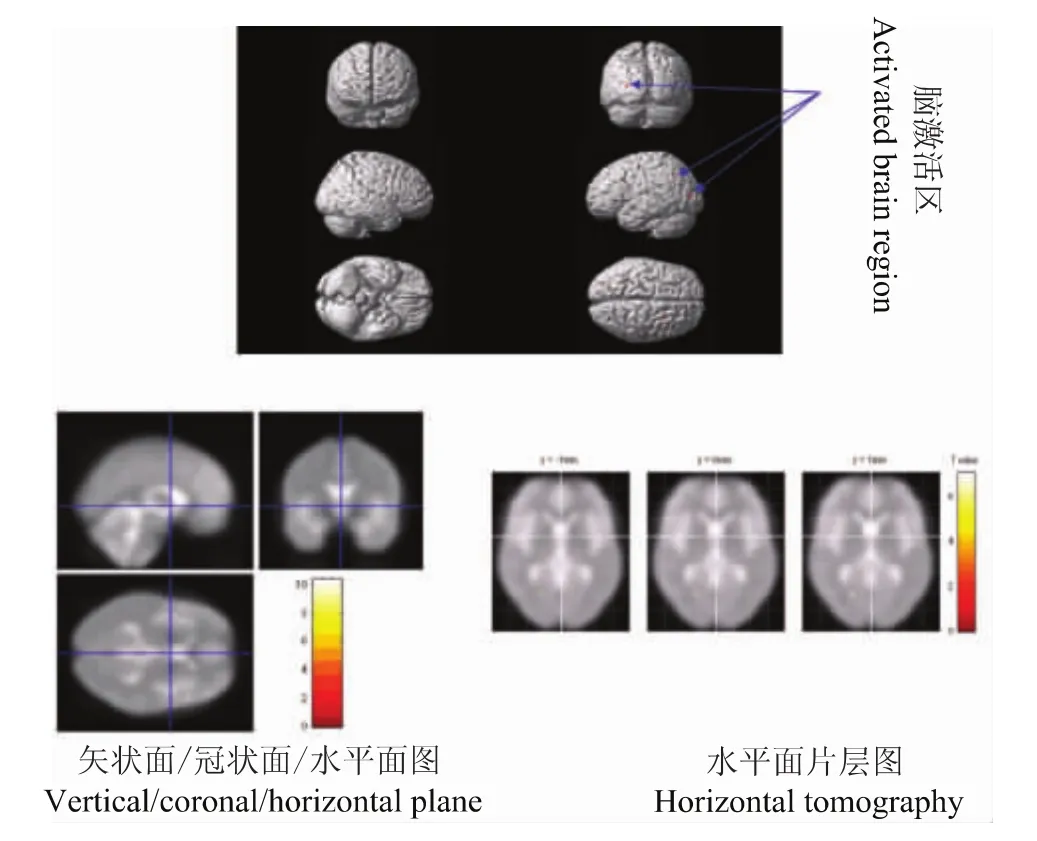
图3 100 ng/ml氯胺酮300 g vFFs刺激-0 ng/ml氯胺酮300 g vFFs刺激激活脑区Fig 3 Activated brain regions in response to 300 g vFFs stimulation after ketamine(100-0 ng/ml)infusion
讨 论
fMR是结合解剖、影像和功能三要素于一体的影像技术,是目前唯一无侵入性、不涉及放射性元素、可精确定位、信息容量大的人脑高级功能研究途径[8]。fMRI检测脑活性依赖于器官血流的变化,血氧水平依赖性功能磁共振成像 (blood oxygenation level dependent,BOLD)是目前最流行的 fMRI 技术[9]。BOLD效应是基于神经元活动对局部氧耗量和脑血流影响程度不匹配所导致的局部磁场性质变化原理。人脑接受各种感觉刺激后,相应神经元兴奋性增强,局部脑组织血流量显著增加,虽然同时氧耗量也增加,但增加幅度较低,其综合效应是局部血液氧合血红蛋白含量增加,脱氧血红蛋白的含量减少,导致局部信号增加。fMRI的空间分辨率为1 mm[10],时间分辨率为45 ms[11],并允许以单个受试者为单位分析,不受样本量的限制,对于脑功能区研究具有较大优势。
本研究采用的是最简单的减法设计,即两种不同状态交替,获得脑功能的参数。典型的fMRI试验包括相等时间 (20~30 s)的刺激和休息交替,3~5个循环,在这段时间内进行信号采集。本研究给予受试者6个循环的20 s机械性刺激 (on)和20 s静息(off)。采用vFFs作为机械性疼痛刺激方式在fMRI下进行脑区激活的观察。vFFs是测量机械疼痛 (触痛觉)比较经典的手段,方法简单、结果直观、可重复性强[12]。结果显示,100 ng/ml氯胺酮抑制小脑后叶以及胼胝体,而激活的脑区主要是额叶、顶叶、枕叶、边缘叶、以及小脑后叶,与以前疼痛的功能成像研究结果大致相同[13-14],这些脑区可能是氯胺酮发挥镇痛作用的脑区。
成像研究证实,人类正常疼痛感觉处理中大脑皮层有重要的作用[14]。尽管存在个体差异,一般认为最常被激活的脑区包括前扣带回 (anterior cingutate,ACC)、岛叶 (insular lobe,IC)、初级体感皮层 (primary somatosensory area of the cerebral cortex,SI)、次级体感皮层 (secondary somatosensory area of the cerebral cortex,SⅡ)、前额叶 (prefrontal cortex,AFC)、颞叶、丘脑和小脑[1,8,15]等,最一致的认识是疼痛激活ACC、IC和SⅡ,这些脑区合称疼痛基质。
前扣带回是在所有疼痛研究都能诱导出来的皮质区。Vogt等[16]研究认为,前扣带回吻侧主要参与疼痛的情感方面,而尾部主要参与伤害防御反射的抑制。本研究机械疼痛刺激未诱导出前扣带回激活,推测其可能原因是疼痛刺激较轻,也可能是受试者的个体差异导致组分析结果为阴性。有研究认为,扣带回可能仅是一个非特异性感觉认识整合中枢;单纯痛觉刺激只引起单侧扣带回兴奋,有注意任务时双侧均兴奋[13,17]。本研究也发现疼痛刺激时,氯胺酮激活双侧扣带回,即氯胺酮可能通过降低受试者对疼痛的注意改变其对疼痛的感知。
临床、生理及功能成像研究证实躯体感觉皮质不但参与疼痛的精细辨别还参与疼痛经历的制作[18-19]。氯胺酮改变SⅠ区的脑活动,说明氯胺酮可能干预疼痛强度的编码。额前皮质在疼痛的感知、情绪,以及反射性运动方面都具有非常重要的作用[20]。本研究结果显示氯胺酮可改变额叶神经元的活动。
两侧的后顶叶皮质都具有同SⅡ相同的感觉神经元[21],无论是试验疼痛、创伤疼痛、慢性疼痛都可引起此区域的激活[22],本研究结果发现氯胺酮改变顶叶神经元激活。
本研究还观察到氯胺酮对小脑的抑制,小脑不参与疼痛的处理,但在试验条件下,为避免受试者体动,试验前让其尽量不动,而有意识的控制体动与实际的体动都会出现小脑的激活[23]。
N-甲基-D-天冬氨酸受体 (N-methyl-D-asparticacid receptor,NMDA)广泛分布于中枢神经系统,如:海马、丘脑和下丘脑等,受体激活被认为是伤害性刺激后中枢敏化的关键所在,是持续性疼痛产生与维持的关键因素[24-25]。氯胺酮是NMDA受体非特异拮抗剂,其镇痛机制可能通过多种机制阻断NMDA受体的激活,抑制钙离子通道开放,促使钙离子内流减少,从而发挥镇痛作用[26-28]。通过本研究结果笔者推测,100 ng/ml氯胺酮可能是通过额叶、顶叶、扣带回NMDA受体非特异拮抗改变这些脑区神经元的电活动达到镇痛作用。
本研究不足之处在于样本量较小,但因fMRI可做单个样本对照研究,因此不影响研究结果。同时由于结果只是脑区激活,并不能说明氯胺酮就是在这些区域分布,因此无法对研究药物的靶点进行定位,有待后期通过其他影像方法进行定位。
[1]Casey KL,Minoshima S,Berger KL,et al.Positron emission tomographic analysis of cerebral structures activated specifically by repetitive noxious heat stimuli [J].J Neurophysiol,1994,71(2):802-807.
[2]Jones K,Friston KJ,Qi LY,et al.Sites of action of morphine in the brain [J].Lancet,1991,338(8770):825.
[3]London ED,Broussolle EP,Links JM,et al.Morphine-induced metabolic changes in human brain.Studies with positron emission tomography and[fluorine 18]fluorodeoxyglucose[J].Arch Gen Psychiatry,1990,47(1):73-81.
[4]陈默曦,许涛,江伟.氯胺酮在疼痛治疗中的应用及研究进展[J].临床麻醉学杂志,2009,8(25):735-736.
[5]Chapman V,Dickenson AH.The combination of NMDA antagonism and morphine produces profound antinociception in the rat dorsal horn [J].Brain Res,1992,573(2):321-323.
[6]邹亮,田首元,权翔.等靶控输注低于麻醉剂量氯胺酮的镇痛作用 [J].山西医科大学学报,2010,41(3):257-259.
[7]Oldfield RC.The assessment and analysis of handedness:the Edinburgh inventory [J].Neuropsychologia,1971,9(1):97-113.
[8]彭慕云.疼痛的脑功能成像研究进展 [J].中国疼痛医学杂志,2012,18(1):50-52.
[9]Ronnqvist KC,McAllister CJ,Woodhall GL,et al.A multimodal perspective on the composition of cortical oscillations[J].Hum Neurosci,2013,7(132):2-9.
[10]Goodyear BG,Menon RS.Brief visual stimulation allows mapping of ocular dominance in visual cortex using fMRI[J].Hum Brain Mapp,2001,14(4):210-217.
[11]Kwong KK,Belliveau JW,Chesler DA,et al.Dynamic magnetic resonance imaging of human brain activity during primary sensory stimulation [J].Proc Nati Acad Sci USA,1992,89(12):5675-5679.
[12]Vandermeulen EP,Brennan TJ.Alterations in ascending dorsal horn neurons by a surgical incision in the rat foot[J].Anesthesiology,2000,93(5):1294-1302.
[13]Davis KD,Taylor SJ,Crawley AP,et al.Functional MRI of pain-and attention-related activations in the human cingulate cortex [J].J Neurophysiol,1997,77(6):3370-3380.
[14]Jones AK,Brown WD,Friston KJ,et al.Cortical and subcortical localization of response to pain in man using positron emission tomography [J].Proc Biol Sci,1991,244(1309):39-44.
[15]Porro CA,Cettolo V,Francescato MP,et al.Temporal and intensity coding of pain in human cortex [J].J Neurophysiol,1998,80(6):p3312-3320.
[16]Vogt BA,Derbyshire S,Jones AK.Pain processing in four regions of human cingulate cortex localized with co-registered PET and MR imaging [J].Eur J Neurosci,1996,8(7):1461-1473.
[17]Lutz A,McFarlin DR,Perlman DM,et al.Altered anterior insula activation during anticipation and experience of painful stimuli in expert meditators [J].Neuroimage,2013,64:538-546.
[18]Greenspan JD,Winfield JA.Reversible pain and tactile deficits associated with a cerebral tumor compressing the posterior insula and parietal operculum [J].Pain,1992,50(1):29-39.
[19]Coghill RC,Talbot JD,Evans AC,et al.Distributed processing of pain and vibration by the human brain [J].J Neurosci,1994,14(7):4095-4108.
[20]Hsieh JC,Hägermark O,Ståhle-Bäckdahl M,et al.Urge to scratch represented in the human cerebral cortex during itch[J].J Neurophysiol,1994,72(6):3004-3008.
[21]Dong WK,Salonen LD,Kawakami Y,et al.Nociceptive responses of trigeminal neurons in SⅡ-7b cortex of awake monkeys[J].Brain Res,1989,484(1-2):314-324.
[22]Talbot JD,Marrett S,Evans AC,et al.Multiple representations of pain in human cerebral cortex [J].Science,1991,251(4999):1355-1358.
[23]Ito M.Movement and thought:identical control mechanisms by the cerebellum [J].Trends Neurosci,1993,16(11):448-450,discussion 453-454.
[24]王惠军.氯胺酮对中枢神经系统功能的影响 [J].国外医学:麻醉与复苏分册,2003,24(4):234-237.
[25]付元山,王 滨,马晓凯.N-甲基D-天冬氨酸2A/B受体亚型在大鼠丘脑前核和扣带后回的表达 [J].中国组织工程研究与临床康复,2007,11(13):2507-2509.
[26]Tovar KR,Westbrook GL.Mobile NMDA receptors at hippocampal synapses[J].Neuron,2002,34(2):255-264.
[27]梁映霞.疼痛相关受体和离子通道及其应用 [J].广东医学,2008,29(1):154-155.
[28]黄小波,许婷,齐国华.氯胺酮在超前镇痛中的应用[J].实用医院临床杂志,2008,5(1):9-11.
