急性呼吸窘迫综合征的抗感染治疗研究进展
2013-11-05高敏综述肖贞良李福祥审校
高敏(综述),肖贞良,李福祥(审校)
ARDS是临床常见危重症,经过40余年的努力,其临床治疗手段已有很大进步,特别是肺保护性机械通气策略、肺开放策略以及限制性液体管理策略的提出与实施,使ARDS的治疗效果得到了明显改善,但其病死率仍高达30%~50%[1-4]。感染是ARDS的常见诱因之一,同时肺内外感染又是导致ARDS患者死亡的主要原因[5]。因此,恰当的抗感染治疗是ARDS治疗所必需的手段。但一直以来,在ARDS的治疗策略中,抗感染治疗策略并未受到足够重视。目前无论是社区获得性感染还是医院获得性感染,细菌耐药都不断出现新的变化,使得ARDS的抗感染治疗面临新的压力和挑战。因此,要提高ARDS患者的救治成功率,必须在治疗策略上作出调整,特别是在抗感染治疗方面必须面对新的严峻形势,总结和完善抗感染策略。本文就ARDS与感染的关系,以及ARDS的抗感染治疗作一简要综述。
1 ARDS与感染
1.1 严重感染所致ARDS 各种外伤、严重感染、误吸、大量输血、休克等均可导致ARDS,但其最常见的诱因仍是感染[6-8]。各种诱因导致的ARDS发生率有所不同,文献报道肺炎、胰腺炎、脓毒症诱发的ARDS分别占全部ARDS的9.0%、3.6%、24.3%[9]。尽管各种不同感染均可导致ARDS,但肺内感染引起ARDS的发病机制与肺外感染有所不同。前者主要是致病因子直接导致肺泡炎症和损伤;而肺外感染,如感染性休克和脓毒症等导致ARDS的主要机制是致病因子激活多种炎性细胞,通过释放炎症介质、细胞因子,启动全身炎症反应综合征(SIRS),再通过级联效应,进一步发展为多器官功能障碍综合征(MODS)和多器官功能衰竭(MOF),ARDS是MODS和MOF在肺部的表现[10-12]。
ARDS的感染诱因可简单分为社区获得性感染(community acquired infection,CAI)和医院获得性感染(hospital acquired infection,HAI)。社区获得性感染与医院获得性感染不仅在感染的时间、地点上有明确定义,且导致感染的常见病原菌也有所不同。医院获得性感染的病原菌主要是革兰阴性菌,如铜绿假单胞菌、大肠埃希菌、肺炎克雷白杆菌及鲍曼不动杆菌[13-14]。近年来,耐甲氧西林的金黄色葡萄球菌(MRSA)以及耐万古霉素的肠球菌(VRE)导致的医院获得性感染也明显增加[15]。社区获得性感染的主要致病菌为肺炎链球菌、流感嗜血杆菌、卡他莫拉菌、肺炎支原体、肺炎衣原体和肺炎克雷白杆菌,而铜绿假单胞菌、鲍曼不动杆菌、MRSA、VRE等导致的社区获得性感染相对少见。
1.2 ARDS并发的医院获得性感染 ARDS患者常并发各种医院获得性感染,其中呼吸机相关性肺炎(ventilator associated pneumonia,VAP)是ARDS最常见的并发症,也是ICU最常见的医院获得性感染,约占ICU所有感染的25%[16-18]。VAP发生于建立人工气道、机械通气超过48h的患者[19-20]。VAP的发生不仅明显延长了机械通气时间和住ICU时间,而且显著增加了患者的病死率及医疗费用[21]。VAP的发生率居高不下与一些医疗干预措施有关,这些措施包括气管插管时间>2d、再插管、头后仰的体位、持续静脉镇静、频繁更换呼吸机管路、输入大于4U的血液制品、经鼻胃管插管、初期抗生素使用不合理等[22]。不同时间段发生的VAP,其病原微生物有所不同。机械通气少于5d的VAP,其病原菌主要为革兰阳性球菌(如葡萄球菌、肺炎链球菌)或革兰阴性菌(如流感嗜血杆菌);机械通气大于5d的VAP,病原微生物发生明显变化,主要转为耐药的革兰阴性菌,如肺炎克雷白杆菌、大肠埃希菌、铜绿假单胞菌、鲍曼不动杆菌以及耐药的革兰阳性球菌如MRSA和VRE[23-24]。耐药菌的出现增加了患者的住院病死率及住院时间[25]。
2 ARDS的抗感染治疗
2.1 社区获得性感染所致ARDS的治疗原则 重症肺炎、脓毒症、脓毒症休克、重症胰腺炎等社区获得性感染是ARDS最常见的诱因,因此积极抗感染治疗、控制原发病对ARDS的治疗有重要意义。如果延迟有效抗生素的治疗大于4h,与之相关的死亡率就会明显增加,所以应当及早进行经验性抗感染治疗[26]。社区获得性感染的治疗原则是所选抗菌药物的抗菌谱必须覆盖常见病原菌。最初经验性抗生素的选择不仅要遵循抗菌药物的临床应用原则,而且应参考当地流行病学情况及患者情况。尽管社区获得性感染的病原微生物相对较单纯,但对重症社区获得性感染患者,高危病原菌、特殊病原菌感染的机会显著增多,尤其是对使用免疫抑制剂和基础疾病复杂的患者。因此,及早获得病原学诊断及药敏试验结果,针对性地应用抗生素,对改善患者预后非常有益。
关于社区获得性感染诱发的ARDS患者的初始经验性治疗,由于此类患者的感染程度一般较重,经验性治疗必须考虑覆盖常见病原菌,因而常需联合应用抗生素。社区获得性感染的原发病不同,其感染病原菌可能不同,因此选用的方案也会不同。①严重COPD并发肺炎的患者(病原菌可能为肺炎球菌),首选左氧氟沙星(750mg,静脉滴注,每日1次)或莫西沙星(400mg,静脉滴注,每日1次);备选:头孢曲松(1g,静脉滴注,每日1次)+阿奇霉素(500mg,静脉滴注,每日1次),或厄他培南(1g,静脉滴注,每日1次)+阿奇霉素(500mg,静脉滴注,每日1次)。研究表明,大环内酯加β-内酰胺类的经验性治疗可降低肺炎球菌菌血症的病死率,在危重肺炎球菌菌血症中进行的前瞻性研究也得出类似结果[27]。发生休克的患者可从联合治疗中获益[28]。②社区获得性肺炎入住ICU的重症患者(病原菌可能为肺炎球菌或金黄色葡萄球菌),首选方案为万古霉素(1g,静脉滴注,每日12h一次)+左氧氟沙星(750mg,静脉滴注,每日1次)或加用莫西沙星(400mg,静脉滴注,每日1次)。备选:利奈唑胺(600mg,静脉滴注,每日2次)+左氧氟沙星或莫西沙星,这种经验性治疗可覆盖MRSA,降低病死率[29]。③怀疑有革兰阴性杆菌感染,如铜绿假单胞菌和感染性休克、脓毒症患者,抗感染方案应覆盖铜绿假单胞菌,如亚胺培南/西司他丁、美罗培南、氨曲南、哌拉西林/他唑巴坦、头孢吡肟或呼吸喹诺酮类[29]。
为评估联合用药的疗效,Kumar等[30]对收集到的相关文献进行Meta分析和Meta回归分析,结果显示,联合用药方案很快改善了患者临床症状,明显增加了细菌清除率,患者生存率也明显提高。
2.2 继发的院内获得性感染及其治疗
2.2.1 细菌学特征和治疗原则 ARDS继发医院获得性感染的病原体复杂多变,主要病原菌是耐药革兰阴性杆菌,同时,耐药革兰阳性菌也有增多的趋势。对各类耐药菌的定义,学术界至今仍未达成共识。多数学者认同以下耐药菌的界定标准:①多重耐药(MDR)是指细菌对常用抗菌药物主要分类中3类及以上的抗菌药物耐药;②广泛耐药(XDR)是指细菌对几乎全部常用抗菌药物耐药,革兰阴性杆菌仅对多黏菌素和替加环素敏感,革兰阳性菌仅对糖肽类和利奈唑胺敏感;③全耐药(PDR)是细菌对所有分类的常用抗菌药物全部耐药,革兰阴性杆菌对多黏菌素和替加环素在内的全部抗菌药耐药,革兰阳性菌对糖肽类和利奈唑胺在内的全部抗菌药耐药[31]。近年来国内外ICU院内感染最常见的耐药菌仍是铜绿假单胞菌、鲍曼不动杆菌、MRSA及VER。不同耐药菌及其耐药的定义有所不同(表1)。
2.2.2 经验性治疗 对于重症医院获得性感染的经验性治疗,文献推荐的方案首选亚胺培南(0.5g,静脉滴注,每6h一次),或多尼培南(500mg,静脉滴注,每8h一次),或美罗培南(1.0g,静脉滴注,每8h一次),怀疑有军团菌感染时加用呼吸氟喹诺酮类(左氧氟沙星或者莫西沙星)[32]。备选:如怀疑铜绿假单胞菌感染,可加用两种抗铜绿假单胞菌抗生素,以保证其中至少一种覆盖该菌,如亚胺培南或头孢吡肟或哌拉西林/他唑巴坦+环丙沙星或妥布霉素[33]。疑为耐药的革兰阳性球菌感染时,应加用糖肽类抗生素。
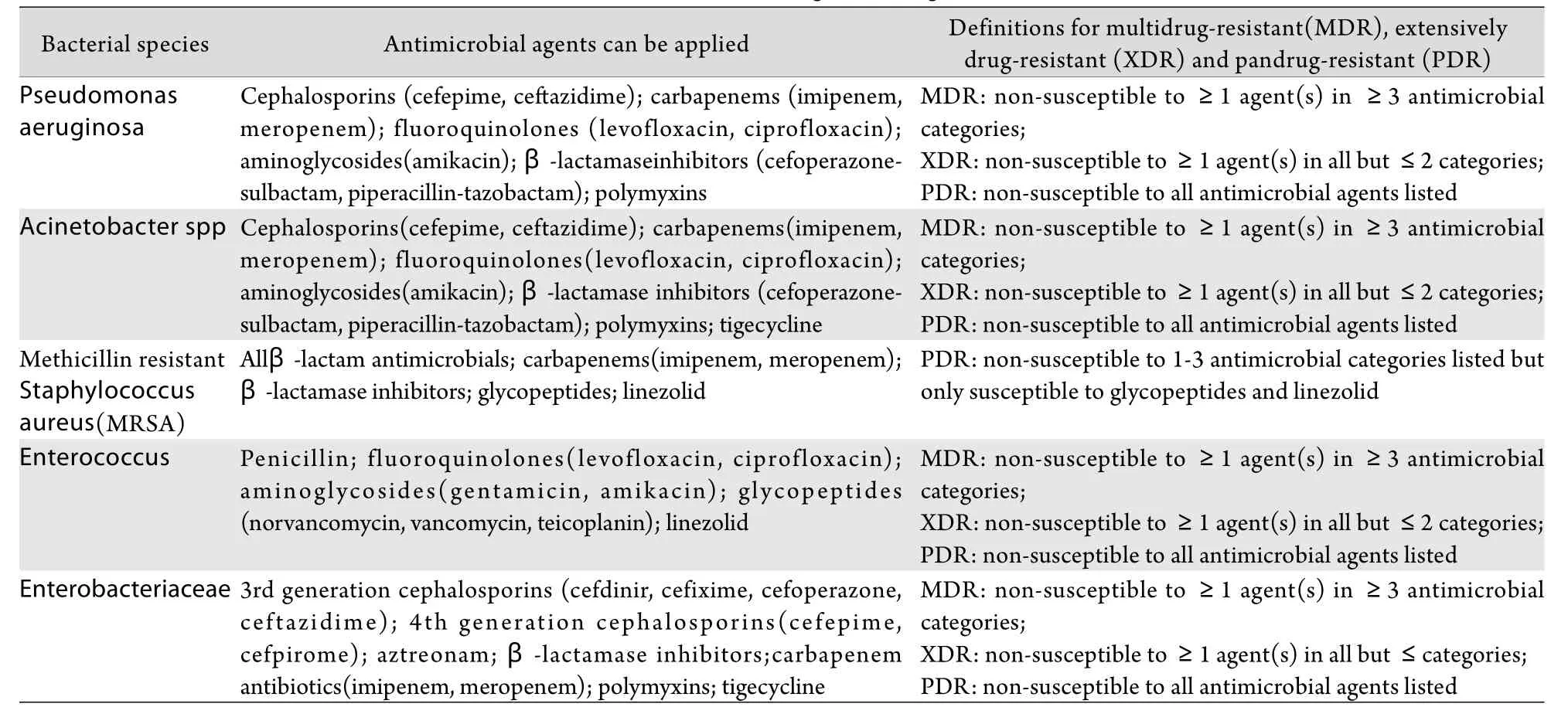
表1 不同细菌的耐药定义Tab.1 Definitions of resistance against drugs of varied bacteria
2.2.3 目标治疗 ARDS患者予以机械通气后最常见的并发症是VAP,且大多是耐药菌株感染。对于VAP的目标治疗,目前推荐的方案如下:①多耐药的铜绿假单胞菌:氨曲南、头孢他啶、多黏菌素E、美罗培南+氨基糖苷类[34];②多耐药的鲍曼不动杆菌:美罗培南+舒巴坦,或氟喹诺酮类+氨基糖苷类,或亚胺培南/西司他丁+氨基糖苷类或利福平,或多黏菌素+利福平[35-36];③MRSA:首选万古霉素、利奈唑胺,备选药物有替考拉宁、达托霉素、奥利万星、特拉万星和甘氨酰环素[37-40]。对MRSA所致的VAP,许多临床研究及Meta分析提示利奈唑胺疗效肯定[39,41-45]。④VRE:首选利奈唑胺、替考拉宁、达托霉素;备选药物:奎奴普丁-达福普汀、甘氨酰环素及奥利万星[38-39]。⑤肺炎克雷白杆菌:若对头孢他啶和其他三代头孢菌素、氨曲南耐药,可选用亚胺培南、美罗培南,对碳青霉烯类、二代及三代头孢耐药,则选用多黏菌素E[46-47]。另外,对耐药菌所致的VAP,加用雾化吸入抗生素辅助治疗可增加药物在肺部的浓度,从而增强抗感染疗效[41-42]。
3 ARDS抗感染治疗的优化策略
针对感染与ARDS的关系,在ARDS的综合治疗中,临床医师应高度关注抗感染治疗。但一直以来ARDS的抗感染策略并未像机械通气策略一样得到足够重视,临床只能参考脓毒症及重症医院获受性肺炎的治疗策略。由于与ARDS相关的感染多是重症感染,因此以下策略也适用于ARDS抗感染治疗。
3.1 起始及时、重拳出击、广谱联合应用抗生素的治疗策略 该策略具有明确的针对性,即对脓毒症、脓毒症休克和重症HAP患者立即进行抗生素的输注是最重要的抢救治疗措施[43-44]。但要注意,最初联合使用广谱抗生素时必须覆盖可能的病原体。临床上该策略主要适用于老年患者、高APACHⅡ评分、重症肺炎、脓毒症和机械通气患者,因而对ARDS患者也适用。
3.2 抗感染治疗的疗效评价策略 抗感染治疗方案启动后,应依据患者的临床反应和辅助检查结果评估抗生素的疗效及其使用的合理性[45-48]。抗生素的疗效包括微生物疗效和临床疗效。临床疗效的指标如下:①临床症状:发热、咳嗽、咳痰等;②体征:肺实变体征及肺部干湿啰音;③实验室检查,如血常规;④胸部X线片结果[48]。抗感染治疗无效表现为病情持续恶化,或治疗反应缓慢、疗效不显著且超过预期治疗时间,或病情一度好转但72h后出现恶化。抗生素治疗失败的常见原因包括抗菌谱未完全覆盖致病菌、抗生素局部药物浓度低、致病菌耐药以及二重感染等。由于呼吸道标本病原学诊断准确性差,而血液病原学结果需要3~5d,在无病原学诊断的情况下调整抗感染方案存在一定困难,此时应对病情和可能的病原体进行重新评估,并根据评估结果制订新的治疗方案。制订新方案时应注意以下几点:①对重症感染的治疗尽可能一步到位,而不要逐步升级;②在原方案无明显不合理情况下,更改治疗方案一般在72h之后;③保持联合用药的完整性。更改抗感染治疗方案时,要从全局考虑,保证新方案能覆盖可能的病原体[45]。
3.3 明确病原学诊断后的降阶梯治疗(De-escalation therapy)策略 降阶梯治疗,即对脓毒症、重症肺炎、VAP患者在最初的经验性广谱抗生素冲击治疗后,依据病原学检查及药物敏感试验结果选用相对窄谱、针对性强的抗生素继续治疗,目的是达到最佳治疗效果、减少耐药菌的产生、降低医疗费用[49]。为观察降阶梯治疗的临床疗效,Leone等[16]进行了为期3年的前瞻性研究,结果证实,降阶梯疗法减少了多余广谱抗生素的应用,打破了广谱抗生素过度使用导致VAP的恶性循环,是临床切实可行的治疗策略。
3.4 短疗程治疗策略 短疗程即联合用药最好少于3~5d,通常抗感染疗程7~10d[48]。临床上在广谱联合应用抗生素48~72h后,应依据临床反应及实验室检验结果,初步评估抗生素的有效性。美国感染疾病学会(IDSA)认为应用广谱抗生素<72h不会导致MDR增加,故主张联合用药48~72h[49-50]。关于抗生素应用疗程,最近由美国胸科学会(ATS)和IDSA制订的一项新指南,对脓毒症、VAP的抗感染治疗采用7~10d的短疗程方案(治疗效果差或免疫缺陷患者可延长至15d),这样可减少耐药菌产生,降低医疗费用,且可获得良好治疗效果[51]。文献报道,VAP患者使用抗生素疗程10d与15d对预后无明显影响。所以如果患者对治疗效果差,或有免疫功能下降,疗程可延长至15d[48,52]。
3.5 抗生素循环用药治疗策略 目前,针对耐药菌株不断出现的严重问题,有专家提出抗生素策略性换药,即抗生素循环使用[53]。这一策略可减少同一品种长时间使用导致的耐药菌产生。在医院的耐药菌高发病区如ICU,应及时监测细菌耐药情况,并及时停用耐药的抗生素,更换有效的抗生素,以尽快改善患者预后和控制耐药菌传播。
4 ARDS抗感染治疗中存在的问题
不管是重症肺部感染、重症胰腺炎[54]、脓毒症、脓毒症休克诱发的ARDS,还是ARDS治疗过程中并发的VAP、感染性休克等,抗感染治疗均刻不容缓。但一直以来在ARDS的综合治疗中,抗感染治疗并未引起足够重视,主要表现在以下两方面:①缺乏相关的随机对照试验(RCT)研究,循证医学证据不足;②抗感染治疗策略和(或)专家共识并未明确,治疗方面只能参考其他的感染相关指南。这可能是今后在ARDS临床研究中需要关注的问题。
[1]Diaz JV, Brower R, Calfee CS, et al. Therapeutic strategies for severe acute lung injury[J]. Crit Care Med, 2010, 38(8): 1644-1650.
[2]Combes A,Bacchetta M, Brodie D, et al. Extracorporeal membrane oxygenation for respiratory failure in adults[J]. Curr Opin Crit Care, 2012, 18(1): 99-104.
[3]Ge QG, Zhao JJ, Lv JQ, et al. Analysis of risk factors in prognosis of acute respiratory distress syndrome in intensive care units[J].Med J Chin PLA, 2010, 35(6): 722-725. [葛庆岗, 赵建娟, 吕旌乔, 等. 重症监护病房中急性呼吸窘迫综合征的预后危险因素分析[J]. 解放军医学杂志, 2010, 35(6): 722-725.]
[4]Shuai WZ, Li Q, Wang CZ, et al. Analysis on prognostic indicators of acute respiratory distress syndrome:a report of 71 cases[J]. Med J Chin PLA, 2009, 34(4): 377-380.[帅维正, 李琦, 王长征, 等. 71例急性呼吸窘迫综合征的预后指标分析[J]. 解放军医学杂志, 2009, 34(4): 377-380.]
[5]Qian GS. Recent progress in research on the diagnosis and treatment of acute lung injury and acute respiratory distress syndrome[J].Med J Chin PLA, 2009, 34(4): 371-373. [钱桂生.急性肺损伤和急性呼吸窘迫综合征的诊断与治疗[J]. 解放军医学杂志, 2009, 34(4): 371-373.]
[6]Marik PE. Pulmonary aspiration syndromes [J]. Curr Opin Pulm Med, 2011, 17(3): 148-154.
[7]Hofmanna A, Farmer S, Towler SC. Strategies to preempt and reduce the use of blood products: an Australian perspective[J].Curr Opin Anesthesiol, 2012, 25(1):66-73.
[8]Qian GS, Wang CZ, Wu GM, et al. Advancement and prospection of respiratory medicine[J]. J Med Chin PLA, 2006 ,31(9) :927-929. [钱桂生, 王长征, 吴国明, 等. 呼吸病学进展与展望[J].解放军医学杂志, 2006, 31(9): 927-929.]
[9]Rocco Jr RH, Harrington D, Buczko GA, et al. 9-Year, singleinstitution, retrospective review of death rate and prognostic factors in adult respiratory distress syndrome[J]. Ann Surg,2001, 233(3): 414-422.
[10]Ibrahim EH, Sherman G, Ward S, et al. The influence of inadequate antimicrobial treatment of bloodstream infections on patient outcomes in the ICU setting[J]. Chest, 2000, 118(1):146-155.
[11]Nahm NJ, Como JJ, Wilber JH, et al. Early appropriate care:definitive stabilization of femoral fractures within 24 hours of injury is safe in most patients with multiple injuries[J]. J Trauma, 2011, 71(1): 175-185.
[12]Villar J, Blanco J, Kacmarek RM, et al. Acute respiratory distress syndrome definition: do we need a change[J]? Curr Opin Crit Care, 2011, 17(1): 13-17.
[13]Yan ZQ, Shen DX, Luo YP, et al. Multiplex PCR to detect multidrug-resistant Acinetobacter baumannii isolated from nosocomial infections [J]. J Clin Lab Sci, 2008, 26(6): 422-424.[闰中强, 沈定霞, 罗燕萍, 等. 多重PCR方法检测多耐药鲍曼不动杆菌基因型[J]. 临床检验杂志, 2008, 26(6): 422-424.]
[14]Shan MJ. Analysis of drug resistance of Acinetobacter baumannii in lower respiratory tract of the elderly[J]. Shanghai J Prev Med,2011, 23(1): 38-39. [单敏娟. 老年患者下呼吸道鲍曼不动杆菌的耐药性分析[J]. 上海预防医学, 2011, 23(1): 38-39.]
[15]Ostendorf U, Ewig S, Torres A. Nosocomial pneumonia[J]. Curr Opin Infect Dis, 2006,19(4): 327-338.
[16]Leone M, Garcin F, Bouvenot J, et al. Ventilator-associated pneumonia: breaking the vicious circle of antibiotic overuse[J].Crit Care Med, 2007, 35(2): 379-385.
[17]Lisboa T, Craven DE, Rello J. Safety in critical care and pulmonary medicine should ventilator-associated pneumonia be a quality indicator for patient safety[J]. Clin Pulm Med, 2008,16(1): 28-32.
[18]Vidaur L. Resolution of VAP[J]. Clin Pulm Med, 2009, 16(4):189-193.
[19]Warren ML, Ruppert SD. Management of a patient with severe sepsis [J]. Crit Care Nurs Q, 2012, 35(2): 134-143.
[20]Munoz P, Cercenado E, Giannella M, et al. Rapid detection of microorganism resistance in patients with ventilator-associated pneumonia[J]. Clin Pulm Med, 2009, 16(6): 302-308.
[21]Bassi GL, Torres A. Ventilator-associated pneumonia: role of positioning [J]. Curr Opin Crit Care, 2011, 17(1): 57-63.
[22]Mosier MJ, Pham TN. American burn association practice guidelines for prevention, diagnosis, and treatment of ventilatorassociated pneumonia (VAP) in burn patients[J]. J Burn Care Res, 2009, 30(6): 910-928.
[23]Rachmale S, Li G, Gajic O. Prevention of acute respiratory distress syndrome[J]. Clin Pulm Med, 2011, 18(6): 300-304.
[24]Ferrer R, Bauer T, Torres A. Acute respiratory distress syndrome and pulmonary infection[J]. Clin Pulm Med, 2002, 9(5): 253-259.
[25]Goff DA. Antimicrobial stewardship: bridging the gap between quality care and cost[J]. Curr Opin Infect Dis, 2011, 24(1):S11-S20.
[26]Luyt CE, Combes C, Nieszkowska A, et al. Aerosolized antibiotics to treat ventilator-associated pneumonia[J]. Curr Opin Infect Dis, 2009, 22(2): 154-158.
[27]Baddour LM, Yu VL, Klugman KP, et al. Combination antibiotic therapy lowe mortality among severely Ill patients with pneumococcal bacteremia[J]. Am J Respir Crit Care Med, 2004,170(15): 440-444.
[28]Rodríguez A, Mendia A, Sirvent JM, et al. Combination antibiotic therapy improves survival in patients with communityacquired pneumonia and shock[J]. Crit Care Med, 2007, 35(6):1493-1498.
[29]Schramm GE, Johnson JA, Doherty JA, et al. Methicillin-resistant Staphylococcus aureus sterile-site infection:The importance of appropriate initial antimicrobial treatment[J]. Crit Care Med,2006, 34(8): 2069-2074.
[30]Kumar A, Safdar N, Kethireddy S, et al. A survival benefit of combination antibiotic therapy for serious infections associated with sepsis and septic shock is contingent only on the risk of death:a meta-analytic/meta-regressionstudy[J]. CritCareMed,2010, 38(8): 1651-1664.
[31]Qiu HB. Critical medicine of 2012[M]. Beijing: People's Publishing Press, 2012. 248-250. [邱海波. 重症医学2012. 第1版[M]. 北京: 人民卫生出版社, 2012. 248-250.]
[32]Lesho E, Wortmann G, Moran K, et al. Fatal Acinetobacter baumannii infection with discordant carbapenem susceptibility[J]. Clin Infect Dis, 2005, 41(5): 758-759.
[33]Garnacho-Montero J, Sa-Borges M, Sole-Violan J, et al. Optimal management therapy for Pseudomonas aeruginosa ventilatorassociated pneumonia: an observational,multicenter study comparing monotherapy with combination antibaoticthrapy[J].Crit Care Med, 2007, 35(8): 1888-1895.
[34]King A, Shannon K, Phillips I. Resistance to imipenem in Pseudomonas aeruginosa[J]. J Antimicrob Chemother, 1995,36(6): 1037-1041.
[35]Rodríguez A, Mendia A, Sirvent JM, et al. Colistin and rifampicin in the treatment of multidrug-resistant Acinetobacter baumannii infections[J]. J Antimicrob Chemother, 2008, 61(2): 417-420.
[36]Ko WC, Lee HC, Chiang SR, et al. In vitro and in vivo activity of meropenem and sulbactam against a multidrug-resistant Acinetobacter baumannii strain[J]. J Antimicrob Chemother,2004, 53(2): 393-395.
[37]Rigo M, Soy D, Guerrero L, et al. Efficacy of linezolid compared to vancomycin in an experimental model of pneumonia induced by methicillin-resistant Staphylococcus aureus in ventilated pigs[J]. Crit Care Med, 2012, 40(1): 162-168.
[38]Gupta M, Durand ML, Sobrin L. Vancomycin resistance in ocular infections[J]. Inter Ophth Clin, 2011, 51(4): 167-181.
[39]Van SJ, Paterson DL. New gram-positive antibiotics: better than vancomycin[J]? Curr Opin Infect Dis, 2011, 24(6): 515-520.
[40]Lanoix JP, Schmit JL, Douadi Y. Bacterial lung sepsis in patients with febrile neutropenia[J]. Curr Opin Pulm Med, 2012, 18(3):175-180.
[41]Ioannidou E, Siempos I, Falagas ME. Administration of antimicrobials via the respiratory tract for the treatment of patients with nosocomial pneumonia: a meta-analysis[J]. J Antimicrob Chemother, 2007, 60(6): 1216-1226.
[42]Dhand R. Inhalation therapy in invasive and noninvasive mechanical ventilation[J]. Curr Opin Crit Care, 2007, 13(1):27-38.
[43]Robinson BR, Athota KP, Branson RD. Inhalational therapies for the ICU[J]. Curr Opin Crit Care, 2009, 15(1): 1-9.
[44]Diaz E, Munoz KA, Agbaht K, et al. Management of ventilatorassociated pneumonia caused by multiresistant bacteria[J]. Curr Opin Crit Care, 2007, 13(1): 45-50.
[45]Yang K, Wang XF. Critical pneumonia[M]//Huang SG, Zhou X. Respiratory and Critical Care Medicine. Beijing: People's Medical Publishing Press, 2011. 255-259. [杨昆, 王晓斐. 重症肺炎[M]//黄绍光, 周新. 呼吸危重病学. 北京:人民卫生出版社, 2011. 255-259.]
[46]Paterson DL, Ko WC, Von Gottberg A, et al. Antibiotic therapy for Klebsiella pneumoniae bacteremia: implications of production of extended-spectrum beta-lactamases[J]. Clin Infect Dis, 2004,39(1): 31-37.
[47]Woodford N, Tierno PM Jr, Young K, et al. Outbreak of Klebsiella pneumoniae producing a new carbapenem-hydrolyzing class a beta-lactamase, KPC-3, in a New York medical center[J].Antimicrob Agents Chemother, 2004, 48(12): 4793-4799.
[48]Dellinger RP, Levy MM, Carlet JM, et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2008[J]. Crit Care Med, 2008, 36(1):296-327.
[49]Morrow LE, Kollef MH. Recognition and prevention of nosocomial pneumonia in the intensive care unit and infection control in mechanical ventilation[J]. Crit Care Med, 2010,38(8): 352–362.
[50]Berenholtz SM, Pronovost Team. Developing quality measures for sepsis care in the ICU[J]. J Comm J Qual Patient Saf, 2007,33(9): 559-568.
[51]Chua Tde J, File TM Jr. Ventilator-associated pneumonia:gearing towards shorter-course therapy[J]. Curr Opin Infect Dis,2006, 19(2): 185-188.
[52]Wlodaver CG, May C. Antibiotic stewardship using clinical guidelines to control antibiotic overuse and deter microbial adaptation[J]. Infect Dis Clin Pract, 2011, 20(1): 12-17.
[53]Paterson DL. Restrictive antibiotic policies are appropriate in intensive care units[J]. Crit Care Med, 2003, 31(1): 25-28.
[54]Dong YB, Cao YQ, Guo QF, et al. Experience of airway management in patients with critical acute panreatitis accompanied with acute respiratory stress syndrome[J]. J Zhengzhou Univ (Med Sci), 2008, 43(5): 1072-1073. [屈清荣, 马继红. 重症急性胰腺炎并发急性呼吸窘迫综合征32例呼吸道管理体会[J]. 郑州大学学报(医学版), 2008, 43(5):1072-1073.]
