不同浓度胡桃醌对HeLa细胞增殖及凋亡的影响
2013-11-02张巍赵行宇李妍徐俊杰姜艳霞吕士杰
张巍, 赵行宇,李妍,徐俊杰,姜艳霞,吕士杰
核桃楸是具有治疗作用的稀有树木类物种之一,在亚洲和欧洲,其叶、根及种子是治疗癌症的传统药物[1]。胡桃醌(juglone)又名5-羟基-1, 4-萘醌,是一种天然环状醌类,可从胡桃楸的叶及外壳中提取。研究发现胡桃醌在体外具有抗多种肿瘤细胞(包括人结肠癌细胞和人淋巴瘤细胞)的活性[2-3]。本研究对不同浓度胡桃醌在人宫颈癌HeLa细胞系的生长和诱导细胞凋亡中的作用进行观察,并探讨其可能机制。
1 材料与方法
1.1 主要材料 胡桃醌、MTT、二甲基亚砜(DMSO)、碘化丙啶(PI)购自Sigma公司,Caspase-3分光光度法检测试剂盒购自南京凯基公司。
1.2 细胞培养及形态学观察 人宫颈癌HeLa细胞系由本院实验室保存。细胞置于RPMI 1640完全培养基中,在37℃、5%CO2、95%湿度培养箱中培养。细胞单层贴壁生长,每2d更换1次培养基,每周按1:3传代。于倒置显微镜(日本Olympus)下观察不同浓度胡桃醌对HeLa细胞生长速度、细胞形态以及悬浮细胞比例的影响。
1.3 MTT法检测细胞增殖情况 取对数生长期HeLa细胞,培养24h后,去上清,将细胞分成正常对照组及10、20、50、100、200μmol/L浓度实验组。各组均采用DMEM培养基稀释液培养24h,加入20μl MTT(5mg/ml),37℃继续孵育4h,弃上清,加入150μl DMSO振荡10min,于570nm处测定吸光度(A)值。
1.4 流式细胞仪检测细胞生长周期 取对数生长期HeLa细胞,培养24h后去上清,分别加入10、20、50、100、200μmol/L胡桃醌,采用DMEM培养基稀释液分别培养24h后,与空白对照组一起进行胰酶消化,PBS洗涤细胞2次,15 000r/min离心10min(离心半径10cm),弃上清,4℃ 70%乙醇沉淀,PI避光染色30min,COUTLER流式细胞仪检测,Listmode 2.0软件分析细胞周期分布。
1.5 细胞Caspase-3活性检测 各组取50μl含100~200μg蛋白的细胞或组织,采用细胞裂解液裂解,取上清加入50μl 2×Reaction Buffer,再加入5μl Caspase-3底物,37℃避光孵育4h。采用酶标仪或分光光度计于405nm或400nm波长处测定其吸光度(A)值。
2 结 果
2.1 不同浓度胡桃醌对HeLa细胞形态学的影响不同浓度胡桃醌对HeLa细胞形态学的影响见图1。对照组细胞紧贴瓶底,生长密集,细胞间连接紧密,呈有规则的多边形,细胞触角较短,圆形细胞少。经10、20、50、100、200μmol/L浓度胡桃醌处理后,细胞附壁疏松,脱壁,形态变圆,且上述改变随浓度增加更明显。
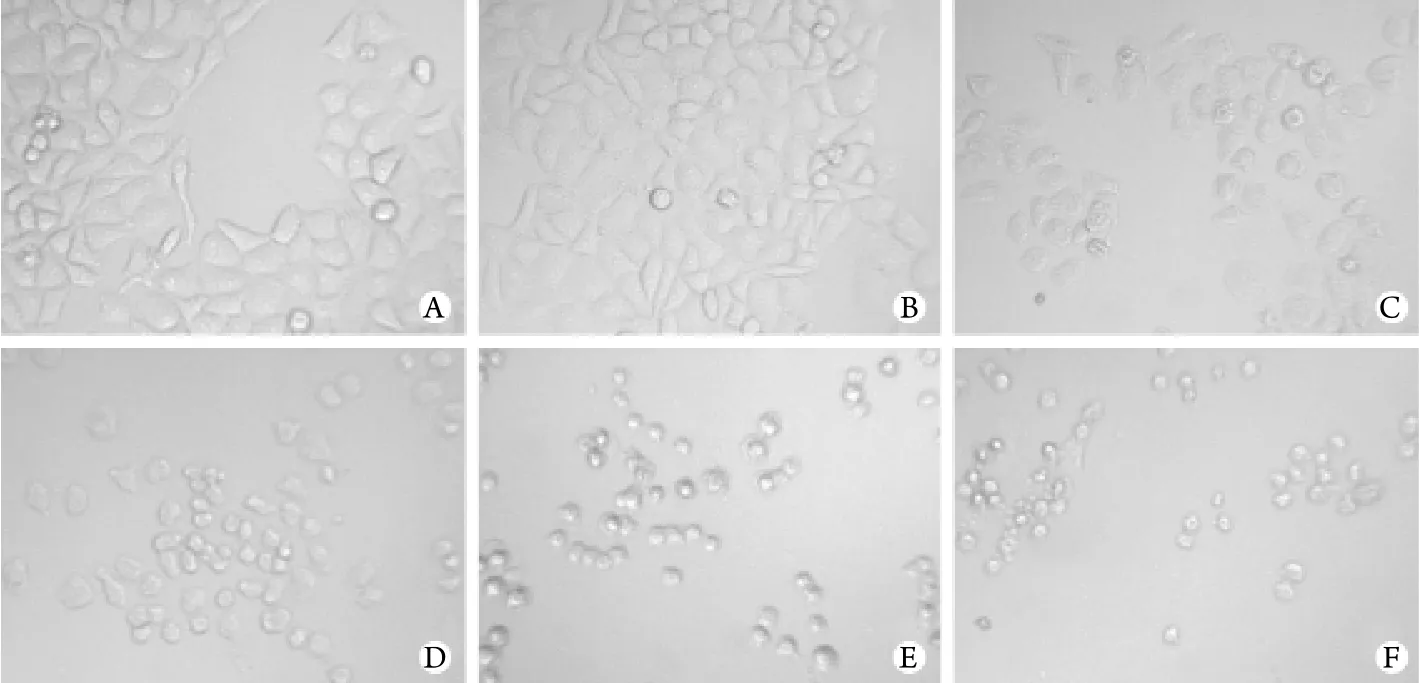
图1 不同浓度胡桃醌对HeLa细胞形态学的影响(×400)Fig.1 Effect of different concentrations of juglone on HeLa cell morphology (×400)
2.2 胡桃醌对HeLa细胞增殖的影响 不同浓度胡桃醌作用于HeLa细胞后,细胞生长受到不同程度抑制,与对照组比较差异均有统计学意义(P<0.05或P<0.01),且该抑制作用呈剂量依赖关系,随着药物浓度增加,抑制率升高(图2)。
2.3 不同浓度胡桃醌对HeLa细胞周期的影响 正常生长的HeLa细胞G2/M期比例为7.50%。经10、20、50、100、200μmol/L胡桃醌处理24h后,G2/M期细胞比例分别增加至12.92%、16.23%、23.64%、34.22%、52.64%(图3)。
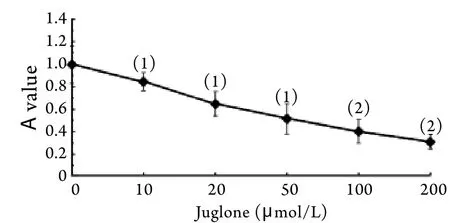
图2 不同浓度胡桃醌对HeLa细胞增殖的影响Fig.2 Effect of different concentrations of juglone on Hela cell proliferation

图3 不同浓度胡桃醌对HeLa细胞周期的影响Fig.3 Effect of different concentrations of juglone on HeLa cell cycle
2.4 不同浓度胡桃醌对HeLa细胞Capase-3活性的影响 不同浓度胡桃醌作用HeLa细胞24h后,Caspase-3活性显著增加,且存在剂量依赖关系(图4)。
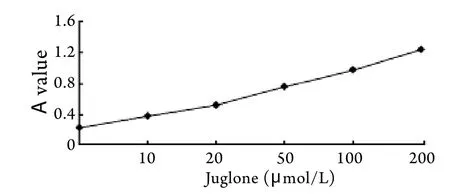
图4 不同浓度胡桃醌对HeLa细胞Caspase-3活性的影响Fig.4 Effect of different concentrations of juglone on the activity of Caspase-3
3 讨 论
Pin1与肿瘤细胞的分化和增殖有关,是肿瘤细胞中高表达的基因之一[4-5]。胡桃醌的抗肿瘤作用在国内外均有报道,Chao等[6]及Paulsen等[7]认为其能与Pin1催化域发生不可逆结合,从而抑制Pin1的活性。
Caspase家族在细胞凋亡过程中起着非常重要的作用,其中Caspase-3为关键的执行分子,在凋亡信号传导的许多途径中发挥功能。正常情况下Caspase-3以酶原(32kD)形式存在于胞质中,在凋亡的早期阶段被激活,活化的Caspase-3由两个大亚基(17kD)和两个小亚基(12kD)组成,裂解相应的胞质胞核底物,最终导致细胞凋亡。在细胞凋亡晚期及死亡细胞中,Caspase-3活性明显下降[8-11]。
本研究形态学观察发现,不同浓度的胡桃醌均能使HeLa细胞形态发生变化,且MTT检测显示,不同浓度的胡桃醌均可明显抑制HeLa细胞的增殖。进一步对其凋亡情况进行检测,结果显示不同浓度胡桃醌均可将HeLa细胞周期阻滞于G2/M期,而Caspase-3活性检测显示胡桃醌可使Caspase-3活性增加,且具有剂量依赖性。
总之,本研究结果显示,胡桃醌能诱导宫颈癌细胞凋亡,有望成为继传统化疗药物之后的又一新型化疗药物,为抗肿瘤治疗提供新的途径。
[1]Inbaraj JJ, Chignell CF. Cytotoxic action of juglone and plumbagin: amechanistic study using HaCaT keratinocytes[J].Chem Res Toxicol, 2004, 17(1): 55-62.
[2]Paulsen MT, Ljungman M. The natural toxin juglone causes degradation of p53 and induces rapid H2AX phosphorylation and cell death in human fibroblasts[J]. Toxicol Appl Pharmacol,2005, 209(1): 1-9.
[3]Segura-Aguilar J, Jonsson K, Tidefelt U, et al. The cytotoxic effects of 5-OH-1,4-naphthoquinone and, 8-diOH-1,4-naphthoquinone on doxorubicinresistant human leukemia cells(HL-60)[J]. Leuk Res, 1992, 16(6/7): 631-637.
[4]Zhang CJ, Zhang ZH, Xu BL, et al. Recent advances in the study of Pin1 and its inhibitors[J]. Acta Pharmacol Sin, 2008, 43(1):9-17.
[5]Gu B, Ji QC, Zhao FZ, et al. Expressions of Pin1 and mTOR in esophageal squamous cell carcinoma tissue[J]. J Zhengzhou Univ (Med Sci), 2012, 47(2): 150-152. [谷博, 吉庆春, 赵富周,等. 食管鳞状细胞癌组织中Pin1 和mTOR蛋白的表达[J]. 郑州大学学报(医学版), 2012, 47(2): 150-152. ]
[6]Chao SH, Greenleaf AL, Price DH. Juglone, an inhibitor of the peptidyl-prolyl isomerase Pin1, also directly blocks transcription[J]. Nucleic Acids Res, 2001, 29(3): 767-773.
[7]Paulsen MT, Ljungman M. The natural toxin juglone causes degradation of p53 and induces rapid H2AX phospho-rylation and cell death in human fibroblasts[J]. Toxicol Appl Pharmacol,2005, 209(1): 1-9.
[8]Thornberry NA. Caspases: key mediators of apoptosis[J]. Chem Biol, 1998, 5(5): R97-R103.
[9]Zhao YH, Chen QH, Hua HY, et al. Effect of lithium chloride on proliferation, apoptosis and mRNA expressions of Fas and Caspase-3 in human osteosarcoma U2-OS cell[J]. J Zhengzhou Univ (Med Sci), 2012, 47(4): 502-505. [赵意华, 陈清汉, 华海婴, 等. 氯化锂对人骨肉瘤细胞U2-OS增殖、凋亡及Fas、Caspase-3 mRNA表达的影响[J]. 郑州大学学报(医学版),2012, 47(4): 502-505.]
[10]Zhan YP, Qin J, Sun SL. Effects of memantine on expression of Caspase-3 and MDA in rats afterischemia-reperfusion[J]. J Zhengzhou Univ (Med Sci), 2011, 46(5): 748-751. [赵彦坡, 秦洁, 孙石磊. 美金刚对大鼠脑缺血再灌注后Caspase-3 表达及丙二醛含量的影响[J]. 郑州大学学报(医学版), 2011, 46(5):748-751.]
[11]Jia QH, Yang XP, Hui L, et al. Effect of lead acetate on apoptosis of human renal mesangial cells and caspase-3 expression[J]. Med J Chin PLA, 2012, 37(6): 628-631. [贾庆华, 杨霄鹏, 惠玲, 等.醋酸铅对人肾小球系膜细胞凋亡及Caspase-3表达的影响[J]. 解放军医学杂志, 2012, 37(6): 628-631.]
