糖尿病大鼠心肌缺血预处理作用减弱与NO-cGMP信号通路抑制的关系
2013-11-05韩宏光王辉山韩劲松汪曾炜尹宗涛
韩宏光,王辉山,韩劲松,汪曾炜,尹宗涛
缺血预适应(IPC)是指经历了短暂性缺血后的心肌会对随后发生的持续的、更为严重的缺血产生保护作用,目前被认为是最有效的一种心肌保护方式[1]。IPC对心肌的保护作用目前普遍认为与信号传导机制有关,但确切机制尚待进一步深入研究。既往关于IPC的研究多数限于健康心肌,而对糖尿病心肌的研究较少。有研究表明,一氧化氮(NO)参与了急性期IPC[2]。本研究在既往血糖正常大鼠研究[3]的基础上,应用大鼠在体缺血再灌注模型,观察糖尿病心肌IPC后NO、环磷酸鸟苷(cGMP)及一氧化氮合酶(NOS)含量的变化,为进一步深入研究IPC信号传导机制寻找理论依据。
1 材料与方法
1.1 实验动物及主要试剂 健康雄性SD大鼠购自沈阳军区总医院,体重260~330g。腹腔注射链佐星(STZ,Sigma公司,60mg/kg)制作糖尿病大鼠模型,2d后测血糖≥11.1mmol/L为造模成功。所有大鼠饲养条件一致,2周后行动物实验。NO、超氧化物歧化酶(SOD)、丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所,cGMP放免分析试剂盒购自上海中医药大学同位素室。
1.2 在体左冠状动脉阻断模型的制备 10%水合氯醛(0.4ml/100g)腹腔注射,麻醉成功后气管插管,呼吸机辅助(呼吸机设定条件:潮气量1.5ml/100g,呼吸频率70~80次/min,吸呼比1:1.5),心电监测。逐层入胸,切开心包、悬吊,显露左冠状动脉,在左冠状动脉下穿线,用聚乙烯小管穿过缝线两端,拉紧小管并固定,制作心肌缺血模型,松开小管即为再灌注模型。左室前壁呈蓝紫色或发绀、心电图提示ST段抬高为缺血模型成功标志。实验动物剔除标准:左室壁颜色、ST段改变不明显以及出血较多者。
1.3 实验分组 取糖尿病与血糖正常大鼠各30只,分别采用随机数字法分为3组,每组10只。假手术(Sham)组:左冠状动脉下穿线后,仅套环但不收紧小管,维持155min;缺血再灌注(I/R)组:左冠状动脉下穿线后平衡35min,收紧小管,维持30min,再松开小管,维持90min;IPC组:左冠状动脉下穿线后平衡35min,收紧小管,维持5min,再松开小管,灌注5min,重复进行3次,持续收紧结扎造成缺血30min,放松后再灌注90min。
1.4 各项指标检测 采用全自动生化分析仪测定各组血清中乳酸脱氢酶(LDH)、肌酸激酶(CK)和肌酸激酶MB同工酶(CK-MB)的含量。取心尖肌0.5g制成10%组织匀浆,采用TBA法测定MDA含量,邻苯三酚自氧化法检测SOD活性,放免法检测cGMP含量,结果以pmol/g表示。采用硝酸还原酶法于波长530nm处测量心肌组织匀浆上清液吸光度(A)值,计算NO和NOS含量,结果用μmol/g prot和U/mg pro表示。
1.5 心肌线粒体Flameng评分 制作心肌组织电镜切片,对线粒体进行Flameng评分[4]。方法:每组随机观察5个视野(每视野中20个线粒体),计算每个视野中线粒体评分的平均数,5个视野的均值即为Flameng评分。
1.6 统计学处理 采用SPSS 11.5软件进行统计分析,数据结果以表示,组间比较采用单因素方差分析(one-way ANOVA),进一步两两比较采用SNK-q法,P<0.05为差异有统计学意义。
2 结 果
2.1 血糖浓度比较 制备的糖尿病大鼠血糖浓度为15.8±4.5mmol/L,非糖尿病大鼠血糖浓度为4.3±1.3mmol/L,两组比较差异有统计学意义(P<0.01)。
2.2 血清CK、CK-MB和LDH含量变化 在非糖尿病大鼠,I/R组及IPC组血清CK、CK-MB、LDH含量均明显高于Sham组(P<0.05),且I/R组明显高于IPC组(P<0.05);在糖尿病大鼠,IPC组及I/R组CK、CK-MB、LDH含量明显高于Sham组(P<0.05),而I/R组与IPC组比较差异无统计学意义(P>0.05,图1)。
2.3 心肌组织MDA、SOD含量比较 在非糖尿病大鼠,IPC组心肌MDA含量与I/R组比较明显降低(P<0.05),SOD含量与I/R组比较明显增高(P<0.05)。而在糖尿病大鼠,两组比较差异无统计学意义(P>0.05,图2)。
2.4 心肌NO、cGMP、NOS含量比较 在非糖尿病大鼠中,与I/R组比较,IPC组心肌NO、cGMP、NOS含量明显增加(P<0.05),而在糖尿病大鼠中,IPC组与I/R组比较差异无统计学意义(P>0.05,图3)。
2.5 线粒体超微结构比较 非糖尿病大鼠IPC组Flameng评分(0.33±0.04)较Sham组(1.50±0.60)和I/R组(1.63±0.15)明显降低(P<0.05);糖尿病大鼠IPC组Flameng评分(1.65±1.33)和I/R组Flameng评分(1.68±0.03)均高于Sham组(0.95±0.02, P<0.05),但IPC组与I/R组比较差异无统计学意义(P>0.05)。Sham组及IPC组线粒体双层膜存在,无明显肿胀,胞核正常。非糖尿病IPC组线粒体中度肿胀,嵴稀疏、紊乱,核膜出现皱褶。糖尿病大鼠I/R组及IPC组线粒体重度肿胀,嵴稀疏、断裂,呈空泡样改变,核膜皱褶明显(图4)。

图1 血清CK、CK-MB和LDH含量比较Fig.1 CK, CK-MB and LDH content in serum
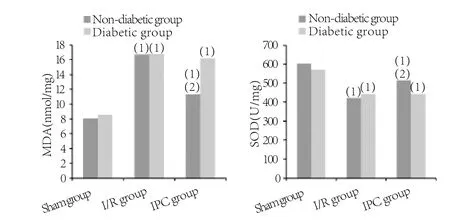
图2 心肌组织MDA、SOD含量比较Fig.2 MDA and SOD content in myocardial tissue
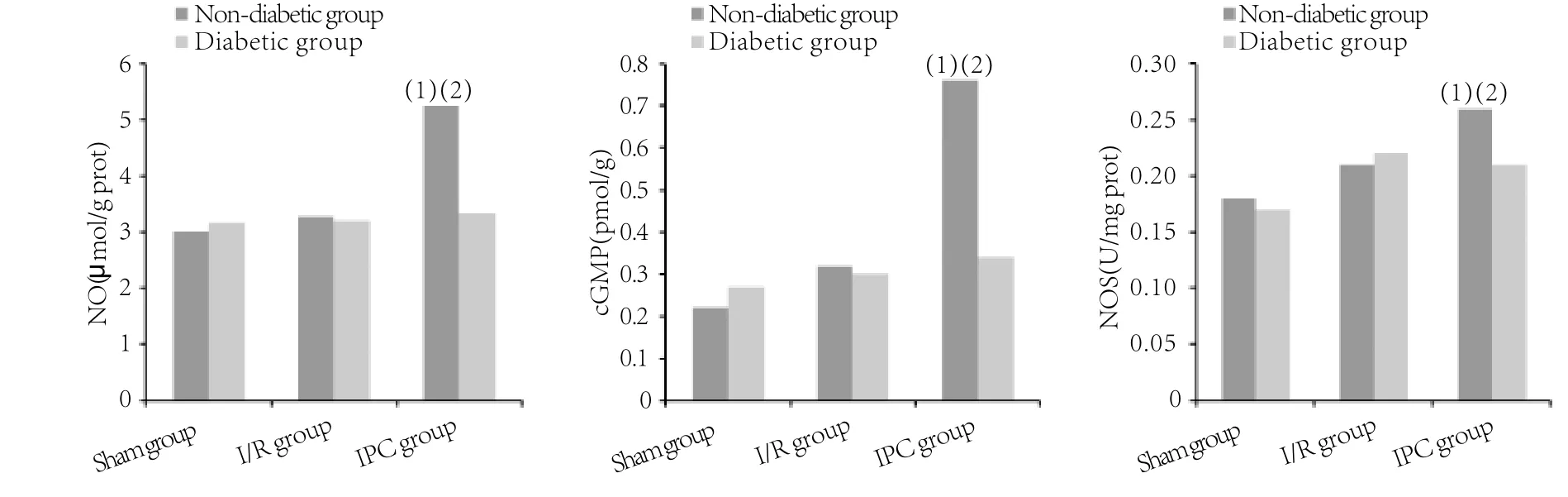
图3 心肌NO、cGMP、NOS含量比较Fig.3 NO, cGMP and NOS content in myocardial tissue
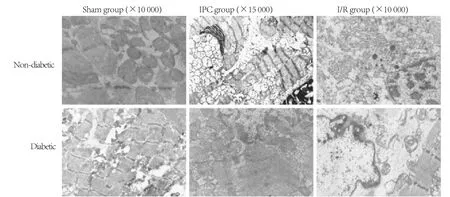
图4 线粒体超微结构比较Fig.4 Comparison of ultra-microstructure of the mitochondria
3 讨 论
目前有关糖尿病对IPC的影响及其机制的研究较少。有研究表明,IPC在糖尿病大鼠心肌的保护作用受抑制可能与心肌胰岛素抵抗有关[5-6],但其机制可能不止一种。本研究通过在体左冠状动脉阻断模型探讨IPC在糖尿病大鼠心肌的保护作用减弱与NO-cGMP信号通路的关系,结果显示,在非糖尿病大鼠中,IPC后心肌组织SOD增加、MDA减少、心肌酶漏出减少,导致NO、cGMP、NOS含量明显增加,而在糖尿病大鼠中,IPC后大鼠心肌酶漏出、MDA、SOD均无明显差异,NO、cGMP、NOS含量亦未见明显增加。Bandyopadhyay等[7]认为,I/R后氧自由基(ROS)生成过多,SOD含量降低,可导致MDA增加,膜脂质过氧化,从而进一步加重心肌细胞损伤。本研究发现IPC组大鼠心肌线粒体的损伤未较I/R组明显减轻。因此,推测IPC在糖尿病大鼠心肌保护作用减弱可能与NO-cGMP信号通路在糖尿病心肌中的表达受到抑制有关。
目前,较为公认的IPC机制是细胞内信号传导途径,一般分为触发物质、中介物质和效应子3个环节[8]。触发物质包括NO、前列腺素、腺苷、缓激肽等,中介物质为蛋白激酶C(PKC),效应子主要为KATP通道。NO产生的反应性氧物质可能是激发产生IPC的信号物质,内源性NO能与SOD竞争,灭活基础状态下产生的超氧自由基[9]。再灌注前予以NO供体,改善心肌收缩性,可缩小心肌梗死范围[10]。Han等[11]研究证实NO-cGMP信号可以激活KATP通道。某些NO供体药物能够增强KATP通道及其开放剂如二氮嗪的活性[12],这一作用是通过可溶性鸟苷酸环化酶的激活使cGMP含量增加,再通过磷酸肌醇反应以及激活cGMP依赖蛋白激酶两条途径激活PKC,导致KATP通道活化而实现的[13]。NO作为一种信号分子可通过cGMP-蛋白激酶途径[14]降低细胞内Ca2+浓度,导致血管平滑肌松弛并阻止血小板聚集[15-16]、中性粒细胞黏附等。
高血糖可使线粒体生成超氧化物增多,后者可与NO发生化学反应生成过氧化氮,从而降低NO的保护作用。高血糖状态还可通过抑制内皮型NOS使NO生成减少。糖尿病时由于糖异生作用加强,葡萄糖摄取和氧化功能发生障碍,细胞内积聚大量甘油三酯和游离脂肪酸等脂滴颗粒,最终导致KATP通道活性降低。
总之,本研究推测IPC对糖尿病大鼠心肌的保护作用受抑制,其机制可能与NO-cGMP信号通路表达在糖尿病心肌中受到抑制有关,进而影响信号传导中相关激酶或辅酶激活因子或KATP通道的活性,使IPC在糖尿病心肌中不能发挥有效的心肌保护作用。当然,糖尿病大鼠和非糖尿病大鼠由于血糖存在的显著差异,也可能对心肌代谢有一定影响,相关研究仍需进一步深入。
[1]Murry CE, Jennings RB, Reimer KA. Preconditioning with ischemia:a delay of lethal cell injury in ischemicmyocardium[J]. Circulation, 1986, 74(5): 1124-1136.
[2]Lochner A, Mantis E, Genade S, et al. Nitric oxide:a trigger for classic preconditioning[J]. Am J Physiol Heart Circ Physiol ,2000, 279(6): H2752-H2765.
[3]Han HG, Wang ZW, Zhang NB, et al. The roles of nitric oxide during early phase of myocardial ischemic preconditioning in rats[J]. Chin Med J, 2008, 121(13): 1210-1214.
[4]Flameng W, Borgers M, Daenen W, et al. Ultrastructual and cytochemical correlates of myocardial protection by cardiac hypothermia in man[J]. J Thorac Cardiovasc Surg, 1980, 79(3):413-424.
[5]Han JS, Yan DM, Zhu HY, et al. Influence of diabetes on the protective effect of ischemic preconditioning on ischemic reper fused rat heart[J]. Med J Chin PLA, 2008, 33(10): 1195-1197. [韩劲松,阎德民, 朱洪玉, 等. 糖尿病对大鼠心肌缺血预处理保护作用的影响[J]. 解放军医学杂志, 2008, 33(10): 1195-1197.]
[6]Han JS, Han HG, Wang HS, et al. Influence of diabetes on myocardial ischemic preconditioning and its mechanism[J].Med J Chin PLA, 2011, 36(5): 463-466. [韩劲松, 韩宏光, 王辉山, 等. 糖尿病对缺血预适应大鼠心肌缺血再灌注的影响及其机制研究[J]. 解放军医学杂志, 2011, 36(5): 463-466.]
[7]Bandyopadhyay D, Chatopadyay A, Ghosh G, et al. Oxidative stress-induced ischemic heart disease:protection by antioxidants[J]. Curr Med Chem, 2004, 11(3): 369-387.
[8]Murphy E. Primary and secondary signaling pathways in early preconditioning that converge on the mitochondria to produce cardioprotection[J]. Circ Res, 2004, 94(1): 7-16.
[9]Jeferey M, Park TS, Giddy JM, et al. Modulation of basal and postischemic leukocyte-endothelial adherence by nitric oxide[J].Stroke, 1998, 29(7): 1423-1430.
[10]Pabla R, Buda AJ, Flynn PM, et al. Intracoronary nitric oxide improves postischemie coronary blood flow and myocardial contractile function[J]. Am J Physiol, 1995, 269(3Pt2): 1113-11 21.
[11]Han J, Kim N, Joo H, et al. ATP-sensitive K(+) channel activation by nitric oxide and protein kinase G in rabbit ventricular myocytes[J]. Am J Physiol Heart Circ Physiol, 2002,283(4): H1545-H1554.
[12]Oldenburg O, Qin Q, Kriegg T, et al. Bradykinin induces mitochondrial ROS generation via NO, cGMP, PKG, and mitoKATP channel opening and leads to cardioprotection[J].Am J Physiol, 2004, 286(1): H468-H476.
[13]Shiono N, Rao V, Weisel RD. L-arginine protects human heart ceils from low-volume anoxia and reoxygenation[J]. Am J Physiol Heart Circ Physiol, 2002, 282(3): H805-H815.
[14]Ruiz-Stewart I, Tiyyagura SR, Lin JE, et al. Guanylyl cyclase is an ATP sensor coupling nitric oxide signaling to cell metabolism[J ].Proc Natl Acad Sci USA, 2004, 101(1): 37-42.
[15]Liu HY, Hu XC, Zhang DY. Relationship between nitric oxide release from pig iliac endothelial cells caused by Exendin-4 and change in intracellular calcium[J]. Med J Chin PLA, 2012,37(9): 859-863. [刘浩宇, 胡小春, 张冬颖, 等. Exendin-4介导的猪髋动脉内皮细胞NO释放与细胞内钙离子浓度变化的关系[J]. 解放军医学杂志, 2012, 37(9): 859-863.]
[16]Xu YX, Zhang RZ, Wang DX, et al. Effects of L-carnitine on the contents of MPO and NO in rats with renal ischemic reperfusion injury[J]. Zhengzhou Univ (Med Sci), 2012, 47(6): 810-813.[许益笑, 张睿, 王德选, 等. 左卡尼汀对肾缺血再灌注损伤大鼠肾组织MPO和NO含量的影响[J]. 郑州大学学报(医学版), 2012, 47(6): 810-813.]
