非那雄胺对糖尿病小鼠肾小球微血管密度及VEGF表达的影响
2013-11-02田河林许忠新韦立顺康艳辉赵如同金东岭
田河林,许忠新,韦立顺,康艳辉,赵如同,金东岭
糖尿病微血管病变是糖尿病的常见并发症,而异常血管新生在糖尿病微血管病变的发生、发展过程中发挥着重要作用[1]。微血管密度(microvessel density,MVD)是反映血管生成的生物指标,CD34在血管内皮细胞呈强阳性表达,是目前检测微血管的可靠标记[2]。非那雄胺是一种5α还原酶抑制剂,临床用于良性前列腺增生症(benign prostate hyperplasia,BPH)的治疗。临床研究发现,非那雄胺可减少前列腺经尿道切除术患者的出血量,缓解BPH血尿症状,该作用可能与其抑制前列腺组织血管内皮生长因子(vascular endothelial growth factor,VEGF)表达、降低MVD有关[3]。动物实验结果显示,非那雄胺可抑制早期糖尿病大鼠视网膜VEGF表达并降低MVD[4]。但有关非那雄胺对糖尿病肾脏MVD及VEGF表达的影响,国内外尚未见报道。本研究采用链脲佐菌素(streptozotocin,STZ)诱导建立糖尿病小鼠模型,应用免疫组化方法观察CD34及VEGF在糖尿病小鼠肾小球的表达,探讨非那雄胺对糖尿病小鼠肾小球MVD的影响,旨在为研究非那雄胺对血管新生的作用及临床应用提供实验依据。
1 材料与方法
1.1 试剂及仪器 链脲佐菌素(Alexis公司);非那雄胺(杭州默沙东制药有限公司);VEGF单抗、CD34单抗、SP检测试剂盒及DAB显色试剂盒(北京中杉金桥生物技术有限公司)。血糖仪及血糖试纸购自艾康生物技术(杭州)有限公司。CX41型显微镜为日本Olympus公司产品。
1.2 实验动物 清洁级昆明种小鼠35只,雄性,体重30~35g,由河北省实验动物中心提供,许可证号SCXK(冀)2008-1-008。适应性饲养2周后开始实验。动物禁食12h后,一次性腹腔注射1%链脲佐菌素溶液(pH4.4柠檬酸缓冲液配制)150mg/kg制备糖尿病模型。60h后,小鼠禁食(不禁水)12h,尾静脉取血测空腹血糖,空腹血糖高于16.7mmol/L为造模成功[5]。将糖尿病模型小鼠按血糖值随机分为4组,即模型组和非那雄胺0.1、1、10mg/kg组,每组7只;另取7只正常小鼠作为对照组。非那雄胺组小鼠每日分别给予非那雄胺0.1、1、10mg/kg灌胃,对照组和模型组小鼠给予等容量生理盐水灌胃,连续4周。
1.3 标本处理 末次给药后,小鼠禁食(不禁水)12h,称空腹体重,测空腹血糖。腹腔注射乌拉坦1g/kg麻醉,摘取肾脏,以10%中性甲醛固定,常规脱水,石蜡包埋,连续4μm切片,行HE染色。CD34及VEGF染色采用免疫组化SP法,操作步骤按SP试剂盒说明书进行。用PBS代替一抗作阴性对照。
1.4 结果观察 取HE染色切片进行肾脏形态学观察,采用组织细胞病理分析软件在400倍视野下测量肾小球面积(Ga),根据文献[6]方法计算肾小球体积(Gv)。Gv=β/k×(Ga)3/2,其中β=1.38(形态系数),k=1.1(大小分布系数)。每张切片随机测定5个不重复肾小球,取其平均值。血管内皮细胞胞质呈棕黄色为CD34染色阳性,单个血管内皮细胞或细胞簇染色阳性判定为一个微血管[3]。在400倍视野下每张切片随机测5个不重复肾小球,取其平均值作为MVD值。细胞质中出现棕黄色颗粒为VEGF表达阳性。按细胞染色强度(a)计分:浅黄色1分,棕黄色2分,棕褐色3分;同时按显色细胞百分比(b)计分:≤30%细胞显色1分,31%~60%细胞显色2分,≥61%细胞显色3分。将2项得分的积作为VEGF表达指数(VEGF index),即VEGF指数=a×b[7]。在400倍视野下观察,每张切片随机取5个肾小球,取其平均值作为VEGF指数值。
1.5 统计学处理 采用SPSS 12.0软件进行数据分析。数据结果均以s表示,组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠体重及血糖水平比较 与治疗前比较,4周后对照组小鼠活动正常,体重增加(P<0.05),空腹血糖值无显著变化(P>0.05),模型组和非那雄胺各剂量组小鼠空腹血糖值明显升高(P<0.01),体重有所下降,但差异无统计学意义(P>0.05)。4周后,与对照组比较,模型组和非那雄胺各剂量组小鼠活动减少,体重显著降低(P<0.01),空腹血糖值明显升高(P<0.01),而与模型组比较,非那雄胺各剂量组小鼠体重和血糖值差异均无统计学意义(P>0.05,表1)。
2.2 各组肾小球组织形态学变化 肾脏病理检查显示,对照组小鼠肾小球、细胞外基质及肾小管未见异常;模型组小鼠肾小球明显增大,肾小球毛细血管数目增多,细胞外基质增多,肾小管上皮细胞水肿,管腔扩张;非那雄胺0.1mg/kg和1mg/kg组小鼠肾脏形态学与模型组比较无明显差异,非那雄胺10mg/kg组小鼠肾脏病变程度略轻于模型组(图1)。组织细胞计量学测定结果显示,模型组及非那雄胺各剂量组小鼠肾小球面积及体积均显著大于对照组(P<0.05,P<0.01);与模型组比较,非那雄胺0.1mg/kg和1mg/kg组肾小球面积及体积差异无统计学意义(P>0.05),但非那雄胺10mg/kg组小鼠肾小球面积及体积显著减小(P<0.01,P<0.05,表2)。
表1 各组体重与血糖变化(s, n=7)Tab. 1 Changes of body weight and blood glucose level in different groups s, n=7)

表1 各组体重与血糖变化(s, n=7)Tab. 1 Changes of body weight and blood glucose level in different groups s, n=7)
(1)P<0.01 compared with control group; (2)P<0.05, (3)P<0.01 compared with 0 week
Group Body weight(g) Blood glucose (mmol/L)0 week 4 week 0 week 4 week Control 37.2±2.7 41.5±2.9(2) 6.6±1.5 7.3±2.2 Diabetic model 36.7±2.6 35.0±2.7(1) 19.6±2.3(1) 27.5±2.5(1)(3)Finasteride 0.1mg/kg 35.9±2.3 34.5±2.7(1) 19.4±2.6(1) 25.6±2.6(1)(3)Finasteride 1.0mg/kg 37.0±2.6 35.2±3.0(1) 20.1±2.8(1) 26.4±2.3(1)(3)Finasteride 10mg/kg 36.5±2.7 34.2±2.6(1) 19.8±2.7(1) 26.7±2.4(1)(3)
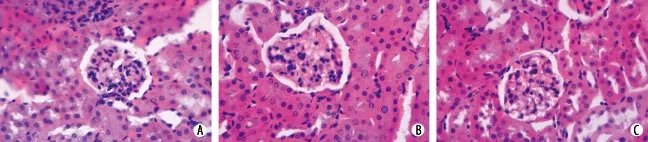
图1 肾小球组织形态学变化(HE ×400)Fig. 1 Histomorphologic changes of glomeruli in mice (HE ×400)
表2 各组肾小球面积和体积变化(s, n=7)Tab. 2 Changes of glomerular area and volume in glomeruli, n=7)

表2 各组肾小球面积和体积变化(s, n=7)Tab. 2 Changes of glomerular area and volume in glomeruli, n=7)
(1)P<0.05, (2)P<0.01 compared with control group; (3)P<0.05,(4)P<0.01 compared with diabetic model group
Glomerular volume(μm3, ×103)Control 2.0±0.6 116.6±52.8 Diabetic model 5.0±1.0(2) 455.9±137.2(2)Finasteride 0.1mg/kg 5.1±0.7(2) 457.1±89.3(2)Finasteride 1.0mg/kg 4.5±0.8(2) 397.7±91.0(2)Finasteride 10mg/kg 3.3±0.9(1)(4) 270.2±104.0(1)(3)Group Glomerular area(μm2, ×103)
2.3 各组肾小球MVD及VEGF表达 免疫组化染色显示,与对照组比较,模型组及非那雄胺各剂量组小鼠肾小球CD34染色明显增强;VEGF染色阳性细胞主要集中在肾小球,与对照组比较,模型组和非那雄胺各剂量组小鼠肾小球VEGF阳性表达明显增强(图2)。模型组和非那雄胺各剂量组小鼠肾小球MVD、VEGF指数均高于对照组(P<0.05或P<0.01);与模型组比较,非那雄胺0.1mg/kg和1mg/kg组小鼠肾小球MVD、VEGF指数差异均无统计学意义(P>0.05),非那雄胺10mg/kg组小鼠肾小球MVD、VEGF指数明显降低(P<0.05,表3)。
表3 肾小球MVD及VEGF表达变化(x±s, n=7)Tab. 3 Changes of MVD and VEGF expression in glomeruli n=7)

表3 肾小球MVD及VEGF表达变化(x±s, n=7)Tab. 3 Changes of MVD and VEGF expression in glomeruli n=7)
(1)P<0.05, (2)P<0.01 compared with control group; (3)P<0.05 compared with diabetic model group
Group MVD VEGF index Control 14.5±2.7 2.3±1.3 Diabetic model 22.6±2.5(2) 6.6±1.6(2)Finasteride 0.1mg/kg 21.2±1.7(2) 6.1±1.1(2)Finasteride 1.0mg/kg 20.8±1.9(2) 5.8±1.2(2)Finasteride 10mg/kg 19.1±2.3(2)(3) 4.5±1.4(1)(3)
3 讨 论
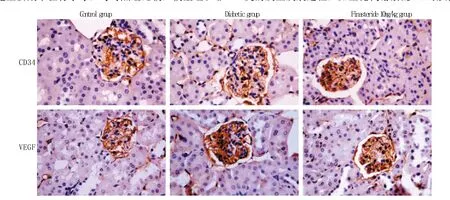
图2 肾小球CD34及VEGF的表达(SP ×400)Fig. 2 Expression of CD34 and VEGF in glomeruli of mice (SP ×400)
目前认为,有多种因素参与了糖尿病微血管病变的发生发展过程,如生化代谢紊乱、血流动力学异常、细胞因子分泌增多等,但糖尿病微血管病变的发病机制尚不完全清楚。糖尿病动物模型的建立为研究糖尿病微血管病变发病机制及药物疗效评价提供了方便。链脲佐菌素对动物胰岛β细胞具有选择性杀伤作用,可特异性作用于胰岛β细胞并破坏其结构,导致胰岛素分泌障碍,诱导糖尿病动物模型形成。本实验采用一次性腹腔注射链脲佐菌素诱导建立糖尿病小鼠模型,成模后小鼠血糖升高,体重减轻,并伴有多食、多饮、多尿症状,病理学检查发现成模小鼠出现了早期肾脏病变,包括肾小球肥大,细胞外基质增多,肾小管上皮细胞水肿,管腔扩张等,与文献[8]报道结果相符。
研究表明,异常血管新生与肾小球肥大、肾间质损害及尿蛋白排泄增多有关,而抑制血管新生则可改善糖尿病肾脏病变[9-11]。本实验免疫组化结果显示,模型组小鼠肾小球CD34表达明显增强,肾小球MVD显著高于对照组;相似研究发现,链脲佐菌素诱导糖尿病小鼠3周时,其肾小球CD31(另一种血管内皮细胞标记分子)阳性细胞数明显增多[11]。上述结果表明,早期糖尿病小鼠肾小球已出现内皮细胞增生、毛细血管数增多等变化,提示糖尿病早期肾小球已存在异常血管新生。现有资料表明,异常血管新生是导致糖尿病肾脏病变的主要原因。高糖、缺氧、糖基化终末产物、转化生长因子β(TGF-β)等多种因素促进了肾脏VEGF的合成与分泌,VEGF表达上调最终导致内皮细胞功能障碍和病理性血管新生[12]。
本实验结果显示,糖尿病小鼠给予非那雄胺10mg/kg连续灌胃4周,其肾小球MVD及VEGF指数明显低于模型组,提示非那雄胺对糖尿病早期小鼠肾小球新生血管形成具有抑制作用。临床资料显示,非那雄胺可降低BPH患者前列腺尿道黏膜下MVD,且该作用与非那雄胺对此部位VEGF表达的抑制呈正相关[7,13]。动物实验显示,在四氧嘧啶诱导糖尿病大鼠模型中,非那雄胺与阿卡波糖联合应用可显著降低糖尿病大鼠视网膜MVD,并可抑制VEGF在视网膜的表达,而单用阿卡波糖则无此作用[4]。可见,非那雄胺对不同组织新生血管形成具有抑制作用,该作用与其抑制VEGF在组织中的表达有关。血管新生是多种因素相互作用的结果,VEGF是其中的重要因素之一。但非那雄胺抑制血管新生的确切机制尚在进一步研究之中。
本实验结果初步证实,非那雄胺可降低VEGF在糖尿病小鼠肾小球中的表达,降低肾小球MVD,抑制糖尿病所致肾小球新生血管形成,对糖尿病肾微血管病变具有潜在防治作用。
[1]Yu P, Li Q, Liu Y, et al. The changes of endothelial function of blood vessels in early diabetic nephropathy[J]. Chin J Pract Inter Med, 2010, 30(9):827-828. [于萍, 李强, 刘颖, 等. 2型糖尿病早期血管内皮功能变化的研究[J]. 中国实用内科杂志,2010, 30(9):827-828.]
[2]Acevedo LM, Londono I, Oubaha M, et al. Glomerular CD34 expression in short- and long-term diabetes[J]. J Histochem Cytochem, 2008, 56(6): 605-614.
[3]Memis A, Ozden C, Ozdal OL, et al. Effect of finasteride treatment on suburethral prostatic microvessel density in patients with hematuria related to benign prostate hyperplasia[J]. Urol Int, 2008, 80(2): 177-180.
[4]Dai XQ, Liu SS, Ni GB, et al. Effects of finasteride on expression of vascular endothelial growth factor and microvascular density in retina of early diabetic rats[J]. Chin J New Drugs Clin Rem,2004, 23(4): 199-202. [戴晓秦, 刘树硕, 倪桂宝, 等. 非那雄胺对糖尿病大鼠视网膜血管内皮生长因子和微血管密度的干预[J]. 中国新药与临床杂志, 2004, 23(4): 199-202.]
[5]Bai H, Ma XY, Guo AT, et al. The study on complete Freud's adjuvant of prevention of STZ-induced diabetes[J]. Med J Chin PLA, 2008, 33(6): 712-714. [白桦, 马学毅, 郭爱桃. 完全弗氏佐剂预防链尿菌素引起糖尿病的机制研究[J]. 解放军医学杂志, 2008, 33(6): 712-714.]
[6]De Vriese AS, Tilton RG, Elger M, et al. Antibodies against vascular endothelial growth factor improve early renal dysfunction in experimental diabetes[J]. J Am Soc Nephrol,2001, 12(5): 993-1000.
[7]Pareek G, Shevchuk M, Armenakas NA, et al. The effect of finasteride on the expression of vascular endothelial growth factor and microvessel density: a possible mechanism for decreased prostatic bleeding in treated patients[J]. J Urol, 2003,169(1): 20-23.
[8]Zhang HJ, Zhao JB, Li P. Progress in the study on animal model of diabetic nephropathy[J]. Chin Pharmacol Bull, 2008, 24(7):845-848. [张浩军, 赵静波, 李平. 糖尿病肾病动物模型研究进展[J]. 中国药理学通报, 2008, 24(7): 845-848.]
[9]Osterby R, Bangstad HJ, Nyberg G, et al. On glomerular structural alterations in type 1 diabetes: companions of early diabetic glomerulopathy[J]. Virchows Arch, 2001, 438(2): 129-135.
[10]Ichinose K, Maeshima Y, Yamamoto Y, et al. Antiangiogenic endostatin peptide ameliorates renal alterations in the early stage of a type 1 diabetic nephropathy model[J]. Diabetes, 2005,54(10): 2891-2903.
[11]Yamamoto Y, Maeshima Y, Kitayama H, et al. Tumstatin peptide,an inhibitor of angiogenesis, prevents glomerular hypertrophy in the early stage of diabetic nephropathy[J]. Diabetes, 2004,53(7):1831-1840.
[12]Khamaisi M, Schrijvers BF, De Vriese AS, et al. The emerging role of VEGF in diabetic kidney disease[J]. Nephrol Dial Transplant, 2003, 18(8): 1427-1430.
[13]Lekas AG, Lazaris AC, Chrisofos M, et al. Finasteride effects on hypoxia and angiogenetic markers in benign prostatic hyperplasia[J]. Urology, 2006, 68(2): 436-441.
