蛋白质晶体的物理性质及其鉴别方法研究进展
2013-10-27解旭卓曹慧玲鹿芹芹陈瑞卿郭云珠周伯儒尹大川
解旭卓,曹慧玲,鹿芹芹,陈瑞卿,郭云珠,周伯儒,尹大川
西北工业大学 生命学院空间生物实验模拟技术国防重点学科实验室,陕西 西安 710072
蛋白质结晶的研究历经了从偶然性地好奇观察、有目的地纯化及蛋白纯度检验,到目前对蛋白质结构解析的发展过程。通过这个历程,人们对蛋白质晶体的性质已有了较清晰的认识。
长期以来,人们从多个角度对蛋白质晶体的物理性质进行了较为深入的研究,这对理解蛋白质结晶机理,进而更好地帮助实现蛋白质结晶,显然是有利的。但是,迄今尚无系统整理这些研究成果的文献。基于此,我们首先从整体上描述了蛋白质晶体的物理性质,然后分别介绍了相关的密度、机械性能、声学、热学、光学等性质,最后在此基础上总结了区分普通蛋白质晶体的方法,并进行评述。
1 蛋白质晶体的物理性质
蛋白质晶体是溶液中随机分布的蛋白质分子经规则排列堆积形成的有序聚集体,其特征是由有序的结构框架和包裹的溶剂分子(主要是水分子)共同形成的空间网状结构,呈多孔性晶体。相对于常规固态晶体,蛋白质晶体中蛋白质分子间的相互作用很弱,水分子对稳定其多孔状态发挥重要作用。作为棱面晶体,蛋白质晶体具有规则的几何外形,通常呈现出锐利的棱、角,以及光滑的平面。
1.1 晶体密度
水基结晶液的密度通常略大于水,而晶体密度又略大于溶液。因此晶体在没有贴附壁面时,一般会沉降到结晶液底部[1-2]。
1.2 机械性能
蛋白质晶体结构松散,在温和的液体环境中易破裂、易粉碎、易溶解[3-4],目前研究涉及机械性能的指标主要有硬度、弹性模量和塑性。蛋白质晶体的机械硬度不高,随室温暴露时间的延长显著增加后趋于稳定。弹性模量可用于估计蛋白质晶体堆积的紧凑程度,但其测量结果差异较大,常常与测量技术有关。根据蛋白质分子的结构,也可通过计算机模拟弹性模量。蛋白质晶体非常脆弱,基本不存在塑性,因此除了一篇利用计算机模拟计算涉及到蛋白质晶体的塑性研究报道外[5],目前还没有针对塑性方面的实验研究。
如前所述,晶体内部的水分子对蛋白质晶体结构稳定起到很大的作用。据此,Tait等[6]认为鸡蛋清溶菌酶(hen egg-white lysozyme,HEWL)晶体中水分子蒸发或溢出,晶体体积减小,致使蛋白质分子相互作用增强,从而硬度增加、弹性模量增大。
1.3 声学性质
蛋白质晶体HEWL的<110>面[001]和[110]方向的声传导速度并不相同,也受温度、pH值和溶剂影响。Tachibana等认为脱水后HEWL体积减小,分子间相互作用加强,导致声传导速率增加[7-10],可见自由穿透的水分子与蛋白质晶体的声传导速率密切相关。由此,证明蛋白质晶体呈现多孔性的内部结构。
1.4 热学性质
晶体在冷冻过程中的传热现象受到关注[11],主要研究晶体与冷媒之间的传热问题,包括三个方面:晶体向冷媒的传热系数,在冷冻瞬间晶体内部温度分布差异,以及相应的因温度差异导致的晶体内部应变。而晶体自身的热导率(thermal conductivity)并无实测数据,早期有向结晶溶液中添加HEWL晶体,进而测量晶体与溶液混合后热导率的报道[12],发现添加HEWL晶体后,溶液的热导率大幅下降;但是随着蛋白质晶体含量的增加,热导率逐渐提高,其具体数值范围为0.26~1.02 W/(m·℃)。由此可知晶体自身的热导率大体数量级范围,但其估计值约为0.6~5.0 W/(m·K)(在100 K到室温之间)[11]。
1.5 光学性质
1.5.1 折射率与双折射现象 Jones等[13]测量了溶菌酶晶体的折射率,发现与晶体中的溶剂含量有很大关系:晶体在含水饱和状态下,其折射率范围为1.49~1.56,但在空气中暴露后随着失水量的增加,其折射率逐步增加。多数蛋白质晶体都具有各向异性,在光学上表现为双折射现象(即存在2个折射率),在偏光显微镜下旋转检偏片观察晶体时,晶体呈现多彩条带[14]。但并不是所有晶体都有各向异性,如细菌分裂相关蛋白FtsZ[15]。通常情况下,我们并不能确定目标蛋白质晶体是否具有各向异性。
1.5.2 荧光现象 除了测量光学参数外,对蛋白质晶体的光吸收与激发也有一定的研究。紫外光下,蛋白质晶体一般能发出荧光。芳香族氨基酸吸收紫外光并释放荧光,色氨酸、酪氨酸和苯丙氨酸的吸收光谱范围为260~310 nm,其中色氨酸的荧光效应最强,在280 nm处达到最大吸收峰,释放300~450 nm的荧光,最强可视光谱为340~360 nm[16]。蛋白质分子堆积越密集,荧光强度越高,因此,蛋白质晶体因含有较大密度的芳香基,比其结晶液释放更多的荧光[17],从背景色中突显出来,即使晶体嵌入沉淀中也能检测到荧光[18],可应用此性质快速鉴别蛋白质晶体。部分蛋白质分子不含色基酸,如胰岛素,基本不具备上述性质,但能连接可发荧光的小分子,辅助鉴别蛋白质晶体。
2 根据物理性质鉴别蛋白质晶体
在蛋白质结晶实验条件筛选、优化过程中,蛋白质晶体(包括单晶、孪晶、微晶等)与非晶态的聚集体、自由的蛋白质分子,并随同缓冲液和沉淀剂中的盐晶、不规则沉淀等共存于结晶液中,给目标蛋白质晶体的检测和鉴别带来困难。进行X线晶体衍射之前,在筛选未知蛋白的结晶条件过程中,若恰当地鉴别蛋白质晶体,能减少蛋白用量、降低成本、提高效率,因此准确、高效地鉴别蛋白质晶体的方法一直是研究热点。依据目前的技术,大体上可将鉴别蛋白质晶体的方法分为低通量法和高通量法。
2.1 低通量法鉴别蛋白质晶体
在已知蛋白质晶体、盐晶或沉淀剂晶体形貌、颜色情况下,可用普通光学或偏光显微镜直接观察鉴别[14]。在未知情况下可采用如下方法:①脱水法:用晶体环固定晶体,较长时间暴露在空气中,蛋白质晶体由于脱水而损毁,盐晶则不发生变化;②密度法:捞出晶体,轻放在结晶液滴上,蛋白质晶体能短时间浮于表面,而盐晶快速下沉;③硬度法:在低倍光学显微镜下,在结晶液中用针尖触碰晶体,蛋白质晶体偏软,容易碎成粉状,而盐晶偏硬,容易碎裂成块;④溶解法:用湿滤纸触碰晶体,蛋白质晶体很快溶解,而盐晶需较长时间才能溶解;⑤灼烧法:捞出晶体放在盖玻片上,火焰灼烧盖玻片底部,显微镜下观察蛋白质晶体会由半透明状变成纯黑色粉末,也有毛发特有的烧焦味;⑥SDS-PAGE法:捞出晶体,在沉淀剂中轻蘸洗涤,经电泳后判断是否有目标染色条带;⑦对照法:参照盐的溶解度和扩散平衡时结晶液中的盐浓度,判断能否长出盐晶,也可单独培养盐晶,根据形貌作对照鉴别等[19];⑧偏光法:蛋白质晶体和盐晶都有较强的偏光性,利用此性质能区别晶体和其他非晶态物质(如玻璃壁上和结晶液内的小气泡、无定形沉淀等),效果显著;⑨衍射法:即X线单晶衍射法,获得衍射图谱,解析结构,进而判定是否是蛋白质晶体。
上述方法多具有破坏性,为了保护晶体可采用一些非破坏性的方法,如对照法和偏光法。
多数低通量鉴别方法并不完全可靠,往往因蛋白而异;最有说服力的方法是衍射法,根据衍射数据判断是否为蛋白质晶体,但费时费力[20-21],而且有时还存在一些不适合衍射的蛋白质晶体,也不能应用这种方法。
2.2 高通量法鉴别蛋白质晶体
在后基因组时代,众多的待解结构的蛋白与不完善的高通量检测技术之间的矛盾越来越尖锐,因此越来越多的科学家致力于该方面的研究。其中,在高通量鉴别蛋白质晶体方面发展出了一系列的方法,并从多个角度进行了改进。主要包括可见光法、UV荧光法和SONICC技术(second-order nonlinear imaging of chiral crystals,手性晶体的二阶非线性成像)。
2.2.1 可见光法 可见光法主要用于观察晶体形貌,根据形貌判断是否是晶体。普通光学显微镜下,晶体和沉淀从结晶液体的背景色中突显出来,能够看到晶体。高通量鉴别则可利用软件对图像进行分析从而自动辨别,例如应用一些自动拍照系统获得批量图像,之后采用XREC、CrysPage[22-23]等软件分析图像,鉴别是否存在晶体。但这种方法也存在准确性低的问题而受到质疑[17]。除此之外,利用晶体的双折射现象,可通过偏光显微镜得到彩色图像,也可判断是否存在晶体。可见光法可用于判断是否存在晶体,但对该晶体是否是蛋白质晶体,却无能为力。
2.2.2 UV荧光法 UV荧光法的主要作用在于区分盐晶。在UV激发下,盐晶保持灰暗,蛋白质晶体则常会释放荧光。这是一大突破,但仍存在一些实用局限性,如部分蛋白不产生荧光、荧光强度极弱且降低信噪比,蛋白质晶体含水量太高导致与溶液背景荧光区分不大而不能凸显、最适UV波长不确定且不统一,长时间UV照射易损毁晶体,结晶用的密封材料自身减弱或阻碍UV光线,非晶态蛋白质聚集体也释放一些荧光,不能高效检测微小晶体等。这些局限性影响了该技术的使用效果。对此,可考虑采用一些优化方案,如在分子水平共价连接上UV荧光因子,加入非特异性荧光因子等以放大蛋白内在特征。
2.2.3 SONICC技术 SONICC技术对蛋白质晶体学领域而言是一个新兴检测技术,可用于区分蛋白质晶体和非晶态蛋白质、盐等聚集体。该技术利用二次谐波(second-harmonic generation,SHG)作为图像信号源检测蛋白质晶体[17]。所谓二次谐波,简单说,是当使用一束近红外激光照射结构有序的材料时,出射光波中包含波长减半、频率倍增的光。通常当被照射的研究对象具备非中心对称的有序结构时,就能检测到SHG信号(即单位时间频率倍增光的信号)。一般对称性越低,SHG信号越强。除八面体和二十面体晶体外,其他所有手性晶体都会产生SHG信号。据估计,已知蛋白质晶体中的99.2%均能产生大量的SHG信号。利用该特点,可以方便地检测蛋白质晶体。同时,由于该技术的分辨能力很强,在蛋白质晶体尺寸很小的情况下(可以小至2 μm),也能检测到明显的信号,因此,利用该技术还可以研究蛋白质晶体的形核过程。该技术在鉴别蛋白质晶体与盐晶时也具备一定的能力。由于盐晶的对称性通常较高,SHG信号相对较弱,而蛋白质晶体,如一些膜蛋白晶体具有较强的SHG信号(如膜蛋白结晶成像中,小于5 μm膜蛋白晶体的SHG信号大于18×106counts/s,背景信号小于 1×103counts/s)[24-27]。因此,利用SHG信号强弱可以区分这2类晶体。
最近,双光子显微镜(two-photon microscopy)也被用于膜蛋白晶体的检测,是UV荧光和SONICC技术的优势互补应用,能从混浊的LCP(lipidic cubic phase,脂立方相)基质中准确检测、鉴别10 μm左右的晶体[17,28]。
依据以上评述,我们归纳总结了目前发展的高通量蛋白质晶体鉴别技术,汇总在表1中。
3 结语
蛋白质晶体的物理性质是研究蛋白质晶体特性、蛋白质结晶过程,以及蛋白质晶体应用的基础,是非常重要的基础信息。长期以来,关于蛋白质晶体的物理性质虽然已有不少相关研究结果,但这些研究结果常淹没散在于大量文献中,少有人对此进行整理总结。而在需要时,搜寻查找相关资料并不容易。针对这种问题,我们对蛋白质晶体的密度、机械性能、声学、热学、光学等性质进行了归纳梳理;同时,面对蛋白质结晶实践中常见的蛋白质晶体鉴别问题,对前人基于其物理性质发展出的晶体鉴别方法也进行了评述。未来蛋白质晶体物理性质相关方面的研究,在蛋白质结晶方法学不断发展的前提下,仍将继续下去,而蛋白质晶体鉴别技术也有望在此基础上得到进一步的发展,甚至催生出新的商业化产品。
[1]Steinrauf L.Preliminary X-ray data for some new crystalline forms of-lactoglobulin and hen-egg-white lysozyme[J].ActaCrystallographica,1959,12(1):77-79.
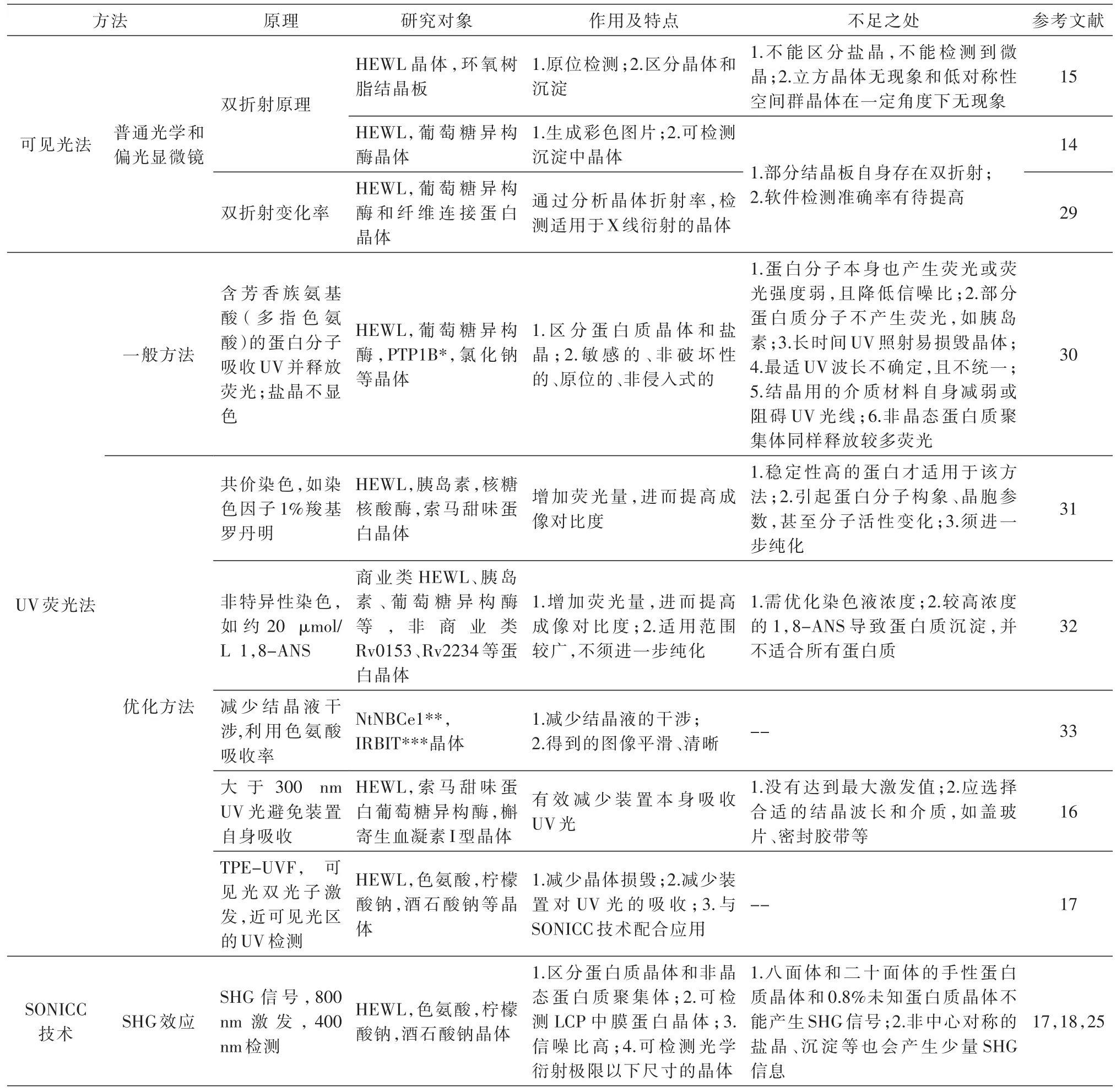
表1 高通量鉴别蛋白质晶体的基本方法
[2]Lin H,Rosenberger F,Alexander J,et al.Convective-diffu⁃sive transportin protein crystalgrowth[J].JCrystGrowth,1995,151(1):153-162.
[3]Margolin A L,Navia M.A Pprotein crystals as novel catalyt⁃ic materials[J].Angewandte Chem Int Ed,2001,40(12):2204-2222.
[4]Vilenchik L Z,Griffith J P,St.Clair N,et al.Protein crys⁃tals as novel microporous materials[J].J Am Chem Soc,1998,120(18):4290-4294.
[5]Buehler M J.Mechanics of protein crystals:atomistic model⁃ing ofelasticityand fracture[J].JComputTheorNanosci,2006,3(5):670-683.
[6]Tait S,White E T,Litster J D.Mechanical characterization of protein crystals[J].Part Part Syst Charact,2008,25(3):266-276.
[7]Tachibana M,Kojima K,Ikuyama R,et al.Sound velocity and dynamic elastic constants of lysozyme single crystals[J].Chem Phys Lett,2000,332(3-4):259-264.
[8]Tachibana M,Koizumi H,Kojima K.Effect of intracrystalline water on longitudinal sound velocity in tetragonal hen-eggwhite lysozyme crystals[J].Phys Rev E,2004,69(5):051921-051925.
[9]Oki H,Matsuura Y,Komatsu H,et al.Refined structure of orthorhombic lysozyme crystallized at high temperature:correla⁃tion between morphology and intermolecular contacts[J].Acta Crystallogr D,1999,55(1):114-121.
[10]Matsuura Y,Chernov A.A morphology and the strength of in⁃termolecularcontactsin protein crystals[J].Acta Crystallogr D,2003,59(8):1347-1356.
[11]Kriminski S,Kazmierczak M,Thorne R.Heat transfer from protein crystals:implications for flash-cooling and X-ray beam heating[J].Acta Crystallogr D,2003,59(4):697-708.
[12]Liu J,Yang W J.Thermophysical properties of lysozyme(pro⁃tein)solutions[J].J Thermophys Heat Transfer,1992,6(3):531-536.
[13]Jones F T.Optical and crystallographic properties of lysozyme chloride[J].J Am Chem Soc,1946,68(5):854-857.
[14]Echalier A,Glazer R,Fulop V,et al.Assessing crystalliza⁃tion droplets using birefringence[J].Acta Crystallogr D,2004,60(4):696-702.
[15]Bodenstaff E R,Hoedemaeker F J,Kuil M E,et al.The pros⁃pects ofprotein nanocrystallography[J].Acta Crystallogr D,2002,58(11):1901-1906.
[16]Dierks K,Meyer A,Oberthur D,et al.Efficient UV detection of protein crystals enabled by fluorescence excitation at wave⁃lengths longer than 300 nm[J].Acta Crystallogr F,2010,66(4):478-484.
[17]Madden J T,DeWalt E,Simpson G.Two-photon excited UV fluorescence for protein crystal detection[J].Acta Crystallogr D,2011,67(10):839-846.
[18]Pusey M,Forsythe E,Achari A.Fluorescence approaches to growing macromolecule crystals[J].Methods Mol Biol,2008,426(4):377-385.
[19]Singh K A,Celie P,Rao G,et al.An approach able to es⁃cape the most common problem during protein crystallization ie formation of salt crystal[J/OL].Nature Precedings,http://dx.doi.org/10.1038/npre.2010.4725.1.
[20]Judge R A,SwiftK,GonzalezC.An ultravioletfluores⁃cence-based method for identifying and distinguishing protein crystals[J].Acta Crystallogr D,2005,61(1):60-66.
[21]Bourgeois D,Vernede X,Adam V,et al.A microspectropho⁃tometer for UV-visible absorption and fluorescence studies of protein crystals[J].J Appl Crystallogr,2002,35(3):319-326.
[22]Pothineni S B,Strutz T,Lamzin V S.Automated detection and centring of cryocooled protein crystals[J].Acta Crystallogr D,2006,62(11):1358-1368.
[23]Esser L,Xia D.CrysPage:a program for displaying images of crystallization trials,rapid comparisons and analysis[J].J Appl Crystallogr,2011,44(5):1130-1131.
[24]Kissick D J,Gualtieri E J,Simpson G J,et al.Nonlinear op⁃tical imaging of integral membrane protein crystals in lipidic mesophases[J].Anal Chem,2009,82(2):491-497.
[25]Wampler R D,Kissick D J,Dehen C J,et al.Selective detec⁃tion of protein crystals by second harmonic microscopy[J].J Am Chem Soc,2008,130(43):14076-14077.
[26]Wanapun D,Kestur U S,Kissick D J,et al.Selective detec⁃tion and quantitation oforganic molecule crystallization by second harmonic generation microscopy[J].Anal Chem,2010,82(13):5425-5432.
[27]Kissick D J,Wanapun D,Simpson G J.Second-order nonlin⁃ear optical imaging of chiral crystals[J].Ann Rev Anal Chem,2011,4:419-437.
[28]Padayatti P,Palczewska G,Sun W,et al.Imaging of protein crystals with two-photon microscopy[J].Biochemistry,2012,51(8):1625-1637.
[29]Owen R L,Garman E.A new method for predetermining the diffraction quality of protein crystals:using SOAP as a selec⁃tion tool[J].Acta Crystallogr D,2005,61(2):130-140.
[30]Judge R A,SwiftK,GonzalezC.An ultravioletfluores⁃cence-based method for identifying and distinguishing protein crystals[J].Acta Crystallogr D,2004,61(1):60-66.
[31]Forsythe E,Achari A,Pusey M L.Trace fluorescent labeling for high-throughput crystallography[J]. Acta Crystallogr D,2006,62(3):339-346.
[32]Groves M R,Muller I B,Kreplin X,et al.A method for the general identification of protein crystals in crystallization exper⁃iments using a noncovalent fluorescent dye[J].Acta Crystal⁃logr D,2007,63(4):526-535.
[33]Gill H S.Evaluating the efficacy of tryptophan fluorescence and absorbance as a selection tool for identifying protein crys⁃tals[J].Acta Crystallogr F,2010,66(3):364-372.
