一株绿僵菌的分离鉴定及对桃小食心虫的致病力研究
2013-10-23王刚熊琦田芬谢映平薛皎亮
王刚,熊琦,田芬,谢映平,薛皎亮
(山西大学 生命科学学院,山西 太原 030006)
0 引言
桃小食心虫(Carposina sasakii),简称桃小,隶属昆虫纲Insecta鳞翅目Lepidoptera蛀果蛾科Carposinldae.桃小食心虫在我国北方对果树危害严重[1],是北方果树生产中发生面积最广、危害最大的食心虫类害虫之一.它可危害枣、苹果、梨、桃、杏等10多种果树的果实,通过幼虫蛀食果肉,在孔道和果核周围残留大量虫粪,严重影响果品的产量和质量[2].幼虫在发育后期株危害率几乎达到100%,果危害率达80%以上,对果树损害巨大[3].
利用昆虫病原真菌防治桃小食心虫是生物防治中的重要手段之一,具有显著的流行潜力,容易大量生产,且安全有效,在防治过程能保证果品安全.因此,获得高致病力的病原真菌菌株尤为重要.朱艳婷等[4]用不同来源寄主上的14株白僵菌菌株侵染桃小食心虫,获得3株高致病力的优良菌株;朱永敏等[5]从桃小食心虫越冬茧自然染病虫尸上,分离纯化得到3株桃小食心虫的病原真菌,其中两株菌株为镰孢属,另外一株为拟青霉属.国内尚少见关于从桃小食心虫越冬茧自然染病虫尸上分离纯化得到绿僵菌(Metarhizium)的报道.绿僵菌是一种重要的生防真菌,全球大概200多种昆虫可被绿僵菌感染致死[6].
樊美珍等[7]证明了绿僵菌对桃小食心虫有良好的防治效果,具有用量少、成本低等优点,叶斌[8]等人还证实了绿僵菌具有一定的耐高温和耐旱性.目前利用绿僵菌防治的靶标害虫中,对于鞘翅目(蛴螬)、直翅目(蝗虫)、同翅目(蚜虫、粉虱、叶蝉)的研究报道比较多,而对于鳞翅目害虫报道较少.因此,筛选能够感染桃小食心虫的绿僵菌新菌株,对于防治鳞翅目害虫十分重要.
Driver[9]等对121株绿僵菌实验菌株ITS序列进行分析,并将绿僵菌划分为3个种,金龟子绿僵菌下有3个变种.但是单纯地依靠菌株的形态特征或分子生物学方法都存在一定的不足,将两者结合用于系统分类有助于更好地解决真菌分类的难题.
本研究经室内培养分离、光学显微镜和扫描电镜的形态特征观察,以及DNA-ITS基因序列分析,鉴定出编号为TSL06的菌株为金龟子绿僵菌.并用浓度为1.2×109孢子/mL悬液侵染桃小食心虫,校正致死率达到86.08%,该菌株有较强的毒力,可为我国北方桃小食心虫的生物防治提供新的菌种资源和应用依据.
1 材料与方法
1.1 材料
1.1.1 样品来源
桃小食心虫虫尸来源于山西临汾地区襄汾景毛乡果园.
1.1.2 培养基
PDA培养基:土豆200g、葡萄糖18g、琼脂20g、蒸馏水1000mL.
1.1.3 回接实验的虫源
用健康的桃小食心虫幼虫作为回接试验昆虫.2012年9月份从山西临汾地区襄汾景毛乡果园采集团枣的落果,放置于室内,让桃小食心虫幼虫自然从果实中钻出,收集健康虫体,用于试验.
1.2 方法
1.2.1 菌株的分离和纯化
在无菌的CJ-C系列洁净工作台中将自然染菌的桃小食心虫虫尸,每头平均剪成3块,在体积分数为75%的酒精中浸泡3s,接着在质量体积比(0.1g Hg溶于100mL蒸馏水中)0.1%的汞水中消毒3min,之后用无菌水冲洗虫尸3次,最后将处理好的虫尸呈等边三角形放入含有PDA培养基的培养皿中.将培养皿放在25℃的SPX-250I-C型人工气候箱中培养5d,划线分离长出的菌株,并重复培养划线分离3-5次,直到得到纯菌株.
1.2.2 孢子悬液的制备
将纯化培养好的菌株用接种环移入到10mL含有质量浓度为0.1%吐温-80无菌水溶液的三角瓶中,在85-2型磁力搅拌器上充分搅拌使孢子均匀分散在溶液中,用血球计数板测定孢子浓度,并将孢子悬液调配成所需要的浓度.
1.2.3 回接杀虫实验
用2012年9月份采集的健康桃小食心虫幼虫做回接实验.6.0×108孢子/mL的孢子悬液感染健康的桃小食心虫,将接菌后的桃小食心虫置于无菌培养缸中,在25℃、70%相对湿度下培养并观察虫体的感染情况.
1.2.4 菌落形态的观察
用移液枪吸取孢子悬液10μL,滴在PDA平板中,每个培养皿滴3滴,呈等边三角形,在(25±1)℃条件下连续培养,每天观察记录菌落特征,并测量菌落直径.
1.2.5 菌株在光学显微镜下的显微结构观察
采取的是载片培养法[10].根据需要在不同的培养时间取出载玻片,置于OLYMPUS BX51光学显微镜下观察,并用配套的OLYMPUS数码相机C-5050ZOOM拍照记录菌落的显微结构特征,参照贺运春[11]和李增智[12]对绿僵菌形态分类的描述进行分类鉴定.
1.2.6 菌株在扫描电镜下的显微结构观察
采用插片培养法[10]培养一个星期后,取出盖玻片,用质量浓度为2.5%戊二醛固定,梯度乙醇脱水,每个梯度10min,EMS850临界点干燥器中干燥,15kV、20mA下喷金,在JSM-840型扫描电镜下观察拍照.
1.2.7 菌株的分子鉴定
采用CTAB法提取DNA[13].先在PDA培养基上培养大量的菌株,用液氮研磨,通过水浴、离心等,将提取的DNA在4℃下溶于TE水中,保存备用.以待测菌株基因组DNA为模版,用ITS序列通用引物ITS4(5’-TCCTCCGCTTATTGATATGC-3’)和ITS5(5’-GGAAGTAAAAGTCGTAACAAGG-3’),在 Master cyoer 5331Eppendorf PCR扩增仪上进行扩增,扩增条件为94℃ 预变性5min;94℃ 变性1min,50℃ 复性1min,72℃延伸1min,30个循环;最终72℃延伸10min.取PCR产物5μL于1.5% 的琼脂糖凝胶上电泳,用DNA Marker指示分子量.将电泳完的胶板放于凝胶成像系统上观察并照相,来检测PCR产物的纯度和含量大小,合格后送生物工程(上海)有限公司测序.用Sequencher软件进行分析得到DNA序列,与NCBI数据库中的已知真菌DNA序列进行比较确定该菌株的种属地位.
1.2.8 致病率试验
制备5个浓度的孢子悬液,孢子浓度分别为1.2×109孢子/mL、6.0×108孢子/mL、1.2×108孢子/mL、6.0×107孢子/mL、1.2×107孢子/mL.用浸染法接种健康的桃小食心虫,对照组为无菌蒸馏水处理,接菌后将桃小食心虫置于无菌培养盒内,盒内放一层保湿滤纸,每盒放30头桃小食心虫,每个浓度做3组,在25℃、70%相对湿度下培养.感染后连续观察10d,并记录各浓度处理组和对照组的累计死亡率.
2 结果与分析
2.1 自然感染死亡的桃小食心虫和分离纯化得到的菌株
从桃小食心虫越冬虫茧中发现自然染菌的虫体表面有绿色的真菌寄生(图1A)在虫尸上,经划线分离纯化得到的一株绿僵菌(图1B),编号为TSL06菌株(TS为桃小食心虫的缩写,L为采集地临汾缩写).

图1 自然染菌的桃小食心虫和从虫尸上分离纯化的TSL06菌株Fig.1 Naturally diseased peach fruit moth larva and the strain of TSL06separated and purified from insect carcasses
2.2 回接杀虫实验结果
将分离获得的TSL06菌株制备成浓度为6.0×108孢子/mL的孢子悬液,接种桃小食心虫.接菌后第2天,虫体开始变得不活跃;第3天出现死亡,且虫体表面颜色变暗(图2A);第4天虫体表面长出白色菌丝,菌丝最先出现在头部和尾部(图2B-2C);第5天菌丝上长出绿色孢子,随后孢子继续增多;第8天虫体表面已布满菌丝和孢子(图2D),虫体干瘪,因此说明该菌株是桃小食心虫的致病菌.

图2 染菌后的桃小食心虫幼虫Fig.2 Diseased larvae of peach fruit moth
2.3 菌落的形态特征
培养状况:在PDA培养基上,25℃条件下培养7d后,菌落平均直径为34mm,呈圆形,不透明.培养初期菌落为绒毛状白色菌丝,边缘较圆滑(图3A);第4天开始产生孢子(图3B),菌落中央孢子圈不断扩大,颜色逐渐变为墨绿色,中间凸起边缘较整齐、平展,绒毛状,表面干燥且菌落不透明(图3C),菌落背面呈棕黄色(图3D).
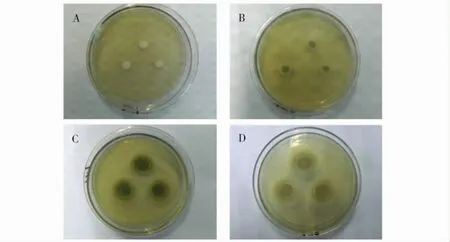
图3 TSL06菌株培养形状Fig.3 Cultural characters of the strain TSL06
形态特征:在光学显微镜下,可以看到分生孢子梗上长有柱形或瓶形的小梗,小梗顶部产分生孢子,分生孢子长椭圆形,菌丝无色透明,直径1.7~2.1μm(图4A).分生孢子梗末端的小梗常对生或者轮生(图4B).通过扫描电镜可以进一步看到,分生孢子梗上有隔,直径2.2~2.8μm(图4C).分生孢子表面较光滑,呈长椭圆形,两端钝圆,大小(5.2~7.7)μm×(2.7~3.1)μm(图4B、图4D).

图4 TSL06菌株形态特征Fig.4 Morphological characteristics of the strain TSL06
通过形态鉴定,初步判断该菌株为绿僵菌属的金龟子绿僵菌(Metarhizium anisopliae(Metsch.)Sorokin).
2.4 菌株的分子鉴定结果
先用CTAB法提取TSL06菌株的DNA,对提出的DNA进行PCR扩增,用琼脂糖凝胶电泳检测扩增的DNA片段的含量和纯度(图5),并分别以ITS4和ITS5为引物进行ITS测序,将菌株的ITS序列测定结果在NCBI中进行Blast比对.结果显示,该菌株与金龟子绿僵菌的相似度为100%.
结合菌株形态鉴定,最终确定该菌株为绿僵菌属的金龟子绿僵菌.
2.5 不同浓度TSL06孢子悬液对桃小食心虫幼虫的致死率
桃小食心虫在染菌后第1天基本没有死亡;第2天5个浓度孢子悬液处理组的幼虫活力都表现下降,且每组都出现少数死亡的情况;第3天死亡虫数继续增加;第4-7天是各染菌组虫体死亡的高峰期;第8天后死亡数量逐日减少.5个浓度相比,孢子悬液的浓度越高,对幼虫的致死效果越好.染菌10天后,最低浓度1.2×107孢子/mL感染下校正死亡率达到37.66%,最高浓度1.2×109孢子/mL 校正死亡率达到85.71%,是最低浓度的2.3倍(图6).LC50为3.86×107孢子/mL,PROBIT(p)=-4.854+0.640 X,孢子悬液不同浓度之间存在一定的显著性差异(P<0.05)(表1),表明孢子悬液在不同浓度下,毒力相差比较大.

图5 菌株TSL06特异引物扩增产物电泳图谱Fig.5 Agarose gel of PCR products of TSL06

图6 五个浓度孢子悬液对桃小食心虫幼虫校正致死率的比较Fig.6 Comparison of corrected mortality of peach fruit moth larvae infected by the spore suspension in five concentrations

表1 五个浓度孢子悬液对桃小食心虫幼虫的校正死亡率Table 1 Corrected mortality of peach fruit moth larvae infected by fungal spore suspension in five concentrations
3 讨论
本研究从自然染病的桃小食心虫虫尸上分离纯化出1株虫生真菌,鉴定为绿僵菌属的金龟子绿僵菌菌株.用其不同的孢子浓度侵染桃小食心虫,最高浓度的校正致死率达到86.08%,说明该菌株是桃小食心虫的病原真菌,且具有较强的致病力.
绿僵菌是一种重要的昆虫病原真菌.国内外关于虫生真菌防治害虫的研究很多,研究最多的病原真菌是白僵菌、绿僵菌等病原真菌.绿僵菌是一种高效环保的生物试剂[14],近年来世界各地用绿僵菌对近百种农业害虫进行室内防治效果评价,对多种昆虫进行了田间防治试验,已发展成为仅次于白僵菌的真菌杀虫剂.在国外,英国研制的杀蝗绿僵菌生物农药,防治效果达到90%以上;美国绿僵菌产品用于防治蟑螂、白蚁;巴西和委内瑞拉的绿僵菌产品防治甘蔗沫蝉等.在国内,重庆真菌农药研制工程中心研制的生物制剂“蝗敌1号”,已在我国北方蝗虫发生地区应用[15];童树森等[16]用含孢量2亿孢子/mL的绿僵菌粉剂林间喷粉防治青杨天牛,连续2a防效70%以上;也有学者利用绿僵菌防治椰心叶甲[17]等.对于绿僵菌的研究报道很多,但目前关于在我国北方地区,从自然感染的桃小食心虫僵尸上分离病原绿僵菌还未见报道.在国内外,菌种分类也更为科学,已从形态特征鉴定开始转向分子手段来确定其种属地位[18-19].
传统的真菌分类鉴定以其形态学特征、生长特性以及生理生化指标为基础,但是绿僵菌其生长特性和生理生化指标随着环境的变化而不稳定,因此本研究在形态特征鉴定方面,从培养性状、光学显微和扫描电镜的形态特征相结合分析,相对准确确定了其形态特征;分子鉴定方面,提取其18S核糖体的DNA-ITS基因序列分析.用不同的技术手段互相佐证,确定了该菌株的种属地位,鉴定结果更科学.进行毒力检测时,用不同浓度的孢子悬液来实验,毒力大小差距大,可以根据生产实践的需要来确定浓度.桃小食心虫1a发生1~3代,在不同寄主上生活史存在一定差异,但基本生活史均为末龄幼虫入土结茧滞育越冬.第二年幼虫出土后再结长茧化蛹、羽化,交尾,产卵,孵化幼虫,幼虫蛀入果内危害果实,之后出果结茧越冬.我们在果园采集桃小食心虫时发现,在越冬后的虫茧内和土块中,发现有自然染病的幼虫,说明幼虫在入土的时候已经染菌.因此防治桃小食心虫可以选择在幼虫入土前后,喷洒孢子悬液或者固体菌粉,是最佳防治时期.绿僵菌还需进一步像白僵菌一样,研究它对靶标害虫的侵染机理[20],适应北方干旱低温的气候特点[21],研制应用剂型和野外防治实验,为开发利用提供科学依据.
[1]王鹏,于毅,张思聪,等.桃小食心虫的研究现状[J].山东农业科学,2012(12):58-63.
[2]郑文德,靳月笑,王曼丽,等.桃小食心虫的发生与防治[J].现代农业科技,2009(14):159,162.
[3]刘万达,赵伟.桃小食心虫的发生与防治[J].北方园艺,2011(7):135-136.
[4]朱艳婷,时景燕,王涛涛,等.桃小食心虫高致病力白僵菌菌株筛选[J].植物保护,2011,37(5):155-159.
[5]朱永敏,李捷,熊琦,等.三株桃小食心虫病原真菌的分离及形态鉴定[J].山西大学学报:自然科学版,2011,34(1):131-136.
[6]刘爱英.中国虫生真菌研究与应用[M].北京:中国农业科技出版社,1991:159-164.
[7]樊美珍,李增智.绿僵菌在土壤中的延续及控制桃小食心虫的潜力[J].应用生态学,1996,7(1):49-55.
[8]叶斌,蒋英成,林文清,等.金龟子绿僵菌对马尾松林节肢动物群落多样性的影响[J].福建农业大学报,2005,34(2):239-243.
[9]Driver F,Milner R J,Truman W H.A Taxonomic Revision of MetarhiziumBased on a Phylogenetic Analysis of rDNA Sequence Data[J].Mycology Research,2000,104(2):134-150.
[10]沈萍,范秀荣,李光武.微生物学实验[M].北京:高等教育出版社,1996:41,45.
[11]贺运春,张仙红.山西虫生真菌[M].北京:中国农业科学技术出版社,2006:16-18.
[12]蒲蛰龙,李增智.昆虫真菌学[M].合肥:安徽科学技术出版社,1996:323-327.
[13]O’Donnell K,Kistler HC,Cigelnik E,et al.Multiple Evolutionary Origins of the Fungus Causing Panama Disease of Banana:Concordant Evidence from Nuclear and Mitochondrial Gene Genealogies[J].Applied Biological Sciences,1998,95:2044-2049.
[14]代鹏,宋妍,许天委,等.绿僵菌的研究进展[J].热带农业科学,2005,25(2):73-77.
[15]李宝玉,张泽华,农向群,等.真菌杀虫剂产品标准化研究进展[J].中国生物防治,2004,20(S):32-38.
[16]童树森,宫建,苟英杰.利用绿僵菌防治青杨天牛试验研究[M].中国虫生真菌研究与应用Ⅲ.北京:中国农业出版社,1991:155-157.
[17]吴青,曾玲,徐大高,等.感染椰心叶甲绿僵菌菌株的筛选[J].华南农业大学学报,2006,27(2):32-34.
[18]Crouch J A,Clarke B B,White J F,et al.Systematic Analysis of the Falcate-spored Graminicolous Colletotrichumand a Description of Six New Species of the Fungus from Warm Season Grasses[J].Mycologia,2009,101:717-732.
[19]Yang Y L,Liu Z Y,et al.Colleotrichum Anthracnose of Amaryllidaceae[J].Fungal Diversity,2009,39:123-146.
[20]Xiong Q,Xie Y P,Zhu Y M,et al.Morphological and Ultrastructural Characterization of Carposina Sasakii Larvae(Lepidoptera:Carposinidae)Infected by Beauveria Bassiana (Ascomycota:Hypocreales:Clavicipitaceae)[J].Micron,2012,in press.
[21]樊金华,谢映平,薛皎亮,等.一株油松毛虫病原真菌—卵孢白僵菌的分离鉴定及生物学特性研究[J].山西大学学报:自然科学版,2007,30(S1):107-110.
