PP2可增强乳腺癌Hs578T细胞缝隙连接功能
2013-10-22董淑英蒋国君童旭辉
董淑英,郑 超,蒋国君,韩 溪,童旭辉
(蚌埠医学院药学系药理学教研室,安徽蚌埠 233030)
缝隙连接(gap junction)是细胞间进行物质交流的主要通道,由特殊的通道蛋白——连接蛋白(connexin)组成[1]。缝隙连接功能改变与肿瘤等多种疾病密切相关。研究表明,与正常乳腺细胞相比,乳腺癌细胞中缝隙连接功能有不同程度的降低或缺失,并且恢复或增强缝隙连接功能可能对化疗药物的抗肿瘤作用具有增效作用[2-3]。
Src激酶是由原癌基因src编码的非受体型酪氨酸激酶。研究表明,Src在多种肿瘤细胞及组织中过表达,如乳腺癌、肺癌、结肠癌等[4]。Src激酶可以降低细胞的缝隙连接功能[5],而PP2作为Src激酶的特异性抑制剂,对乳腺癌细胞缝隙连接功能的影响尚不清楚。本课题组前期研究结果表明,乳腺癌细胞株Hs578T中Cx43总蛋白表达水平、细胞膜上Cx43的表达能较好反映药物对乳腺癌缝隙连接功能的改变[3],因此本实验通过Western blot及荧光示踪法研究了Src激酶抑制剂PP2对Hs578T细胞Src激酶表达及缝隙连接功能的影响,以期为提高化学药物的抗肿瘤疗效提供一个新的思路。
1 材料与方法
1.1 细胞及主要试剂 Hs578T细胞系购于中科院上海细胞库。胰蛋白酶、MTT、二甲基亚砜(DMSO)、PP2均为美国Sigma公司产品;高糖型DMEM培养基、新生小牛血清均为Gibco公司产品;荧光染料 Calcein-AM为 Molecular Probes公司产品。其他常用试剂均为国产分析纯级。
1.2 细胞培养 Hs578T细胞接种于含有10%(V/V)新生小牛血清、100 kU/L青霉素、100 mg/L链霉素的 DMEM培养液中,置于37℃、含体积分数5% 二氧化碳以及饱和湿度的细胞培养箱中培养。细胞常规培养于培养瓶中,0.25%胰蛋白酶溶液消化传代,1周传代2~3 次,传代比例为1∶2。
1.3 MTT法测定 Hs578T细胞的生长 将Hs578T细胞接种于96孔板细胞培养板中培养,细胞密度为5000个/孔。每组药物浓度设5个复孔,PP2终浓度为:1、2、4、8、16、32 μmol/L。加药24 h(药物作用终点时间)终止培养,终止培养前4 h,每孔加MTT 15μl(5 g/L),弃上清液,加入二甲基亚砜 150μl/孔,微量振荡器震摇10 min,全自动定量绘图酶标仪测定每孔的570 nm波长处吸光度值。以上实验重复3次。细胞存活率按下述公式计算。

1.4 Western blot法检测Src激酶表达水平将Hs578T细胞按每孔2 ml(细胞密度为1×108个/L)接种于6孔板,放置培养箱中培养48 h,待细胞融合后,用不同浓度的PP2处理24 h和用 8 μmol/L PP2 处理 6 h、12 h、24 h。加药后24 h,采用细胞全蛋白抽提试剂盒提取细胞全蛋白,BCA蛋白定量试剂盒测定所提取蛋白浓度。取蛋白150μg/组,12%SDS-PAGE凝胶电泳(80 V,30 min;120V,150 min);转膜(50 V,180 min);5%脱脂牛奶室温封闭过夜;一抗1∶4000稀释,4℃孵育过夜;TPBS洗涤3次×10 min;二抗1∶4000稀释,室温孵育2 h;TPBS洗涤3次 ×10 min,PBS洗涤1次 ×15 min;ECL发光试剂盒暗室发光、显影、定影。Bio-Rad凝胶成像系统采集图像。对Western blot结果中各条带进行灰度值扫描,取4次实验结果的平均值,按正常对照组的Src激酶与其相应的β-actin的比值进行标化计算(即设定正常对照组的Src激酶与其相应的β-actin的比值为1)。
1.5 荧光示踪法测定细胞间缝隙连接功能
将Hs578T细胞按每孔1 ml(细胞密度为1×108个/L)接种于12孔板,放置培养箱中培养48 h,待细胞融合后,用不同浓度的PP2处理24 h 和用 8 μmol/L PP2 处理 6 h、12 h、24 h。加药24 h后,将 Hs578T细胞与荧光指示剂calcein-AM共同孵育,使calcein-AM进入细胞。该细胞称为“供体细胞”。将“供体细胞”接种到已生长融合的Hs578T细胞(“接受细胞”)上,培养4 h。待形成稳定的缝隙连接后,小分子的calcein(发绿色荧光)可以通过缝隙连接进入相邻的“接受细胞”,用荧光显微镜观察,记录缝隙连接荧光传递功能。一个“供体细胞”周围含有calcein的“接受细胞”数目作为缝隙连接功能的指标[2]。取5次实验结果的平均值,按正常对照组的细胞荧光传递的结果进行标化(即设定正常对照组“供体细胞”周围的“接受细胞”的数量为1)。
2 结果
2.1 PP2对Hs578T细胞生长增殖的影响 先采用MTT法检测0~32 μmol/L浓度下PP2对Hs578T细胞的生长抑制作用。结果显示,在1~8 μmol/L的浓度范围内,PP2作用 Hs578T细胞24 h后,细胞存活率为(98±3)% ~(94±4)%,与未用药组(PP2为0 μmol/L)无明显差异(P>0.05),表明其对细胞增殖几无影响;而16、32 μmol/L PP2(超过 8 μmol/L 浓度范围)作用Hs578T细胞24 h后,其细胞存活率分别为(84±3)%和(75±4)%,与未用药组(PP2为0 μmol/L)比较,细胞存活率明显降低(P<0.01),表明该浓度范围的PP2对细胞增殖有明抑制作用(图1)。因此,实验中选取了对细胞增殖无明显影响剂量范围(1~8 μmol/L)的PP2,观察其对细胞缝隙连接功能的影响。

图1 不同浓度PP2对乳腺癌Hs578T细胞存活的影响(n=3)Fig.1 Effect of PP2 on survival of breast cancer cell Hs578T(n=3)
2.2 PP2增强Hs578T细胞缝隙连接功能 细胞荧光示踪结果显示,PP2(1~8 μmol/L)作用Hs578T细胞24 h可以增强缝隙连接介导的细胞间荧光传递功能(图 2)。1、2、4、8 μmol/L PP2作用后细胞的标化荧光传递强度分别为1.60 ±0.08、2.00 ±0.05、2.20 ±0.05、2.70 ±0.09,与对照组差异均有统计学意义(均P<0.01);且高浓度PP2组与低浓度PP2组差异均有统计学意义(P<0.05~0.01)。结果提示,1~8 μmol/L浓度范围内的PP2随着用药浓度增高,其对Hs578T细胞缝隙连接功能的增强作用更加明显。
图3显示,8 μmol/L PP2预处理 Hs578T细胞6 h、12 h、24 h后,可以增强缝隙连接介导的细胞间荧光传递功能。PP2预处理不同时间后细胞标化荧光传递强度分别为1.4±0.05、1.7 ±0.06 及2.2 ±0.07,与正常对照组相比差异有统计学意义(P<0.01);且PP2长时间作用与短时间作用差异均有统计学意义(P<0.01)。结果提示,6~24 h的时间范围内,长作用时间8 μmol/L PP2对Hs578T细胞的缝隙连接功能的作用更明显。


2.3 PP2减少Hs578T细胞Src激酶的表达用1 ~ 8 μmol/L PP2处理Hs578T细胞24 h,可见 Src激酶表达均减少(图 4)。1、2、4、8 μmol/L PP2作用后Hs578T细胞Src激酶表达与 β-actin 比值分别为 0.93 ±0.02、0.70 ±0.09、0.66 ±0.09、0.36 ±0.10,与对照组比较差异均有统计学意义(P<0.05~0.01);且高浓度PP2组与低浓度PP2组比较,其差异亦均有统计学意义(P <0.05~0.01)。
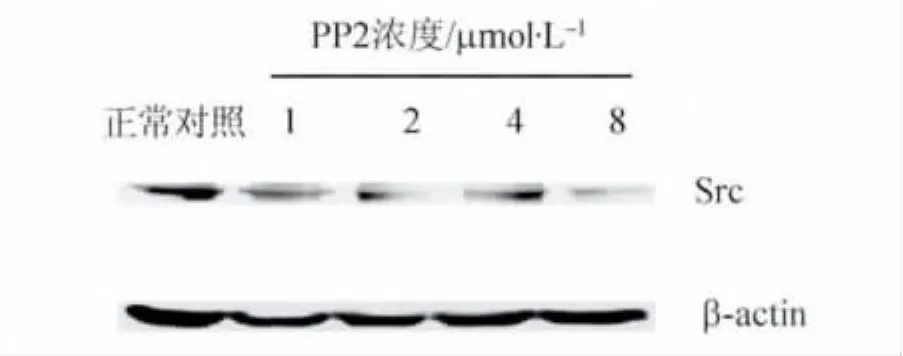
图4 不同浓度PP2作用后乳腺癌细胞Hs578T Src激酶表达 Western blot法检测结果Fig.4 Effect of PP2 with different concentrations on the expression of Src kinase of breast cancer cell Hs578T
进一步观察8 μmol/L PP2预处理Hs578T细胞不同时间对Src激酶表达的影响。结果显示,用8 μmol/L 预处理Hs578T 细胞6 h、12 h 和24 h,可以减少Src激酶表达(图5)。8 μmol/L PP2作用细胞6、12、24 h后,其Src激酶表达与β-actin 比值分别为 0.82 ±0.03、0.66 ±0.08、0.59±0.09,与对照组比较差异有统计学意义(P<0.01);且PP2长时间作用与短时间作用后差异均有统计学意义(P<0.05~0.01)。

图5 8 μmol/L PP2作用不同时间后乳腺癌细胞 Hs578TSrc激酶表达Western blot法检测结果Fig.5 Effect of PP2 with 8 μmol/L on the expression of Src kinase in breast cancercells Hs578T fordifferent duration
3 讨论
在肿瘤细胞中,缝隙连接功能增强对于抗肿瘤药物具有一定的增效作用,而Src激酶对缝隙连接功能则有抑制作用。本研究探讨了Src激酶的强选择性抑制剂PP2[6-7]对乳腺癌细胞Hs578T的缝隙连接功能的影响及可能机制。对缝隙连接功能的研究常用的方法是划痕法,但此法只可进行定性研究,而荧光示踪法则可对缝隙连接功能进行较为准确的定量研究[2],所以本研究采用荧光示踪法研究了 Src激酶抑制剂PP2对Hs578T细胞中缝隙连接功能的影响,并采用Western blotting法检测Src激酶的表达情况以探讨其可能机制。为筛选出本身对肿瘤细胞生长增殖无明显影响的PP2的浓度,为后续通过增强缝隙连接功能而增敏抗肿瘤药的抗肿瘤作用研究提供依据,先观察了PP2对乳腺癌Hs578T细胞生长曲线的影响。结果表明,PP2浓度在1~8 μmol/L时,对于乳腺癌细胞生长几无影响。进一步的研究发现该浓度范围的PP2可以显著增强Hs578T细胞的缝隙连接功能,同时显著降低Hs578T细胞中Src激酶的表达,因此可以推测 PP2对Hs578T细胞的缝隙连接功能的增强作用可能与其降低Hs578T细胞中Src激酶的表达有关。
目前认为Src激酶可以通过以下几种途径来影响细胞的缝隙连接功能:(1)影响作用于缝隙连接通道功能的蛋白质的表达;(2)作用于蛋白激酶C(PKC)、丝裂原活化蛋白激酶(MAPK)等,进而使连接蛋白磷酸化,抑制缝隙连接通道功能;(3)直接磷酸化连接蛋白连接蛋白43[7-8]。(4)Src通过下游的 Cas阻断缝隙连接功能[8]。本研究Western blot结果提示,PP2可能通过直接抑制Src激酶的表达来间接调控Hs578T细胞之间的缝隙连接功能,但Src激酶调控缝隙连接功能的具体机制尚有待探讨。
文献报道,缝隙连接能显著增强顺铂的细胞毒性[9];此外,缝隙连接功能增强时也可促进依托泊苷引起的成胶质瘤细胞凋亡[10]。Kashiwagi[11]报道,Src 激酶抑制剂 Su6656 可以显著增强顺铂在H28细胞中的细胞毒性。PP2是一种强选择性的Src激酶抑制剂,本研究结果表明:PP2在乳腺癌细胞中可以显著增强细胞的缝隙连接功能。因此我们推测,作为Src激酶的特异性抑制剂PP2可能会通过增强缝隙连接功能而增强化学药物的抗乳腺癌作用,该研究将为乳腺癌的治疗提供一个新的思路。
[1]WILLECKE K,EIBERGER J,DEGEN J,et al.Structural and functional diversity of connexin genes in the mouse and human genome[J].Biol Chem,2002,383(5):725-737.
[2]TONG Xuhui,DONG Shuying,JIANG Guojun,et al(童旭辉,董淑英,蒋国君,等).Influence of Cx26/Cx32 gap junction channel on antineoplastic effect of etoposide in Hela cells[J].Journal of Southern Medical University(南方医科大学学报),2012,32(3):329-332.(in Chinese)
[3]JIANG Guojun,TONG Xuhui,ZHU Xiaoguang,et al(蒋国君,童旭辉,祝晓光,等).Influence of expression of Cx43 in breast cancer cells Hs578T on the cytotoxicity ofadriamycin [J].Chinese Pharmacological bulletin(中国药理学通报),2012,28(5):641-647.(in Chinese)
[4]SUMMY J M,GALLICK G E.Src family kinases in tunor progression and metastasis[J].Cancer Metastusis Rev,2003,22(4):337-358.
[5]SHEN Y,KHUSIAL P R,LI X,et al.SRC utilizes Cas to block gap junctional communication mediated by connexin43 [J].J Biol Chem,2007,282(26):18914-18921.
[6]SELTANA A,GUEZGUEA A,LEPAGE M,et al.Src family kinase inhibitor PP2 accelerates differentiation in human intestinal epithelial cells[J].Biochem Biophys Res Commun,2013,430:1195-1200.
[7]SOLAN J L,LAMPE P D.Connexin phosphorylation as a regulatory event linked to gap junction channel assembly[J].Biochim Biophys Acta,2005,1711(2):154-163.
[8]PAHUJAA M,ANIKINM,GOLDBERGGS.Phosphorylation of connexin43 induced by Src:Regulation of gap junctional communication between transformed cells [J].Experimental Cell Research,2007,313(20):4083-4090.
[9]HE B,TONG X H,WANG L Z,et al.Tramadol and flurbiprofen depress the cytotoxicity of cisplatin via their effects on gap junctions[J].Clin Cancer Res,2009,15(18):5803-5810.
[10]HUANG R P,HOSSAIN M Z,HUANG R,et al.Connexin 43(cx43)enhances chemotherapyinduced apoptosis in human glioblastoma cells.[J].Int J Cancer,2001,92(1):130-138.
[11]KASHIWAGI K,VIRGONA N,YAMADA J,et al.Bowman-Birk protease inhibitorfrom soybeans enhances cisplatin-induced cytotoxicity in human mesothelioma cells[J].Exp Ther Med,2011,2(4):719-724.
