125I粒子短时低剂量率照射对胰腺癌Capan-2细胞神经浸润的影响
2013-10-19司佩任路筝刘岩马建霞吴洪玉李兆申
司佩任 路筝 刘岩 马建霞 吴洪玉 李兆申
·论著·
125I粒子短时低剂量率照射对胰腺癌Capan-2细胞神经浸润的影响
司佩任 路筝 刘岩 马建霞 吴洪玉 李兆申
目的观察125I粒子短时低剂量率照射对胰腺癌Capan-2细胞神经浸润的影响,并探讨其分子机制。方法建立胰腺癌Capan-2细胞和大鼠背根神经节(DRG)共培养及Capan-2或DRG单培养模型。通过125I粒子低剂量率照射平板对3种模型进行照射,以相应未照射模型作为对照。倒置显微镜下观察癌细胞、DRG的生长,图像分析软件计算神经突和癌细胞集落占据的表面积,ELISA法检测细胞培养上清液和基质胶溶解液中神经生长因子(NGF)及转化生长因子α(TGF-α)浓度, RT-PCR法检测胰腺癌Capan-2细胞神经营养因子-3 (NT-3)mRNA表达。结果共培养模型中DRG发出的神经突向癌细胞定向、集中生长,而癌细胞沿神经突的方向生长。经125I粒子照射后这种定向、集中和互逆的生长受到一定程度的抑制。共培养组第5天所增加的神经突表面积为290.15±12.08,较DRG单培养组的124.83±6.96显著增加(P<0.01),经照射后的神经突表面积减少到201.53±12.20(P<0.01);所增加的Capan-2细胞表面积为300.47±12.99,较Capan-2细胞单培养组的199.30±8.60显著增加(P<0.01),经照射后的Capan-2细胞表面积减少到202.35±7.97(P<0.01)。共培养组不表达NT-3 mRNA,经照射后NT-3mRNA表达量为0.68±0.04(P<0.05)。共培养组培养上清液中NGF及TGF-α浓度分别为(27.56±13.73)、(40.86±20.73)ng/ml,经照射后分别升高到(94.98±33.80)、(157.54±83.76)ng/ml,差异有统计学意义(P<0.05或<0.01)。共培养组基质胶溶解液中NGF及TGF-α浓度分别为(60.42±33.03)、(64.39±21.52)ng/ml,经照射后分别升高到(132.52±53.01)、(138.38±83.58)ng/ml,其中NGF的差异有统计学意义(P<0.05)。结论125I粒子短时低剂量率照射可以抑制胰腺癌和神经的交互作用,其机制可能与癌细胞促神经浸润介质NGF、TGF-α和NT-3等表达上调有关。
胰腺肿瘤; 碘同位素; 小剂量照射; 肿瘤浸润
胰腺癌远处转移扩散的途径包括血管、淋巴管和神经浸润,其中周围神经浸润(perineural invasion, PNI)是被广泛接受的特殊扩散途径[1]。极高频率的PNI(90%,甚至100%)[1-3]是胰腺癌的特征。最初的胰腺内PNI可能引起胰腺外神经丛浸润,是持续胰腺外播散和术后复发的主要原因[4]。最近的研究[5-7]证实,PNI可能涉及肿瘤细胞和神经元之间相互的趋向性和旁分泌的交互作用。
胰腺癌内放疗治疗是通过置入瘤内的放射性粒子持续释放射线来达到最大限度地杀伤肿瘤细胞的作用。目前文献报道[8-9],采用内镜超声(EUS)引导下穿刺等方式植入放射性粒子治疗不能手术的中晚期胰腺癌是安全有效的,可明显改善患者生活质量,尤其可以缓解患者的疼痛反应。胰腺癌疼痛的发生多与其嗜神经特性有关。为此,本研究用高神经转移的胰腺癌细胞Capan-2和大鼠背根神经节(dorsal root ganglion,DRG)构建共培养体,观察125I粒子短时低剂量照射对胰腺癌细胞、DRG生长及培养上清中PNI相关细胞因子含量的影响,探讨胰腺癌细胞PNI的分子机制。
材料和方法
一、胰腺癌细胞神经浸润的体外模型建立
4只SD雄性大鼠由第二军医大学实验中心提供,动物许可证号SCXK(沪)2012-0003,清洁级,体质量80 g左右。参照文献[5]用CO2将大鼠安乐死,75%乙醇消毒。在无菌条件下切除胸和腰段的DRGs,置RPMI培养液中备用。
胰腺癌细胞株Capan-2购自ATCC(American type cultrue collection),常规培养、传代。参照文献[5]把100 μl EHS基质胶(BD Biosciences公司)加进置于冰上(为保持基质胶的流动性)的直径3.5 cm的细胞培养皿中央,放入1枚DRG,再种植105个Capan-2细胞,置细胞培养箱中加温到37℃,使细胞和DRG固化在基质胶中。同时制作单独种植Capan-2或DRG的培养皿。然后在培养皿中加入含有10%热灭活的胎牛血清(GIBCO公司)、100 U/ml青霉素、100 μg/ml链霉素的RPMI-1640培养液(GIBCO公司)。
二、125I粒子短时低剂量率照射模型建立
参照文献[10]设计。用5 cm直径的细胞培养皿灌注石蜡,晾干后制作照射平板。在3 cm直径的圆周线找出8个等距离的点,在这8个点和圆心处刻出直径6 mm的凹槽。把9颗1.0 mCi的125I粒子分别置入9个凹槽内,制成照射平板。将上述制作的3种体外模型培养皿分别放在照射装置的中央,置入专用的细胞培养箱中常规培养,总照射剂量为2 Gy。为避免各培养皿放射线的互相干扰,每个125I粒子照射装置用金属隔板隔开。以上述制作的3种体外模型培养皿放入普通培养箱内培养作为相应对照组。培养第3、5天在倒置显微镜下观察各组Capan-2细胞、DRGs的形态并摄像,应用图像分析软件Image pro-plus 5.0计算DRG发出的神经突和选定区域的Capan-2细胞集落占据的表面积。照射第5天收集培养液上清,应用基质胶溶解剂(BD Biosciences公司)试剂盒将基质胶溶解并收集基质胶溶解液,收集从基质胶溶解液中分离出的Capan-2细胞和DRGs。实验期间避免放射污染,凡是涉及接触放射源的步骤均用铅衣、铅眼镜、铅围脖和铅手套防护。
三、人神经生长因子(NGF)、转化生长因子α(TGF-α)检测
应用NGF、TGF-α的ELISA试剂盒(Westang公司)检测收集的细胞培养上清液和基质胶溶解液内NGF、TGF-α含量,按试剂盒说明书操作。通过试剂盒携带的NGF或TGF-α标准品绘制标准曲线,计算样本中NGF、TGF-α浓度。
四、Capan-2细胞神经营养因子3(NT-3)mRNA表达的检测
收集各组用基质溶解剂后分离出来的Capan-2细胞,用预冷的PBS洗涤3次,应用Trizol 试剂(Invitrogen公司)提取细胞总RNA。采用逆转录试剂盒(Takara公司)合成cDNA。RT反应条件:37℃ 15 min,85℃ 5 s。采用RT-PCP法检测NT-3 mRNA的表达。引物通过Primer Premier 5.0软件设计,NT-3引物上游为5′-AAGTCATCGGCCATCGACA-3′, 下游为5′-TCAGTGCTCGGACGTAGGTT-3′,扩增片段200 bp;内参GAPDH引物上游为5′-GCACCGTCAAGGCTGAGAAC-3′,下游为5′-ATGGTGGTGAAGACGCCAGT-3′,扩增片段142 bp。引物均由上海英俊生物工程技术有限公司合成。PCR反应条件: 94℃ 4 min,94℃ 45 s、58℃ 45 s、72℃ 45 s,35个循环,最后72℃延伸10 min。PCR扩增产物经琼脂糖凝胶电泳分离,ImageJ软件扫描,以目的条带与内参条带的灰度比值表示mRNA的表达量。每组实验重复3次,取均值。
五、统计学分析
结 果
一、各组Capan-2细胞和神经突的生长状况
在共培养模型可以观察到DRG与Capan-2细胞之间定向、集中和互逆的生长,即DRG发出的神经突向癌细胞定向、集中生长,而癌细胞沿神经突的方向生长。经125I粒子持续低剂量率照射后这种定向、集中和互逆的生长虽仍存在,但其趋势受到一定程度的抑制(图1)。
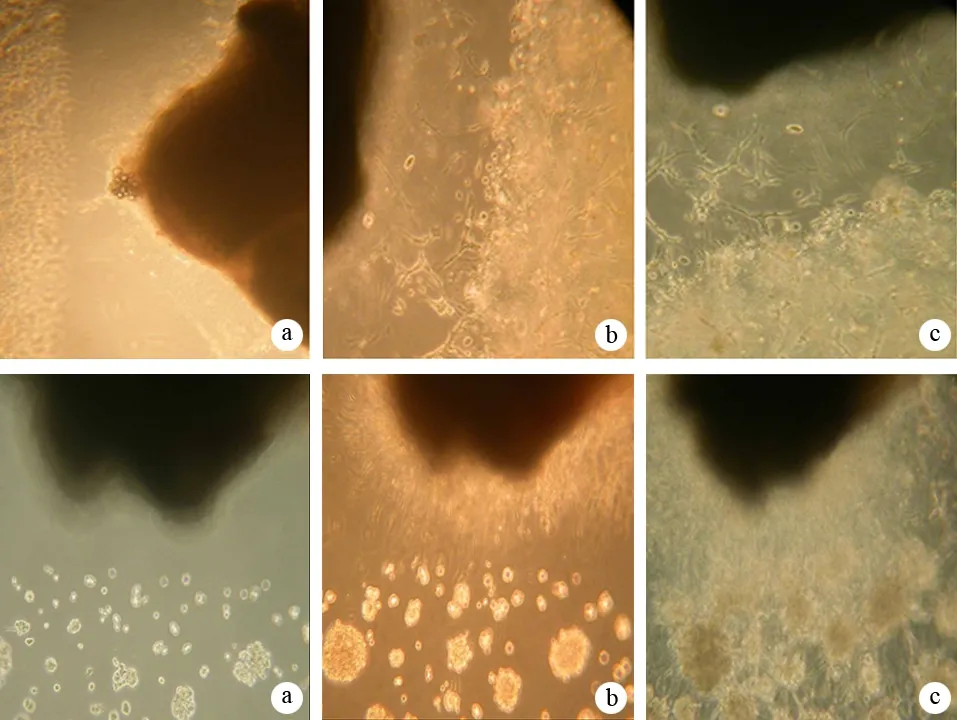
图1共培养照射组(上)和未照射组(下)在第1(a)、3(b)、5(c)天的细胞和神经突生长
DRG和Capan-2共培养组在培养第3、5天所增加的神经突表面积分别为182.15±10.05、290.15±12.08,而DRG单培养组所增加的神经突表面积分别为82.08±3.48、124.83±6.96,共培养组显著大于相应时间的DRG单培养组(t值分别为23.044、29.056,P值均<0.01)。经125I粒子照射后,共培养组所增加的神经突表面积分别为128.30±10.02、201.53±12.20,均显著低于相应时间的共培养未照射组(t值分别为9.294、12.644,P值均<0.01)。
DRG和Capan-2共培养组在培养第3、5天所增加的Capan-2细胞表面积分别为162.93±6.96、300.47±12.99,而Capan-2细胞单培养组所增加的Capan-2细胞表面积分别为112.08±10.55、199.30±8.60,共培养组显著大于相应时间的Capan-2细胞单培养组(t值分别为90.855、15.901,P值均<0.01)。经125I粒子照射后,共培养组所增加的Capan-2细胞表面积分别为95.12±4.83、202.35±7.97,均显著低于相应时间的共培养未照射组(t值分别为19.610,16.116,P值均<0.01)。
二、各组Capan-2细胞NT-3 mRNA表达的变化
DRG和Capan-2共培养照射组NT-3 mRNA表达量为0.68±0.04,而共培养未照射组不表达NT-3 mRNA,差异有统计学意义(t=5.66,P<0.05)。Capan-2细胞单培养照射组NT-3 mRNA表达量为0.71±0.04,较单培养未照射组的0.57±0.03明显上调,差异有统计学意义(Z=2.882,P<0.05,图2)。

图2Capan-2细胞单培养未照射组(1)和照射组(2)及共培养未照射组(3)和照射组(4) NT-3 mRNA的表达
三、各组Capan-2细胞培养上清和基质胶溶解液中NGF浓度的变化
DRG和Capan-2共培养照射组的培养上清中NGF浓度为(94.98±33.80)ng/ml,较共培养未照射组的(27.56±13.73)ng/ml显著升高,差异有统计学意义(t=4.132,P<0.01)。Capan-2细胞单培养照射组的培养上清中NGF浓度为(24.62±10.10)ng/ml,单培养未照射组为(38.89±10.60)ng/ml,差异无统计学意义(t=2.182,P=0.06)。
DRG和Capan-2共培养照射组的基质胶溶解液中NGF浓度为(132.52±53.01)ng/ml,较共培养未照射组的(60.42±33.03)ng/ml显著升高,差异有统计学意义(t=2.581,P<0.05)。Capan-2细胞单培养照射组的基质胶溶解液中NGF浓度为(56.59±8.15)ng/ml,单培养未照射组为(57.81±3.12)ng/ml,差异无统计学意义(t=0.410,P=0.890)。
四、各组Capan-2细胞培养上清和基质胶溶解液中TGF-α浓度的变化
DRG和Capan-2共培养照射组的培养上清中TGF-α浓度为(157.54±83.76)ng/ml,较共培养未照射组的(40.86±20.73)ng/ml显著升高,差异有统计学意义(t=2.704,P<0.05)。Capan-2细胞单培养照射组培养上清中TGF-α浓度为(54.80±34.71)ng/ml,单培养未照射组为(105.21±21.97)ng/ml,差异无统计学意义(t=2.454,P=0.05)。
DRG和Capan-2共培养照射组基质胶溶解液中TGF-α浓度为(138.38±83.58)ng/ml,共培养未照射组为(64.39±21.52)ng/ml,差异无统计学意义(t=1.917,P=0.09)。Capan-2细胞单培养照射组基质胶溶解液中TGF-α浓度为(157.71±39.57)ng/ml,较单培养未照射组的(83.39±26.69)ng/ml显著升高,差异有统计学意义(t=3.359,P<0.05)。
讨 论
以前的研究多用前列腺癌细胞与DRG共培养证实肿瘤细胞沿神经节起源的神经突移行,神经突集中、定向性向肿瘤细胞集落外生长[5]。同样,胰腺癌细胞与DRG共培养模型中,肿瘤细胞在移行前经历早期形态学改变和神经细胞的神经突定向朝向癌细胞生长,最终导致移行细胞成簇围绕在神经节周围[6-7]。这些发现提示神经元与癌细胞之间存在互惠的交互作用,这种交互作用有助于肿瘤细胞的增殖和抑制凋亡,并有利于神经生长。
神经营养因子家族(NTs)包括NGF、NT-3等,在胰腺癌的发生和演进过程中发挥重要作用,包括刺激趋化性、肿瘤侵袭性、克隆增生、各种肿瘤细胞的形态学改变等[4]。
NGF在胰腺癌细胞系中过表达,其受体trkA在周围神经的神经束膜上强表达,NGF与trkA相互作用调节神经浸润[6]。NT-3在胰腺癌标本中过表达,刺激肿瘤细胞浸润[11]。表皮生长因子受体(EGFR)和TGF-α在有胰腺癌细胞的组织中大量表达,神经也产生TGF-α,TGF-α和EGFR相互作用触发一系列增强细胞增殖的事件,与胰腺癌的神经浸润有关[12]。
针对胰腺癌细胞与神经节之间互惠的交互作用,以及这些与胰腺癌神经浸润有关的因子,本研究结合文献资料[5,10]构建了一个新的125I籽源短时间低剂量率照射干预胰腺癌神经浸润的体外模型,用125I籽源短时间低剂量率持续照射(总照射剂量为2 Gy)的方法干预胰腺癌细胞与神经的交互作用,观察癌细胞与神经突的生长和形态变化, 以及NGF、NT-3和TGF-α表达的改变。结果发现,125I籽源短时间低剂量率持续照射后在形态学和生物学行为上抑制胰腺癌细胞和神经之间的交互作用,使癌细胞向神经突的生长和移行减缓。但在共培养模型培养上清液和基质胶溶解液中,照射组的NGF和TGF-α浓度高于未照射对照组,且照射组胰腺癌细胞NT-3 mRNA的表达显著上调,提示125I籽源短时间低剂量率持续照射可能增强胰腺癌细胞的侵袭性,与Ohuchid等[13]的研究一致。他们把照射过的成纤维细胞与胰腺癌细胞共培养,可刺激成纤维细胞分泌MMP-2,增强肿瘤细胞的侵袭力,但使胰腺癌细胞的移行能力减弱,这也可以解释本研究在体外模型中看到的现象,即神经节与癌细胞的互逆生长明显减弱。
以前的研究认为,放疗可作为很多恶性肿瘤主要的一种辅助治疗。应用于胰腺癌患者放疗的原理是基于放射能抑制体外细胞增殖或使凋亡的细胞死亡,并抑制体内肿瘤的生长[14]。然而,近来很多证据显示放射通过激活与肿瘤浸润和转移有关的众多途径促进癌细胞的恶性行为[15-17]。此现象可能由于多为体外实验,与体内肿瘤生长的微环境不同,导致对照射的反应不同。其次实验多为短时低剂量率照射,照射时间及剂量是否充分也是值得考虑的问题。因此深入研究125I粒子短时低剂量率照射干预胰腺癌的分子机制显得尤为重要。
[1] Kayahara M, Nakagawara H, Kitagawa H, et al. The Nature of Neural Invasion by Pancreatic Cancer. Pancreas, 2007, 35:218-223.
[2] Spinelli GP, Zullo A, Romiti A, et al.Long-term survival in metastatic pancreatic cancer. A case report and review of the literature.JOP, 2006, 7:486-491.
[3] Beard CJ, Chen MH, Cote K, et al. Perineural invasion is associated with increased relapse after external beam radiotherapy for men with low-risk prostate cancer and may be a marker for occult, high-grade cancer. Int J Radiat Oncol Biol Phys, 2004, 58: 19-24.
[4] Liebig C, Ayala G, Wilks JA,et al. Perineural invasion in cancer: a review of the literature. Cancer, 2009,115:3379-3391.
[5] Ayala GE, Wheeler TM, Shine HD, et al. In vitro dorsal root ganglia and human prostate cell line interaction: redefining perineural invasion in prostate cancer. Prostate, 2001, 49: 213-223.
[6] Dai H, Li R, Wheeler T, et al. Enhanced survival in perineural invasion of pancreatic cancer: an in vitro approach. Hum Pathol, 2007, 38:299-307.
[7] Ceyhan GO, Demir IE, Altintas B, et al. Neural invasion in pancreatic cancer: a mutual tropism between neurons and cancer cells. Biochem Biophys Res Commun, 2008, 37:442-447.
[8] Jin Z, Du Y, Li Z, et al. Endoscopic ultrasonography-guided interstitial implantation of iodine 125 seeds combined with chemotherapy in the treatment of unresectable pancreatic carcinoma: a prospective study, Endoscopy, 2008, 40:314-320.
[9] Wang K, Jin Z, Du Y, et al. EUS-guided celiac ganglion irradiation with iodine-125 seeds for pain control in pancreatic carcinoma: a prospective pilot study. Gastrointest Endosc, 2012, 76:945-952.
[10] Aird EG,Folkard M,Mayes CR,et al.A purpose-built iodine 125 irradiation plaque for low dose rate low energy irradiation of celllines in vitro. Br J Radiol, 2001,74:56-61.
[11] Okada Y, Eibl G, Guha S, et al. Nerve growth factor stimulates MMP-2 expression and activity and increases invasion by human pancreatic cancer cells. Clin Exp Metastasis, 2004, 21: 285-292.
[12] Farrow B, Albo D, Berger DH. The role of the tumor microenvironment in the progression of pancreatic cancer. J Surg Res, 2008,149:319-328.
[13] Ohuchida K, Mizumoto K, Murakami M, et al. Radiation to stromal fibroblasts increases invasiveness of pancreatic cancer cells through tumor-stromal interactions.Cancer Res, 2004, 64:3215-3222.
[14] Nakagawara A. Trk receptor tyrosine kinases: a bridge between cancer and neural development. Cancer Lett, 2001, 169:107-114.
[15] Sakamoto Y, Kitajima Y, Edakuni G, et al. Expression of Trk tyrosine kinase receptor is a biologic marker for cell proliferation and perineural invasion of human pancreatic ductal adenocarcinoma. Oncol Rep, 2001, 8:477-484.
[16] Bouzas-Rodriguez J,Cabrera JR, Delloye-Bourgeois C,et al.Neurotrophin-3 production promotes human neuroblastoma cell survival by inhibiting TrkC-induced apoptosis.J Clin Invest, 2010, 120:850-858.
[17] Meirovitz A, Hermano E, Lerner I, et al. Role of heparanase in radiation-enhanced invasiveness of pancreatic carcinoma. Cancer Res, 2011,71:2772-2780.
EffectofIodine125seedsshorttimelowdoserateirradiationonperineuralinvasioninpancreaticcancerCapan-2cells
SIPei-ren,LUZheng,LIUYan,MAJian-xia,WUHong-yu,LIZhao-shen.
DepartmentofGastroenterology,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
LIZhao-shen,Email:zhsli@81890.net
ObjectiveTo investigate the effect of Iodine 125 seeds short time low dose rate irradiation on perineural invasion (PNI) in pancreatic cancer Capan-2 cells, and explore its molecular mechanism.MethodsThe co-culture model was established by co-culturing the dorsal root ganglion (DRG) of SD rat and Capzn-2 cells line , while Capan-2 culture model and DRG culture model was also established. Iodine 125 seeds short time low dose rate irradiation tablet was used for the 3 models, and the model without irradiation was used as control. Cancer cell and DRG growth was observed under inverted microscopy, surface of neurite and cell colony growth was determined by image analysis software. The concentration of nerve growth factor (NGF), transforming growth factor-α (TGF-α) in cell culture supernatant and matrigel solution was tested by ELISA, and the expression of neurotrophin-3 (NT-3) mRNA was detected by semi-quantitative reverse transcriptase polymerase chain reaction (RT-PCR).ResultsIn the co-culture model, neurite of DRG showed a direction to cancer cells and had a concentrated growth towards cancer cells. And Capan-2 cells formed more colonies towards neurite. However, in irradiation groups, the symbiotic phenomenon was inhibited to some degree. Increased surface of neurite in co-culture model at 5th day was 290.15±12.08, which was significantly higher than that in DRG group (124.83±6.96,P<0.01), but the surface of neurite was decreased to 201.53±12.20 after irradiation (P<0.01). Increased surface of Capan-2 cell was 300.47±12.99, which was significantly higher than that in Capan-2 group (199.30±8.60,P<0.01 ), but the surface of Capan-2 was decreased to 202.35±7.97 after irradiation (P<0.01). NT-3 mRNA was seldom or not expressed in supernatant of co-culture model, but it was strongly expressed (0.68±0.04) after irradiation (P<0.05). The concentration of NGF and TGF-α in supernatant of co-culture model were (27.56±13.73), (40.86±20.73)ng/ml, after irradiation they were increased to (94.98±33.80), (157.54±83.76)ng/ml, and the difference between the two groups was statistically significant (P<0.05 or <0.01). The concentration of NGF and TGF-α in matrigel lysate of co-culture model were (60.42±33.03), (64.39±21.52)ng/ml, after irradiation they were increased to (132.52±53.01), (138.38±83.58)ng/ml, and the difference of NGF concentration between the two groups was statistically significant (P<0.05).ConclusionsIodine-125 seeds short-time low-dose rate irradiation could inhibit interactions between nerve and Capan-2 cells, and the mechanism may be related to up-regulation of cancer cells perineural invasion promoter NGF, TGF-α and NT-3.
Pancreatic neoplasms; Iodine isotopes; Low-level irradiation; Neoplasm invasiveness
2013-07-10)
(本文编辑:屠振兴)
10.3760/cma.j.issn.1674-1935.2013.06.001
国家自然科学青年基金(30801362)
264002 山东烟台,解放军107医院(司佩任);第二军医大学长海医院消化内科(路筝、刘岩、马建霞、吴洪玉、李兆申)
李兆申,Email:zhsli@81890.net
共同第一作者:吴洪玉
