依达拉奉对机械通气所致大鼠急性肺损伤的保护作用
2013-10-17钟和英顾俊峰余开锋
付 俊 钟和英 郑 敏 冉 然 肖 昀 顾俊峰 余开锋
湖北医药学院附属人民医院麻醉科,湖北十堰 442000
呼吸机相关性肺损伤(ventilation-induced lung injury,VILI)是机械通气的常见并发症,由于发病机制不清楚,目前临床上缺乏有效的治疗手段。近些年的研究发现,氧化应激在呼吸机相关性肺损伤的发生中具有十分重要的作用[1]。氧化应激状态下直接或间接产生的活性氧族(ROS)和活性氮族(NOS)介导了各种炎症损伤,羟自由基(·OH)是ROS中化学性质最活泼的基团,在诱导生物氧化应激损伤中具有十分重要的作用[2-3]。依达拉奉是一种新合成的自由基清除剂,可以选择性的清除羟自由基,具有抗炎和抗氧化作用,研究发现,其在对缺血再灌注损伤[4-5]、内毒素(LPS)[6]和博莱霉素[7-8]诱发的肺损伤有潜在的治疗作用中,具有明显的保护作用,但其在呼吸机相关性肺损伤中的治疗却很少有研究涉及。本研究探讨依达拉奉对大鼠呼吸机相关肺损伤的影响,旨在为呼吸机相关性肺损伤寻找新的更有效的治疗方法。
1 材料与方法
1.1 材料
戊巴比妥钠(美国Sigma公司);依达拉奉注射液(四川升和制药有限公司,批号52028303);多克隆抗鼠NF-κB亚基P65抗体(美国Santa Cruz公司);髓过氧化物酶(MPO)、丙二醛(MDA)、超氧化物歧化酶(SOD)试剂盒(南京建成生物工程研究所);LaminB1抗体(美国Santa Cruz公司);Western blot全套系统(美国 Bio-Rad公司),Imager 5500凝胶成像仪(美国Alpha公司)。
1.2 方法
1.2.1 模型制备及标本收集 清洁级雄性SD大鼠24只,体重280~320 g,由湖北医药学院实验动物中心提供,随机分为 3 组(n=8):对照组(C 组)行常规潮气量(VT=8 mL/kg)机械通气4 h;大潮气量组(MV组)行大潮气量(40 mL/kg)机械通气4 h,呼吸频率40次/min,氧浓度21%,呼气末正压通气(PEEP)=0 cm H2O(1 cm H2O=0.098 kPa); 大潮气量+依达拉奉组(E组)经股静脉注射0.2%的依达拉奉(批号:H20031342,先声制药,江苏)15 mg/kg后 30 min 行大潮气量机械通气,参数设定同MV组。C组和MV组于上述相应时间点经股静脉注射等量生理盐水。MV组和E组大鼠腹腔注射20%乌拉坦1.3 g/kg麻醉后,直视下应用额镜经口气管插管(16G×211的静脉套管针代替气管导管),口腔填塞细纱布条以防止漏气,连接683型小动物容量控制呼吸机(Harvard Apparatus公司,美国)机械通气,调节潮气量40 mL/kg,呼吸频率40次/min,氧浓度 21%,PEEP=0 cm H2O,通气时间4 h。以24G动脉穿刺针行股静脉置管,静脉输注乳酸钠林格液3 mL/h。以24G动脉穿刺针行颈动脉置管,由1205A监护仪(HP公司,美国)监测心率和平均动脉压。整个过程大鼠保持仰卧位,通气结束后颈动脉放血处死大鼠。动物处死后立即开胸,分离右肺上叶,滤纸吸干肺表面水分,精确称重后,置于70℃烤箱烘烤至恒重,计算肺湿/干重比(W/D)。取部分右肺下叶,4%多聚甲醛浸泡,持续真空抽吸至沉淀固定,经HE染色后,光镜下观察病理学。剩余新鲜肺组织液氮速冻,锡纸包裹后置于-80℃冰箱中保存以制备组织匀浆。
1.2.2 检测指标及方法 ①肺组织匀浆中检测指标:采用比色法测定MPO,硫代巴比妥酸法测定MDA;黄嘌呤氧化酶法测定SOD,具体步骤按试剂盒说明书进行。②肺组织W/D测定:取右肺上叶,滤纸吸干肺表面水分,精确称重后,置于70℃烤箱烘烤至恒重,计算肺湿/干重比(W/D)。③肺组织病理观察:留取右肺下叶,4%多聚甲醛浸泡固定48 h,常规脱水,透明,浸腊,包埋,切片机常规切成5 μm的石蜡切片,HE染色,光镜下观察组织病理形态变化。④肺组织NF-κB p65蛋白的表达:采用Western blot法测定肺组织细胞核NF-κB p65蛋白的表达,以表示NF-κB的活性。称取液氮冻存的肺组织100 mg,加入细胞核蛋白蛋白抽提试剂1 mL,提取核蛋白。将样品蛋白和2×样品缓冲液以1∶1混匀,100℃煮沸5 min,冷却后依次加到样品槽中。在稳压状态下SDS-聚丙烯酰胺凝胶电泳,以200 mA恒流电泳2 h转移至硝酸纤维素膜。转移膜用封闭液在室温下封闭2 h。洗膜后用多克隆兔抗鼠NF-κB亚基P65抗体(1∶500,Santa Cruz公司,美国)孵育过夜,洗膜后用辣根过氧化物酶标记山羊抗兔的IgG二抗(1∶5000,福州迈新生物技术公司产品)室温孵育2 h。ECL化学发光法检测阳性信号,内参为LaminB1。采用光密度扫描仪计算积分光密度,取与LaminB1的比值反映肺组织细胞核NF-κB p65蛋白的相对水平。
1.3 统计学方法
采用SPSS 19.0软件进行数据统计学处理分析,计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织病理形态学变化
C组肺组织结构完整,肺泡壁光滑,肺泡间隔薄,且均匀一致,肺泡腔中无渗出液。MV组肺泡间隔水肿增厚,肺泡腔内可见明显的出血、渗出,间质水肿以及中性粒细胞浸润,部分肺泡萎陷不张;与MV组相比,E组中肺组织肺泡间隔清晰,肺泡腔内的出血、渗出以及中性粒细胞浸润显著减轻。见图1~3。

2.2 肺组织W/D、匀浆中MPO和MDA含量、SOD活性的变化
机械通气4 h后,MV组和E组大鼠肺组织W/D、MPO、MDA含量显著高于C组(P<0.05),SOD活性较C组明显降低(P<0.05);机械通气 4 h后,E组 W/D、MPO、MDA含量显著低于MV组(P<0.05),SOD活性显著高于MV 组(P <0.05)。 见表1。

表1 肺组织W/D、MPO和MDA含量、SOD活性的变化(±s,n=8)

表1 肺组织W/D、MPO和MDA含量、SOD活性的变化(±s,n=8)
注:与 C组比较,*P<0.05;与MV 组比较,#P<0.05;MPO:髓过氧化物酶;MDA:丙二醛;SOD:超氧化物歧化酶;W/D:肺湿/干重比
SOD/mg prot)E组5.7±0.42.36±0.152.93±0.30 94.3±10.5 47.8±9.8*72.6±10.3*#
2.3 肺组织NF-κB p65蛋白的表达
机械通气4 h后,MV组肺组织核蛋白NF-κB p65蛋白的表达显著高于C组(P<0.05);机械通气4 h后,E组肺组织核蛋白NF-κBp65蛋白的表达显著低MV组(P<0.05)。见图4。
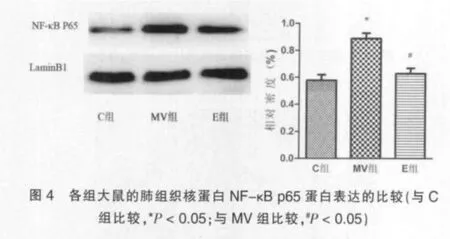
3 讨论
机械通气在ICU危重患者抢救中具有无可替代的作用。在ICU的患者中,30%的患者需要进行机械通气。自Webb等[9]于1974年首次提出VILI以来,众多学者从人类研究、动物模型、离体器官和细胞学等多个方面来探索机械通气肺损伤的发病机制,其中VILI动物模型研究最能体现机械刺激引起的肺部改变在整个机体环境中的发展变化。目前认为大潮气量合并无呼吸末正压(PEEP=0)的通气是复制VILI最简单有效的方法,也是现在最常用的研究VILI的方法。因此,本实验也采用大潮气量机械通气的方法建立VILI模型。在临床上,需要机械通气辅助治疗的患者往往肺部已有严重病变,此类患者肺组织病变程度不均使得患者肺顺应性不一致,机械通气时,顺应性好的肺组织受力大于有病变的肺单位,病变周围正常肺组织遭受的跨肺压约是正常的4.5倍[10]。有研究表明[11],呼吸窘迫综合征患者采用VT 10~12 mL/kg进行机械通气时,对于周围未损伤的肺组织来说,其作用力相当于给予VT 38~50 mL/kg通气时的机械力刺激,极易使正常肺组织受损,导致VILI。大鼠的正常潮气量是7~10 mL/kg[12],接近人类的潮气量。故本实验在参考既往相关的实验研究的基础上[13-15],采用40 mL/kg的潮气量对正常大鼠的肺组织施行机械通气,使其更好地模拟临床上治疗ARDS等肺部有病变患者机械通气诱发的肺损伤的过程,且本实验发现,该潮气量通气4 h后,大鼠的肺组织病理呈现肺水肿等典型的VILI改变,证实了模型的成功。
研究表明,VILI时机体内存在氧化系统和抗氧化系统的失衡[16]。VILI时肺内的ROS主要来源于中性粒细胞和巨噬细胞[16]。生理情况下体内可产生少量活性氧,其具有杀菌、信号转导及维持体内氧化还原的平衡,并可以被体内抗氧化系统所清除,两者之间保持一种动态平衡状态。病理状态下,活化的炎症细胞产生大量的,虽然其活性很弱,但是在SOD的作用下生成H2O2,后者在金属离子(铁离子或铜离子)共同作用下可通过Fenton和Haber-Weiss反应被还原成活性更强和毒性更强的·OH,从而导致机体受损。·OH是化学性质最活泼的活性氧,也是ROS中诱导生物损伤最重要的成分。吞噬细胞中活化的嗜苯胺蓝颗粒可释放MPO,后者也可以作为中性粒细胞浸润的证据。由于氧自由基活性高,性质不稳定,半衰期短,很难直接测量其含量,而通过测量其氧化产物的含量则可间接反映其生成情况。丙二醛(MDA)是氧自由基作用于细胞膜脂质发生过氧化反应的终产物,丙二醛的测定可间接反映体内细胞膜结构受氧自由基攻击的严重程度。SOD是体内最重要的自由基清除酶,其活性变化可反映体内抗氧化功能情况。通过观察SOD和MDA指标的变化,可以反映氧化应激反应的发生程度。本研究中,MV组在机械通气4 h后,肺组织W/D明显高于C组,显微镜下观察可见明显肺损伤,同时肺组织MPO、MDA含量均显著升高,SOD活性显著降低,说明MV组的肺组织中有较多的吞噬细胞浸润,释放大量的ROS引起氧化应激,造成肺损伤。
NF-κB是一种能与多种基因启动子或增强子κB序列(GGGACTTTC)特异结合的核蛋白因子,通常是由p50/p65构成的异源二聚体,其中p65羧基端含有多个反式激活结构域,可调节与免疫、炎症等有关的多种基因表达。在静息状态下,NF-κB与IκB家族中的一个抑制性蛋白相结合,以无活性的形式存在于细胞浆。在前炎症细胞因子、氧化应激、凋亡介质等的刺激下NF-κB抑制因子IκB发生磷酸化而降解,使NF-κB游离、活化并进入细胞核,与不同的靶基因的启动子或增强子内特异的同源结合序列结合,启动和调控参与炎症反应的炎症因子(TNF-α、IL-1β、IL-6、MIP-2、ICAM-1等)的基因表达。反过来,体内增多的炎症介质、ROS等又可以激活NF-κB,形成恶性循环,导致炎症级联扩大。也就是说致病因素激活NF-κB后,引起ROS等释放,ROS又可以正反馈激活NF-κB,造成炎症级联放大,加重肺损。大量的文献显示[17-20]细胞核NF-κB p65的活化在VILI中发挥重要作用。本实验采用Western Blot测定细胞核NF-κB p65蛋白的表达水平,以此反映NF-κB的激活程度。本实验结果显示,与对照组比较,大潮气量组(MV组)细胞核NF-κB p65蛋白的表达水平明显增多,提示NF-κB被激活,除与直接的机械刺激有关,可能还与ROS的产生,进一步激活NF-κB有关。
由于氧化应激在机械通气肺损伤的发病机制中起着重要作用,目前对应用抗氧化剂治疗VILI的研究已成为国内外研究热点之一。既往实验研究显示,N-乙酰半胱氨酸、褪黑素、香荚兰乙酮(NADPH氧化酶抑制剂)、鱼藤酮(线粒体呼吸链复合体Ⅰ抑制剂)、氢气、别嘌呤醇等抗氧化剂在VILI动物模型中具有良好的保护作用,但是遗憾的是这些药物在临床试验中不一定有效。因此寻求新的临床有效治疗VILI的药物迫在眉睫。依达拉奉是目前全球进入三期临床使用的最新型强抗氧化剂,其主要是通过提供电子直接清除·OH、过氧亚硝酸阴离子(ONOO-)、单线态氧(1O2)等强细胞毒性自由基,抑制脂质过氧化。该药具有亲脂性、易渗透入组织、静脉使用后可以保持有效的组织内药物水平等良好的药理性质[21]。参考相关文献[6]报道及预实验结果,笔者选择静脉注射依达拉奉15 mg/kg作为治疗剂量进行实验。本研究发现,依达拉奉干预可以减轻大鼠脓毒性肺损伤病理改变,降低肺组织内MPO、MDA含量和肺组织W/D,增加SOD含量,说明应用依达拉奉后对VILI发挥了保护作用。其可能的机制为通过清除ROS,切断ROS对NF-κB正反馈过程,降低了NF-κB信号转导通路的活化,从而减轻了因NF-κB活化而引起的炎症级联放大效应,达到保护VILI的目的。
[1]Chiang CH,Chuang CH,Liu SL,et al.Apocynin attenuates ventilator-induced lung injury in an isolated and perfused rat lung model[J].Intensive Care Med,2011,37(8):1360-1367.
[2]Reddy SP,Hassoun PM,Brower R,et al.Redox imbalance and ventilator-induced lung injury [J].Antioxid Redox Signal,2007,9(11):2003-2012.
[3]Huang CS,Kawamura T,Peng X,et al.Hydrogen inhalation reduced epithelial apoptosis in ventilator-induced lung injury via a mechanism involving nuclear factor-kappaB activation[J].Biochem Biophys Res Commun,2011,408(2):253-258.
[4]Akao T,Takeyoshi I,Totsuka O,et al.Effect of edaravone on pulmonary ischemia reperfusion injury in dogs [J].Heart Lung Transplant,2006,25(8):965-971.
[5]Qiu W,Gu H,Zheng L,et al.Pretreatmen with edaravone reduces lung mitochondrial damage in an infant rabbit ischemia-reperfusion model[J].Pediatr Surg,2008,(11)43:2053-2060.
[6]Tajima S,Soda M,Bando M,et al.Preventive effects of edaravone,a free radical scavenger,on lipopolysaccharide-induced lung injury in mice[J].Respirology,2008,13(5):646-653.
[7]Asai T,Ohno Y,Minatoguchi S,et al.The specific free radica scavenger edaravone suppresses bleomycin-induced acute pulmonary injury in rabbits[J].Clin Exp Pharmacol Physiol,2007,34(1-2):22-26.
[8]Tajima S,Bando M,Ishii Y,et al.Effects of edaravone on bleomycin induced lung injury in mice [J].Eur Respir,2008,32(5):1337-1343.
[9]Webb HH,Tierney DF.Experimental pulmonary edema due to intermittent positive pressure ventilation with high inflation pressures.Protection by positive end-expiratory pressure [J].Am Rev Respir Dis,1974,110(5):556-565.
[10]James AF,Michael AM.Science review:Mechanisms of ventilator induced lung injury[J].Critical Care,2003,7(3): 233-241.
[11]王月兰,姚尚龙.机械通气对大鼠肺组织早期生长因子-1、C-jun和白介素-1β 表达的影响[J].中华麻醉学杂志,2005,25(11):828-831.
[12]陈孝平.外科常用实验方法及动物模型建立[M].北京:人民卫生出版社,2003:494-495.
[13]Richard JD,Dreyfuss D,Saumon G,et al.Production of inflammatory cytokinesin ventilator-induced lung injury:a reappraisal[J].Am J Respir Crit Care Med,2001,163(5):1176-1180.
[14]Vaneker M,Halbertsma FJ,Egmond VJ,et al.Mechanical ventilation in healthy mice induces reversible pulmonary and systemic cytokine elevation with preserved alveolar integrity:an in vivo model using clinical relevant ventilation settings [J].Anesthesiology,2007,107(3):419-426.
[15]武庆平,刘萍,王立奎,等.不同潮气量通气对大鼠呼吸机相关性肺损伤模型的影响[J].华中科技大学学报:医学版,2006,35(4):511-515.
[16]Reddy SP,Hassoun PM,Brower R,et al.Redox imbalance and ventilator-induced lung injury [J].Antioxid Redox Signal,2007,9(11):2003-2012.
[17]Niitsu T,Tsuchida S,Peltekova V,et al.Cyclooxygenase inhibition in ventilator induced lung injury[J].Anesth Analg,2011,112(1):143-149.
[18]Kim JH,Suk MH,Yoon DW,et al.Inflammatory and transcriptional roles of poly(ADP-ribose)polymerase in ventilator-induced lung injury[J].Crit Care,2008,12(4):108.
[19]Ning Q,Wang X.Role of Rel A and IkappaB of nuclear factor kappaB in the release of interleukin-8 by cyclic mechanical strain in human alveolar type Ⅱ epithelial cells A549[J].Respirology,2007,12(6):792-798.
[20]Jerng JS,Hsu YC,Wu HD,et al.Role of the rennin-angiotensin system in ventilator-induced lung injury:an in vivo study in a rat model[J].Thorax,2007,62(6):527-535.
[21]Minhaz U,Tanaka M,Tsukamoto H,et al.Efect of MCI-186 on postischemic reperfusion injury in isolated rat heart[J].Free Radie Res,1996,24(5):361-367.
