盐度、温度和培育密度对白刺参幼虫生长及存活的影响*
2013-10-16朱厚祥孔令锋王有廷
朱厚祥,孔令锋,李 琪**,王有廷,赵 强
(1.中国海洋海水养殖教育部重点实验室,山东 青岛266003;2.烟台海益苗业有限公司,山东 烟台265619)
刺参(Apostichopus japonicus)隶属于棘皮动物门(Echinodermata)、海 参 纲 (Holothuroidea)、楯 手 目(Aspidochirota)、刺参科(Stichopodidae),主要分布于中国的黄、渤海、日本、朝鲜半岛和俄罗斯远东地区,在我国所有海参种类中品质最佳、营养价值最高,是极受人们喜爱的一种海产品,名列海产“八珍”之首。刺参含有大量的酸性黏多糖,除具有抗肿瘤及抗凝血等作用外,还具有增强机体免疫力的功效。因此,刺参不仅是一种美味佳肴和保健食品,还是一种药用价值极高的海洋药物[1]。近年来,随着全球海参自然资源日趋枯竭与国内海参消费持续增长,我国海参养殖呈现迅猛发展态势。据统计,2010年我国海参养殖面积为15.0万hm2,产量达到13.0万t,比2009年增长了27.6%[2]。其中,刺参已成为我国单种水产品中产值最高的养殖对象,产生了巨大的经济及社会效益。
刺参体色变化较大,背面一般为黄褐色或棕褐色,腹面为浅黄褐色,此外还有黄绿色、赤褐色、灰白色[3],而只有极少数刺参背腹均为纯白色,呈白化特征,被称为“白刺参”(见图1)。因为罕见、潜在利用价值较大,一些水产养殖公司相继开始白刺参规模化人工繁育的探索。
盐度、温度及培育密度等环境因子是影响刺参幼虫存活、生长、附着与变态的关键因素[4],直接关系到人工育苗的成功与否。研究表明,与幼参相比,刺参耳状幼虫适宜的盐度范围更加狭窄,并且对外部环境中盐度的变化更为敏感[5];在较高温度下,刺参幼虫的发育比自然水温下快[6],过高或过低的温度都将使刺参幼虫的成活率下降,并影响其正常变态[7];一些研究发现,培育密度可以通过影响鱼类及扇贝幼虫的内分泌系统[8],能量代谢[9]以及个体间的相互接触[10]来影响幼虫的生长和存活。然而,对于白刺参幼虫生长及存活所需的最佳培育环境条件,目前还没有相关的报道。本研究通过比较不同盐度、温度及培育密度下白刺参和普通刺参幼虫的生长及成活状况,筛选白刺参幼虫所需的最佳盐度、温度和培育密度,以期为白刺参苗种培育提供基础资料,进而为白刺参大规模工厂化苗种繁育奠定良好的基础。

图1 白刺参成体及稚参Fig.1 Adults and juveniles of white race of A.japonicas
1 材料与方法
1.1 种参来源与催产
白刺参和普通刺参均采自我国蓬莱沿海,暂养于烟台海益苗业有限公司。室内暂养过程中,投喂由鼠尾藻、马尾藻和海带等大型藻粉配制的饵料。采用阴干升温法诱导种参产卵,亲参阴干2h,流水刺激50min,随后将种参放入升温海水中(水温升高3~5℃),待其排精、产卵。当受精卵发育至初耳幼虫开口摄食后,用于幼虫实验。受精卵孵化水温为21℃,盐度为33,密度为0.6个/mL。幼虫在3L的塑料水桶中进行培育。
1.2 盐度实验
分别测定不同盐度对白刺参与普通刺参幼虫生长及存活的影响。实验分为4组,每组设3个重复。受精2d后,取开口摄食的初耳幼虫进行幼虫实验,幼虫初始大小(n=30)为(388.2±5.4)μm,分别测定4个盐度梯度25、29、33和37对幼虫生长及存活的影响。先将幼虫置于正常盐度(33)的海水中,然后逐渐升高或降低海水盐度,在2h内达到设计的各盐度水平。实验用水是用经砂滤的自然海水、300目筛绢过滤的淡水以及海盐配制而成的。培育密度为0.15个/mL,水温20~22℃。浮游幼虫培育期间,投喂饵料种类包括海洋红酵母、干酵母及螺旋藻粉,日投饵3次,投饵量根据胃部饱满度和生长发育的情况而定。日换水2次,每次换水量为1/3~1/2,持续充气。受精后第5、7、9天分别测定其体长及成活率。
1.3 温度实验
分别测定4个温度梯度(19,21,24和27℃)对幼虫生长及存活的影响。先将幼虫置于正常温度(21℃)的海水中,然后在2h内逐渐调整至设定温度。培育密度为0.15个/mL,盐度为33。幼虫的培育方法同盐度实验。分别于受精后第5、7、9天测定幼虫的体长及成活率。
1.4 密度实验
分别测定4个培育密度梯度(0.1,0.2,0.4和0.6个/mL)对幼虫生长及存活的影响。水温20~22℃,盐度33。幼虫的培育方法同盐度实验。分别于受精后第5、7、9天测定幼虫的体长和成活率。
1.5 数据统计
实验数据用SPSS 16.0软件进行ANOVA方差分析,并进行LSD分析后比较,以P<0.05作为不同处理之间显著差异水平。
2 结果
2.1 盐度对白刺参和普通刺参幼虫生长及成活的影响
随着培育时间的增加,不同盐度组中浮游幼虫的成活率不断下降(见表1)。第5天时,29盐度组白刺参幼虫成活率最高,为97.8%,并且与其他组差异极为显著(P<0.01),37盐度组白刺参幼虫成活率最低,为62.2%;而不同盐度对普通刺参幼虫存活的影响不显著(P>0.05)。第7天时,29盐度组白刺参幼虫成活率最高(68.9%),但与其他组差异不显著(P>0.05);而普通刺参幼虫成活率在25盐度组最高(80.0%),37盐度组成活率最低(50.0%),并且两者之间差异显著(P<0.05)。第9天时,29盐度组白刺参幼虫成活率最高,为62.2%,且与25和33盐度组不存在显著性差异(P>0.05);而不同盐度对普通刺参幼虫存活的影响不显著(P>0.05)。

表1 不同盐度下刺参耳状幼虫的成活率Table 1 The survival rates of the larvae of A.japonicus at different salinities
随着培育时间的延长,不同盐度组中浮游幼虫的体长不断增长(见图2)。白刺参在受精后第2~5天,29盐度组生长速度最快,平均体长最大,为(673.3±12.3)μm,极显著高于其他各实验组(P<0.01);普通刺参幼虫在发育到第5天时,37盐度组的平均体长最小,为(649.6±14.9)μm,并与其他组差异极其显著(P<0.01),但其他组之间差异不显著(P>0.05)。第7天时,25盐度组的白刺参幼虫平均体长最大((740.9±26.4)μm),37盐度组平均体长最小((623.4±13.0)μm),两者之间差异极为显著(P<0.01);而29盐度组的普通刺参幼虫平均体长最大((855.5±18.7)μm),37盐度组的普通刺参幼虫平均体长最小((746.9±19.0)μm),并且两者之间差异极为显著(P<0.01)。第9天时,25盐度组的白刺参幼虫平均体长最大((800.9±21.0)μm),并且与其他组间差异极为显著(P<0.01),但其他组之间差异不显著(P>0.05);而25盐度组的普通刺参幼虫平均体长最长((991.7±13.5)μm),37盐度组平均体长最小((923.8±16.8)μm),两者之间差异显著(P<0.05)。
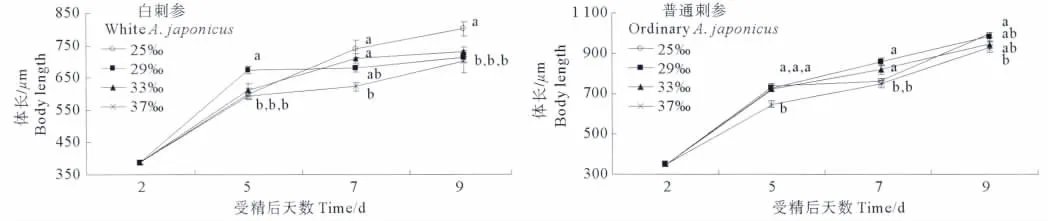
图2 刺参耳状幼虫在不同盐度下的生长Fig.2 Growth of the larvae of A.japonicus at different salinities
2.2 温度对白刺参与普通刺参幼虫生长及成活的影响
随着培育时间的增加,不同温度组中浮游幼虫的成活率不断下降(见表2)。第5天时,27℃温度组白刺参幼虫成活率最高(91.1%),19℃温度组成活率最低(72.0%),两者之间差异显著(P<0.05);而在第5天时,不同温度对普通刺参幼虫成活率的影响不显著(P>0.05)。第7天时,不同温度对白刺参幼虫成活率的影响不显著;而对于普通刺参,在19℃其幼虫成活率最高(76.7%)。第9天时,21℃温度组白刺参幼虫成活率最高(66.7%),19和27℃温度组成活率最低,都是55.6%;而在第9天时不同温度对普通刺参幼虫成活率影响不显著(P>0.05)。
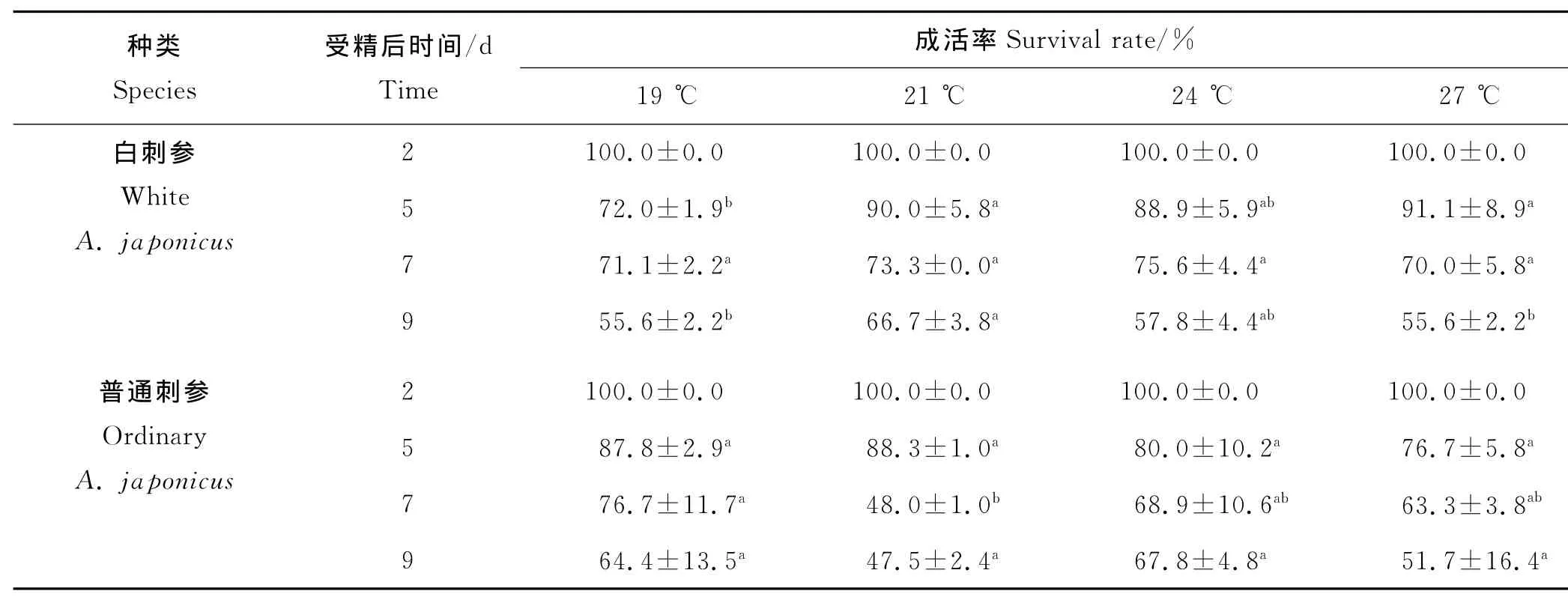
表2 不同温度下刺参耳状幼虫的成活率Table 2 The survival rates of the larvae of A.japonicus at different temperatures
随着培育时间的延长,不同温度组中浮游幼虫的体长不断增长(见图3)。白刺参在受精后第2~5天,27℃温度组生长速度最快,平均体长最大,为(655.9±11.9)μm,极显著高于其他各实验组(P<0.01);普通刺参幼虫在发育到第5天时,24℃温度组的平均体长最大,为(607.0±9.4)μm,但与其他组差异极不显著(P>0.05)。第7天时,19℃温度组的白刺参幼虫平均体长最大((744.0±17.3)μm),显著高于其他各实验组(P<0.05);而24和27℃2个温度组的普通刺参幼虫平均体长较大,分别为(883.3±13.3)μm 和(870.6±22.8)μm,并且与其他2组之间差异极为显著(P<0.01)。第9天时,19℃温度组的白刺参幼虫平均体长最大((854.9±19.6)μm),并且与其他组之间差异极为显著(P<0.01);而在第9天各温度组的普通刺参幼虫平均体长之间没有显著性差异(P>0.05)。

图3 刺参耳状幼虫在不同温度下的生长Fig.3 Growth of the larvae of A.japonicus at different temperatures
2.3 培育密度对白刺参与普通刺参幼虫生长及成活的影响
随着培育时间的增加,不同温度组中浮游幼虫的成活率不断下降(见表3)。不同密度对白刺参与普通刺参幼虫成活率影响均不显著(P>0.05);第5天时,0.6个/mL密度组白刺参和普通刺参幼虫成活率最高,分别为96.7%和81.1%;。第7天时,白刺参和普通刺参幼虫成活率依然在0.6个/mL密度下达到最高,分别为83.3%和72.2%。第9天时,0.6个/mL密度组白刺参幼虫成活率最高(70.0%);而0.4个/mL密度组普通刺参幼虫成活率最高(61.1%)。
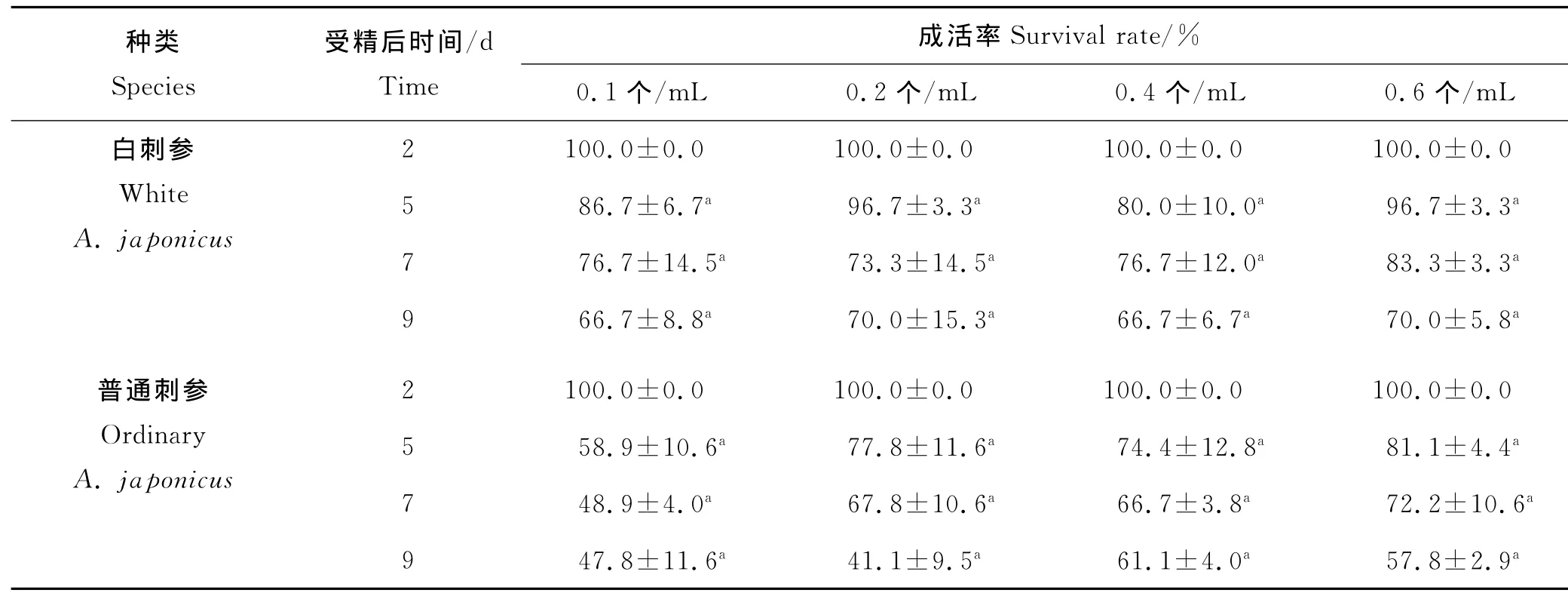
表3 不同培育密度下刺参耳状幼虫的成活率Table 3 The survival rates of the larvae of A.japonicus at different stocking densities
随着培育时间的延长,不同密度组中浮游幼虫的体长不断增长(见图4)。白刺参在受精后第2~5天,0.2个/mL密度组生长速度最快,平均体长最大,为(666.8±15.4)μm;普通刺参幼虫在发育到第5天时,0.4个/mL 密 度 组 的 平 均 体 长 最 大,为 (713.7±8.4)μm。第7天时,0.6个/mL密度组的白刺参幼虫平均体长最大((722.5±15.5)μm),0.2个/mL密度组平均体长最小((673.9±13.7)μm),两者之间差异显著(P<0.05);而0.1个/mL密度组的普通刺参幼虫平均体长最大((848.1±11.3)μm),0.6个/mL密度组的普通刺参幼虫平均体长最小((793.2±15.6)μm),并且两者之间差异显著(P<0.05)。第9天时,不同密度对白刺参幼虫平均体长影响不显著(P>0.05);而0.1个/mL密度组的普通刺参幼虫平均体长最大,为(968.2±14.2)μm,并与其他组之间差异显著(P<0.05)。

图4 刺参耳状幼虫在不同培育密度下的生长Fig.4 Growth of the larvae of sea cucumber at different stocking densities
3 讨论
对于海洋无脊椎动物,盐度是影响其生长、发育和存活的重要环境因子之一。不适宜的盐度会降低机体对不良外界环境的抵抗能力、食物的消化吸收效率,严重影响海洋无脊椎动物的生长和存活[11]。低盐度可能引起海参季节性排脏,部分原因是由于渗透调节作用变化的结果[12]。研究发现,在盐度30的条件下红刺参幼虫的生长率和成活率最高[4];盐度35是海参(Holothuria spinifera)幼虫的最佳生长和发育条件,过低的盐度容易导致幼虫变形和解体的发生[13]。本研究表明,对于白刺参与普通刺参幼虫的生长和存活,盐度25是适宜的培育条件。在高盐度37下,无论是幼虫的成活率还是生长率都是最低的。本研究中刺参幼虫生长的最适盐度比其他研究中的最适盐度略低,这可能是由于实验中所用到的种参来自于不同海区,生长环境的不同可能导致刺参幼虫生长所需最适盐度的差异。此外,刺参幼虫的生长是受多种环境因子综合作用的结果,不同研究中幼虫的培育温度、密度等环境因子的不同也可能导致刺参幼虫培育适宜盐度的差异。
温度也是影响刺参幼虫生长及成活的主要环境因子。温度对于受精卵孵化率以及幼虫各个阶段的存活和变态都会产生重大的影响。在适宜的温度范围内提高温度,刺参幼虫生长速度更快,而极端的温度将阻碍幼虫的生长和发育[14]。研究发现,过高的温度会导致对虾(Peaneus californiensis)幼虫消化吸收减弱,增加耗氧率和氨排泄率[15]。热带海参(H.scabra,Actinopyga echinites和H.atra)幼虫的最佳培育水温在27~30℃之间[16]。一些具有重要经济价值的双壳贝类幼虫同样需要适宜的培育温度。例如,海扇贝(Placopecten magellanicus)最适宜培育温度为15℃[17],而海 湾 扇 贝 (Argopecten irradians irradians)为25℃[18],紫贻贝(Mytilus edulis)为18~20 ℃[19],太平洋牡蛎(Crassostrea gigas)为30 ℃[20]。本研究中,19℃温度组的白刺参及普通刺参幼虫的生长速度较快,成活率较高。因此,白刺参与普通刺参幼虫的最适宜培育温度相近。所以,为提高苗种的生长率及成活率,白刺参幼虫最适宜温度为19℃。
在苗种的生产过程中,幼虫的培育密度直接决定着出苗量。研究发现高密度养殖会显著抑制海洋无脊椎动物的生长及存活[21]。适当提高培育密度可以大幅度提高苗种的产量,降低成本。但当培育密度过高时,水中的代谢废物增多、溶氧值下降、氨氮值增高,很容易造成水质恶化,导致幼虫产生一系列不良的生理反应,进而死亡率升高[10]。菲律宾蛤仔(Ruditapes philippinarum)幼虫的生长速度与培育密度呈负相关的关系,幼虫生长的适宜密度为5~10个/mL[22]。对于文蛤(Meretrix meretrix),在高密度培育下,其幼虫生长速度变慢,发育明显滞后,附着时间延长,10~20个/mL是比较合适的培育密度[23]。较高的培育密度(5个/mL)抑制了扇贝(Argopecten nucleus)的生长和存活[24]。对于普通刺参耳状幼虫,其适宜培育密度在0.2~1个/mL之间[25]。本研究表明,0.6个/mL密度组白刺参幼虫生长速度快、成活率高。对于普通刺参,0.1个/mL密度组生长速度最快。因此,培育密度对白刺参和普通刺参的影响略有不同,白刺参幼虫更适合在较高密度下进行培育。
[1] 李莉.中国青刺参和日本红刺参苗种培育的生物学研究 [D].青岛:中国海洋大学,2009.
[2] 农业部渔业局.中国渔业年鉴 [M].北京:中国农业出版社,2011.
[3] 于东祥,孙慧玲,陈四清,等.海参健康养殖技术 [M].北京:海洋出版社,2005.
[4] Li L,Li Q.Effects of stocking density,temperature,and salinity on larval survival and growth of the red race of the sea cucumber Apostichopus japonicus (Selenka)[J].Aquaculture International,2010,18:447-460.
[5] Kashenko S D.Acclimation of the sea cucumber Apostichopus japonicus to decreased salinity at the blastula and gastrula stages:its effect on the desalination resistance of larvae at subsequent stages of development[J].Russian Journal of Marine Biology,2000,26:422-426.
[6] Ito S,Kitamura H.Technical development in seed production of the Japanese sea cucumber,Stichopus japonicus [J].SPC Bechede-mer Information Bulletin,1998,10:24-28.
[7] 隋锡林.海参养殖 [M].北京:农业出版社,1990.
[8] Montero D,Izqueerdo M S,Tort L.High stocking density produces crowding stress altering some physiological and biochemical parameters in gilthead seabream,Sparus aurata,juveniles [J].Fish Physiology and Biochemistry,1999,20(1):53-60.
[9] Wendelaar B.The stress response in fish [J].Physiological Reviews,1997,77:591-625.
[10] MacDonald B A.Physiological energetics of Japanese scallop Patinopecten yessoensis larvae[J].Journal of Experimental Marine Biology and Ecology,1988,120:155-170.
[11] Forcucci D,Lawrence J M.Effect of low salinity on the activity,feeding,growth and absorption efficiency of Luidia clathrata (E-chinodermata:Asteroidea)[J].Marine Biology,1986,92:315-321.
[12] Fankboner P V.Seasonal visceral atrophy and response to salinity by Parastichopus californicus (Stimpson):Osmoregulation?[J].SPC Beche-de-mer Information Bulletin,2002,17:22-26.
[13] Asha P S,Muthiah P.Effects of temperature,salinity and pH on larval growth,survival and development of the sea cucumber Holothuria spinifera Theel[J].Aquaculture,2005,250:823-829.
[14] Liu G B,Yang H S,Liu S L.Effects of rearing temperature and density on growth,survival and development of sea cucumber larvae,Apostichopus japonicus (Selenka)[J].Chinese Journal of Oceanology and Limnology,2010,28(4):842-848.
[15] Villarreal H,Ocampo L.Effect of size and temperature on the oxygen consumption of the brown shrimp Peaneus californiensis(Holmes,1900)[J].Comparative Biochemistry and Physiology,1993,106A(1):97-101.
[16] James D B,Gandhi A D,Palaniswamy N,et al.Hatchery techniques and culture of sea cucumber Holothuria scabra [J].CMFRI Special Publication,1994,57:1-40.
[17] Culliney J L.Larval develop of the giant scallop Placopecten magellanicus(Gmelin)[J].Biology Bulletin,1974,147:321-332.
[18] Tettelbach S T,Rhodes S T.Combined effect of temperature and salinity on embryos and larvae of the northern bay scallop Argopecten irradians irradians[J].Marine Biology,1981,63:246-256.
[19] Hrs-Brenko M,Calabrese A.The combined effects of salinity and temperature on larvae of the mussel Mytilus edulis [J].Marine Biology,1969,4:224-226.
[20] His E,Robert R,Dinet A.Combined effects of temperature and salinity on fed and starved larvae of the Mediterranean mussel Mytilus galloprovincialis and the Japanese oyster Crassostrea gigas[J].Marine Biology,1989,100:455-463.
[21] Zmora O,Findiesen A,Stubblefield J,et al.Large-scale juvenile production of the blue crab Callinectes sapidus [J].Aquaculture,2005,244:129-139.
[22] Yan X W,Zhang G F,Yang F.Effects of diet,stocking density,and environmental factors on growth,survival,and metamorphosis of Manila clamRuditapes philippinarumlarvae[J].Aquaculture,2006,253:350-358.
[23] Liu B,Dong B,Tang B,et al.Effect of stocking density on growth,settlement and survival of clam larvae,Meretrix meretrix [J].Aquaculture,2006,258:344-349.
[24] Velasco L A,Barros J.Experimental larval culture of the Caribbean scallops Argopecten nucleus and Nodipecten nodosus [J].Aquaculture Research,2008,39:603-618.
[25] 田传远,李琪,梁英.刺参健康养殖技术 [M].青岛:中国海洋大学出版社,2008.
