仿刺参不同体外标记方法效果的比较
2013-10-13邱天龙林承刚杨红生
孙 璐, 邱天龙, 许 强, 刘 辉, 林承刚, 杨红生
(1. 中国科学院 海洋研究所, 山东 青岛 266071; 2. 中国科学院大学 北京 100049)
仿刺参(Apostichopus japonicus)也称刺参, 属棘皮动物门(Echinodermata), 海参纲(Holothuroidea),楯手目(Aspidochirotida), 仿刺参科(Stichopodidae),是中国北方海域重要的经济物种[1]。其主要生产方式为工厂化养殖、池塘围堰养殖、自然海区底播和野生种群采捕等。仿刺参身体柔软, 体壁没有硬质部分,且变形和排异能力极强, 是难以实现体外长效标记的海洋生物之一。使用体外标记技术可对仿刺参进行种群和个体尺度上的时空行为学研究、种群动态研究、良种繁育、高效采捕方法研究[2]。
使用具有编码的标记可为仿刺参个体的行为学研究提供极大的便利。Uthicke等[3]利用基于扩增片段长度多态性的DNA指纹技术对海参进行个体识别,效果良好。然而此类基因技术标记的缺点在于野外实验时无法直接识别海参个体。Mercier等[4]和Shiell[5]采用在海参表皮刻画记号的方法进行标记,操作性差且记号会随着海参体壁的自愈而模糊。
Yanagisawa[6]使用了类似的方法, 即用热金属丝在海参体壁表面进行烙印, 但是这种方法对海参伤害较大, 易造成死亡, 且烙印随着体壁生长而变得难以辨认。Harriott[7]、Kirschenbaum 等[8]和 Purcell等[9]先后尝试了体壁植入T形标等方法, 但是植入的标记物均被排出或造成海参死亡, 保留率同样不高。Morgan[10]指出, 标记造成的体壁溃烂是标记脱落的主要原因, 任何标记方法应当做到的基本原则是 T形标完全穿过体壁而不是停留在体壁中, 并且使穿刺造成的伤口尽可能小。在国内, 赵鹏等[11]已经建立了一种使用钙黄绿素标记仿刺参骨片的方法, 该方法尤其适宜于群体研究, 如研究标记回捕, 群体迁移规律等。然而该方法的局限性在于无法区分不同仿刺参个体, 无法追踪及定量化研究仿刺参个体在野外环境下的行为特征。这些研究为探索仿刺参体外标记技术提供了参考, 但以上方法的标记无法长期保留, 且不能区分个体。为突破这一瓶颈, 本实验进一步研究了在仿刺参身体上添加体外标签的方法,评估了在仿刺参不同部位添加标签后仿刺参的行为反应, 并筛选出适宜进行仿刺参体外标记的方法。
1 材料与方法
体腔植入标记物法、体壁半包埋法、棘部及体壁穿刺法、体壁胶粘法所使用的仿刺参均为荣成天鹅湖自然海域采捕的底播养殖健康仿刺参, 体质量为100 g左右。石灰环嵌套法实验使用工厂化养殖、体质量为(10.7±1.5)g的小规格健康仿刺参和100 g左右的大规格健康仿刺参。进行实验前, 将仿刺参转移至实验场所并进行驯化; 实验期间, 仿刺参均暂养于室内玻璃钢水槽, 水槽内放置石块以模拟自然环境,水温保持在 10℃左右, 以利于部分实验中仿刺参伤口的愈合并防止感染, 每日换水 1/2, 投喂海泥与藻粉质量比1∶1配合饲料。
1.1 体腔植入标记物法
本实验使用模拟标记物(pvc管, 1.5 g)对仿刺参进行体内填充。实验个体为10头体质量为100 g左右的健康仿刺参。模拟标记物经过100℃淡水煮沸消毒后, 从仿刺参背部切口植入仿刺参体腔内, 切口长度为20 mm, 植入后对切口不做处理, 暂养观察。
1.2 体壁半包埋法
由于前述体腔植入法直接影响了仿刺参呼吸消化等重要器官的生理活动, 对仿刺参造成了严重的影响, 因而设计了一种使标记物挂在仿刺参身体外的连接头, 以减少对仿刺参体腔内部器官的影响。模拟标记物与连接头成哑铃形, 连接头圆盘直径为 8 mm,底盘厚度 0.8 mm。植入操作同体腔植入标记物法,模拟标记物经过煮沸消毒, 使用时将连接头的圆盘包埋入仿刺参体壁下, 将模拟标记物一侧留在体外, 如图1。本组实验使用10头健康仿刺参, 按上述操作后暂养观察。

图1 使用体壁半包埋法标记后外观Fig. 1 Appearance of Apostichopus japonicus with somatic embedding
1.3 棘部及体壁穿刺法
棘是仿刺参特有的突出于体表的器官。通过实验分别采用聚乙烯塑料线、银钉、羊肠线对仿刺参棘部及体壁进行穿刺标记, 如图2。每组实验个体健康仿刺参10头, 穿刺后于海水中暂养观察。

图2 使用穿刺法标记后外观Fig. 2 Appearance of Apostichopus japonicus with spine and somatic piercing
1.4 体壁胶粘法
体壁胶粘法是将标记物使用胶水粘附于仿刺参体壁表面。本实验采用医用胶(主要成分α-氰基丙烯酸丁酯)和普通502胶水(主要成分α-氰基丙烯酸乙酯)两种胶水, 使用大小两种规格的模拟标记物 A和B(湿质量3 g和0.8 g, 分别占实验仿刺参质量3%和0.8%)。选择健康仿刺参, 使用上述两种胶将模拟标记物粘附于各组仿刺参体壁表面。
1.5 石灰环嵌套法

图3 使用石灰环嵌套法后外观Fig. 3 Appearance of calcareous ring nesting
仿刺参口咽部有一圈紧密排列的细小石灰质骨针, 称为石灰环。本方法使用细线从仿刺参口部穿入,经过石灰环, 在体前五分之一体长处经由体壁穿出,打结固定, 松紧度使细线恰好接触体壁外侧, 如图3。本实验中小规格组使用重5 g左右仿刺参, 设3个处理组和1个对照组, 处理组分别使用尼龙线(线径0.16 mm),聚丙烯线(线径0.19 mm), 不可吸收手术缝合线(型号4/0, 线径约0.150~0.199 mm)进行标记, 每个处理设3个重复, 每个重复使用 30头仿刺参。实验仿刺参养殖于塑料水箱(140 L), 水箱内放置石块, 以模拟自然生长环境。大规格组使用重100 g左右仿刺参, 设1个处理组和1个对照组, 使用尼龙线(线径0.16 mm)进行标记, 设3个重复, 每个重复使用30头仿刺参, 养殖于塑料水箱(400 L)。
2 结果
2.1 体腔植入标记物法
使用此方法植入标记物后3 h, 即有50%被排出体外, 42 h后全部排出, 如图4。

图4 体腔植入标记物后仿刺参排异情况Fig. 4 Rejection of tags with body cavity implantation
2.2 体壁半包埋法
包埋后仿刺参对标记物连同连接头的排异情况相对上一种标记方法并不严重, 且排异所需时间较长, 但8 d后排异率仍达到了90%, 如图5。

图5 标记物半包埋后排异率变化Fig. 5 Rejection of tags with somatic embedding
2.3 棘部及体壁穿刺法
使用穿刺法进行体壁标记的标记物保留情况好于棘部标记, 3种标记材料中银质材料保留率最低,见表1。

表1 穿刺法添加标记物后的保留率Tab. 1 Retention of tags with spine and somatic piercing
2.4 体壁胶粘法
使用医用胶将模拟标志物粘贴于仿刺参体壁后12 h, A组全部脱落且创面发生溃烂; B组模拟标志物部分脱落, 48 h后全部脱落, 创面无溃烂。使用502胶水粘贴后12 h, A组全部脱落且创面溃烂; B组12 h后未脱落, 48 h后全部脱落, 创面无溃烂。标记后仿刺参运动和摄食行为未受影响。
2.5 石灰环嵌套法
使用石灰环嵌套法标记小规格后 48~72 h, 标签脱落数最多, 此后则较稳定, 几乎没有标签脱落。各组仿刺参死亡后进行解剖, 发现标签保留率较高(图6~图7)。
然而, 标记后各组仿刺参体壁均出现被标记线磨伤、溃烂的情况, 其中聚丙烯线和不可吸收手术缝合线标记组仿刺参情况较严重, 在标记后72和48 h全部死亡; 尼龙线标记组仿刺参体壁溃烂情况较轻,但也在10 d后全部死亡(图8~图9)。
大规模仿刺参标记后只发生轻微溃烂或脱落现象, 仅在标记后1、3、4和15 d发生脱落, 共6个标记, 至标记后3个月时标签保留率为93.3%。
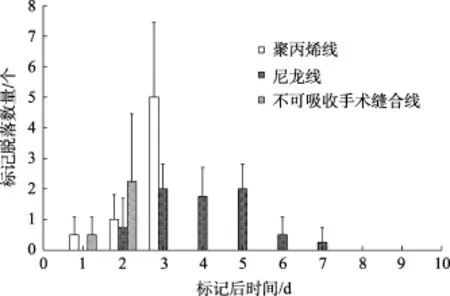
图6 石灰环嵌套法标记后每日标签脱落情况Fig. 6 Detachment of tags with calcareous ring nesting

图7 石灰环嵌套法10 d后标签保留率Fig. 7 Final retention of tags of calcareous ring nesting

图8 石灰环嵌套法标记后仿刺参体壁溃烂情况Fig. 8 Somatic fester of Apostichopus japonicus tagged with calcareous ring nesting
3 讨论
3.1 影响仿刺参标记稳定性的生物学因素
3.1.1 仿刺参的伸缩性
仿刺参的体壁具有极强的伸展和收缩能力, 能够在肌肉的带动下缓慢而有力地对身体形状做出调整, 甚至达到与正常时的外形差别极大的状态, 以适应周围环境或完成各种生命活动。在使用体壁半包埋法的标记实验中, 仿刺参在标记后产生了较剧烈的整体体型变化或者局部的体壁变形。在体壁半包埋法实验中, 标记物被穿刺固定于仿刺参体壁, 仿刺参为排出标记物, 将标记处被穿刺的体壁孔洞再次扩张,使标记物脱离后再收缩受损的标记处体壁孔洞。这种行为使得在仿刺参体壁的各个位置都难以通过简单的包埋来完成特异性标记。
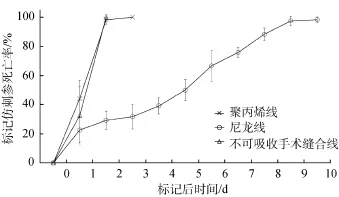
图9 石灰环嵌套法标记后仿刺参死亡情况Fig. 9 Death of Apostichopus japonicus tagged with calcareous ring nesting
3.1.2 仿刺参的自溶和再生性
海参具有自溶能力, 在遇到不利的环境条件时(受伤、敌害等), 自行将部分体壁溶解。而在利用自溶成功度过不利情况后, 受损身体部位又能够在一段时间后自行修复并愈合[12,13]。在棘部及体壁穿刺法中, 仿刺参在被标记物穿过体壁后产生自溶现象,将标记处体壁部分溶解以使标记物脱落, 再经过一段时间重新愈合此处。以上这些特征对于特异性标记方法的开发无疑是首要面对的难题。在这一点上, 前述几种标记方法均难以长期存留于仿刺参体外, 无法满足特异性标记的基本要求。
3.1.3 仿刺参的排异反应
体腔植入标记物法、体壁半包埋法和棘部及体壁穿刺法 3种破坏性的标记方法均对仿刺参标记位置产生较明显的伤害, 造成标记后不同程度的排异现象, 较严重无法自愈时可导致死亡。在标记脱落之前,仿刺参普遍出现活动强度减弱、停止进食或进食减少的情况。
有研究指出金属银具有抗菌作用[14], 且多个行业均有使用各种含银材料作为抗菌材料的先例[15-16]。因此在尝试使用棘部及体壁穿刺法进行标记时, 银也成为了研究人员选择的标记材料之一。然而实验结果显示, 仿刺参对银质材料具有极其强烈的排异反应, 在棘上部和棘基部穿刺的银线被排出速度均显著快于聚乙烯和羊肠线两种材料。前期实验中各种金属材料的标记效果同样不令人满意, 因此推断仿刺参对于金属的排异反应较强烈。另外, 本实验中聚乙烯线效果好于羊肠线, 介于两者线径相同, 其原因有可能在于材料表面光滑程度的较大差别, 另一个原因则是羊肠线本身属于异体蛋白质, 组织反应较重。因此在后续的石灰环嵌套法实验中, 研究人员选择了表面光滑的尼龙线作为标记材料之一。
使用体壁胶粘法进行标记时发现, 较大质量的模拟标志物一组使用两种胶水都会在标记处发生体壁溃烂现象, 小质量组则未发生溃烂, 并且保留时间长于大质量组。据此推断当所需标记保存时间不超过24 h时, 可使用合适胶水和质量小于仿刺参体质量1%的标签, 使用体壁胶粘法进行标记。
3.2 标记效果与应用前景
通过对上述几种标记方法的总结分析, 研究人员选择了仿刺参唯一一处无法自行脱出标记物的位置——石灰环, 进行标记实验。本实验中, 聚丙烯线和不可吸收手术缝合线在标记效果的各个指标上均显著差于尼龙线, 表明前两种材料和质地对仿刺参影响较大, 不适宜作为此法中的标记用线。相对以上两种材料, 尼龙线优点在于表面质地光滑, 标记过程中和标记后由于仿刺参活动造成的摩擦均较小, 因而对仿刺参伤害也较小。通过观察和后期的解剖鉴定,使用石灰环嵌套法进行标记, 凡是准确穿过石灰环的标记, 均没有脱落, 标签保留率达到可以投入使用的水平。但由于尝试使用小规格仿刺参进行标记实验以便为遗传育种工作提供技术, 所以造成对仿刺参伤害较大。后期使用100 g左右的大规格仿刺参进行标记, 标记后第2天即可恢复摄食活动, 4 d后摄食恢复正常, 且标记 3个月后标签保留率仍达到 93.3%,标记效果良好。大规格仿刺参其石灰环也较大, 相对于小规格仿刺参更利于标记准确穿过石灰环, 较高的标签保留率也印证了这一推测。初步认为该方法适宜使用于仿刺参体外标记用以进行行为学等研究,但标记后对仿刺参生长情况是否具有影响尚须验证。
4 结语
石灰环嵌套法是一种有广泛使用潜力的仿刺参体外长效标记技术, 其优点在于操作方法简便, 标记材料可获得性较好且成本较低, 标记效果良好。使用标记线作为载体, 可在其上附加各种标签, 如常规编号标签、电子标签、声学标签等, 为仿刺参的时空行为学研究、种群动态研究、良种繁育、高效采捕方法研究等提供重要技术支撑。
[1]廖玉麟. 中国动物志——海参纲[M]. 北京: 科学出版社1997: 148-150.
[2]Conand C. Methods of studying growth in holothurians(beche-de-mer), and preliminary results from a beche-de-mer tagging experiment in New Caledonia[J].Fish Newsletter, 1983, 26(3): 31-38.
[3]Uthicke S, Benzie A H. A genetic fingerprint recapture technique for measuring growth in unmarkable invertebrates: negative growth in commercially fished holothurians (Holothuria nobilis)[J]. Marine Ecology Progress Series, 2002, 241: 221-226.
[4]Mercier A, Battaglene S C, Hamel J F. Periodic movement, recruitment and size-related distribution of the sea cucumberHolothuria scabrain Solomon Islands[J]. Hydrobiologia, 2000, 440(1-3): 81-100.
[5]Shiell G R. Effect of invasive tagging on the activity ofHolothuria whitmaei(Echinodermata : Holothuroidea):A suitable mark-recapture method for short-term field studies of holothurian behaviour[J]. Marine and Freshwater Behaviour and Physiology, 2006, 39(2):153-162.
[6]Yanagisawa T. Sea-cucumber ranching in Japan and some suggestions for the South Pacific[C]. Tonga:Aquaculture Workshop, 1995, 387-400.
[7]Harriot V J. The ecology ofHolothurian faunaof Heron Reef and Moreton Bay[D]. Townsville: University of Queensland, 1980.
[8]Kirschenbaum S, Feindel S, Chen Y. A study of tagging methods for the sea cucumber Cucumaria frondosa in the waters off Maine[J]. U.S. National Marine Fisheries Service Fishery Bulletin, 2006, 104: 299-302.
[9]Purcell S W, Blockmans B F, Nash W J. Efficacy of chemical markers and physical tags for large-scale release of an exploited holothurian[J]. Journal of Experimental Marine Biology and Ecology, 2006, 334(2): 283-293.
[10]Morgan A D. Induction of spawning in the sea cucumberHolothuria scabra(Echinodermata: Holothuroidea)[J].Journal of World Aquaculture Society, 2000, 31(2):186-194.
[11]赵鹏, 杨红生, 王晓宇, 等. 钙黄绿素标记仿刺参的效果及其对仿刺参抗氧化酶活力的影响[J]. 水产科学, 2011, 35(3):372-378.
[12]李霞, 聂竹兰, 魏杰. 仿刺参体壁表皮再生组织学和超微结构观察[J]. 中国水产科学, 2007, 14(7): 1-6.
[13]聂竹兰, 李霞. 海参再生的研究[J]. 海洋科学, 2006,30(5):78-82.
[14]张文钲, 张羽天. 载银抗菌材料的研究与开发[J]. 化工新型材料, 1997, 7: 20-22.
[15]王维清, 冯启明, 董发勤. 银系抗菌材料及其研发应用现状[J]. 应用化工, 2004, 33(4): 1-3.
[16]陈炯, 韩春茂, 林小玮, 等. 纳米银敷料在修复Ⅱ度烧伤创面的应用研究[J]. 中华外科杂志, 2006, 44(1): 50-52.
