软组织多形性透明变性血管扩张性肿瘤2例病理表现并文献复习
2013-10-04彭发全
彭发全
(上饶市第五人民医院病理科,江西 上饶 334000)
软组织多形性透明变性血管扩张性肿瘤(pleomorphic hyalinizing angiectatic tumor ofsoftparts,PHAT)是一种比较少见的软组织肿瘤,由Smith等[1]于1996年首先报道并命名。2002年新版WHO软组织肿瘤分类中界定它是一种分化未明、生物学行为低度恶性的不转移性软组织肿瘤,但对其性质未注明编码。本瘤局部复发率高,约33%~50%病例复发,有些病例甚至多次复发[2]。 范钦和[3]以中间型血管肿瘤对其作了介绍。笔者在工作中遇到2例PHAT,现结合相关文献对该肿瘤的临床表现、病理特征、组织起源、鉴别诊断及治疗预后等方面进行复习总结,旨在提高对本病的认识及指导实际临床病理诊断,以利于今后临床治疗及预后判断。
1 材料与方法
上饶市第五人民医院2012年6月及江西省肿瘤医院2005年8月收治2例PHAT患者。标本均经10%中性福尔马林液固定,石蜡包埋,4 μm厚重切蜡块,HE染色,并镜下观察。免疫组化标记,所用抗体包括 CD34、VEGF、CD31 和 S-100、SMA、Des、CD68、Ki-67及PV-9000检测系统,抗体均购自北京中杉金桥生物技术公司。采用PV系列通用型二步法操作,高压锅修复,DAB显色,苏木素复染。同时进行PSA/AB黏液染色。
2 结果
2.1 临床表现
例1,男,36岁,左大腿根部肿块2年余,近2个月缓慢增大;例2,男,45岁,左足踇趾肿块4个月余,无明显疼痛不适。触诊2例肿瘤境界欠清,呈浸润性生长。
2.2 病理特征
巨检:肿块境界欠清,无包膜,大小分别为3.5×2 cm×1.5 cm和直径1.5 cm,切面灰白,灰红色,局灶区域暗红色。镜检:肿瘤与周围组织境界欠清,呈浸润性生长,浸润周围肌肉及脂肪组织,主要由大量成簇分布的薄壁血管和多形性肿瘤细胞构成。血管大小不等,周围透明变性,部分血管扩张,扩张的血管内衬梭形内皮细胞(封三图1A)。肿瘤细胞多形性,呈短梭形、卵圆形或星形,胞质丰富,核膜清晰,核染色质细颗粒状,可见有小核仁,并可见双核或多核瘤巨细胞,未见明显核分裂像(封三图1B)。间质疏松,部分区域透明变性明显,成片围绕血管壁形成“袖套”样结构(封三图1C),肿瘤边缘还可见黏液样疏松区,与肿瘤中央病变区相移行;黏液样疏松区瘤细胞形态单一,呈短梭形,异型性小,排列稀疏,可见散在灶状瘤细胞密集区,间质见多少不等的淋巴细胞浸润并有淋巴滤泡形成 (封三图1D)。免疫表型:肿瘤细胞表达Vim弥漫性强阳性,S-100、SMA、Des、CD68均阴性。血管内皮细胞表达 CD34和CD31,阳性率100%,VEGF阳性率约60%。瘤细胞Ki-67表达微弱,约1%,表明细胞增殖活性较低。透明变性物质PAS/AB染色部分区域阳性。
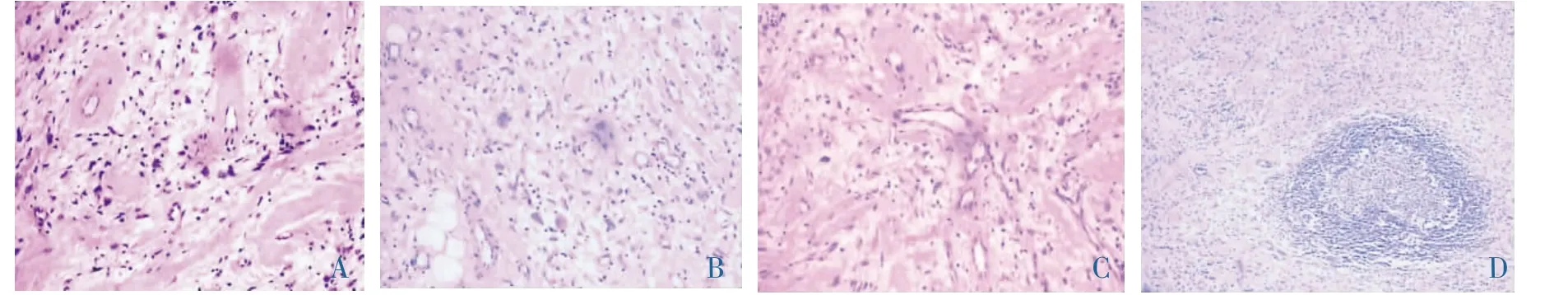
图1 PHAT病理表现
3 讨论
3.1 临床表现
文献报道的PHAT以成人为主,年龄10~86岁[4],平均54岁,多为中老年,性别差异不大。肿瘤发生部位以四肢、躯干的皮下或浅筋膜为主,以下肢为多见,依次为上肢、阴部、臀部、胸腹壁、背部、颈部、腋窝、腹股沟及髂部等,很少见于深部肌肉组织内,也可见于颊黏膜[4]和后腹膜[5]。 临床上多数患者表现为局部缓慢生长的肿块,病程较长,从2个月至38年不等,呈良性经过。肿瘤无真性包膜,边缘多呈局限性浸润性生长,少数病例肿瘤周围境界清楚,与周围组织无粘连,手术可完整切除。临床一般诊断为良性纤维组织来源性肿瘤,比如纤维瘤、血管瘤等多种良性病变。
3.2 病理特征
3.2.1 巨检
肿瘤多为圆形或卵圆形,部分可呈分叶状,无真性包膜,部分有纤维性假包膜,与周围组织境界欠清。大小为0.3~19.7 cm,平均约5.6 cm,多彩状,灰红色,褐色,淡黄色,部分呈灰白色,蜂窝状,质硬或韧,常有灶性出血及囊性变,部分可见少量细小的囊腔和裂隙。肿瘤边缘呈浸润性生长,可见周围组织被包入肿瘤组织之中。
3.2.2 镜检
目前关于PHAT的最大的一项研究是由Folpe等[2]报道的,并将其分为早期PHAT和典型PHAT 2个亚型,两者之间有广泛的组织学重叠,在同一病变内2种结构常混合存在。早期PHAT形态主要表现为单形性的梭形细胞,瘤细胞少到中等量呈编织状排列包绕脂肪细胞巢,有含铁血黄素沉积和核内包涵体、黏液样基质,血管有扩张及纤维素沉积。Folpe等[2]认为这些形态改变是PHAT的前驱病变。Brim等[6-8]也证实了间质黏液变性及透明变性的细胞稀少区是PHAT的前驱病变。另外早期PHAT还可见到温和的梭形细胞含有大量的含铁血黄素、血管壁之间的多形性瘤细胞聚集、核内假包涵体以及肿瘤周围小的损害的血管和异常血管堆积[9]。典型PHAT 的组织学改变主要有以下 3 个特征[1-14]:1)大量成簇分布的薄壁血管,血管大小不等,部分明显扩张,散在性分布于肿瘤内,扩张的血管内衬梭形内皮细胞,部分血管腔内可见红细胞和(或)淡红染血浆,有时血管腔内可见有血栓。2)呈片状或条索状密集或稀疏分布于扩张性血管之间的肿瘤细胞,有明显的多形性,瘤细胞呈胖梭形,圆形或多边形,胞质丰富,核多形性,深染或空泡状,有时可见小核仁,并见散在核大深染的双核或多核瘤巨细胞,易与恶性纤维组织细胞瘤混淆,核分裂像很少见,不超过3个/50HPF。常可见到核内包涵体,局部扩张血管周围瘤细胞内可见含铁血黄素沉着。3)血管壁、血管周围及瘤细胞之间基质呈嗜伊红性透明变性,部分区域透明变性明显,成片,围绕血管壁形成“袖套”,并同时向周围肿瘤组织延伸,部分薄壁血管被挤压成裂隙状。其本质为无定型嗜酸性物质,PAS、Masson三色及PTAH染色显示由胶原纤维组成。另外,在肿瘤边缘和部分肿瘤中还可见黏液样疏松区,与肿瘤中央病变区表面不完全相同,基质呈黏液样,也可见聚集的薄壁血管。瘤细胞形态较为单一,呈梭形,异型性小,排列稀疏,可见散在灶状瘤细胞密集区。瘤细胞间和部分血管周围可见淡嗜伊红玻璃样物质,黏液样疏松区与肿瘤中央病变区相移行。肿瘤外周致密玻璃样变性纤维组织中可见灶性淋巴细胞和浆细胞聚集并有淋巴滤泡形成。除上述典型和早期改变外,PHAT还可见到其他改变,且常被误诊为其他病变,包括:梭形细胞增生浸润至周围脂肪;血管壁上有较多再通微小管道;肿瘤间质淋巴细胞浸润及肥大细胞浸润灶;有同心圆或层状钙化;肿瘤局灶性点状坏死。Folpe等[2]认为早期PHAT是典型PHAT的先驱病变,其理由是:1)至少70%典型PHAT的周边或局灶区域出现早期PHAT改变;2)早期PHAT尽管在组织学上与典型PHAT表现有所不同,但却存在许多微妙的相似性;3)最直接的证据是早期PHAT的复发病例演变成典型PHAT表现,这些表现支持早期PHAT是PHAT一种早期的、固有的病变部分,而不是简单的一种晚期继发性改变。
3.2.3 免疫组化
肿瘤细胞Vim部分或弥漫性强阳性,血管内皮细胞表达 CD34、VEGF、NSE、CD31 和 FⅧRag,少量圆形细胞表达CD99,梭形细胞则阴性,血管壁SMA阳性,CD117肥大细胞阳性,瘤细胞Ki-67表达0.2%~3.5%[8,13],增殖活性较低。透明变性物质PAS及PTAH染色部分阳性,肿瘤稀疏区小灶梭形细胞内和肿瘤组织中Perls染色含铁血黄素阳性。S-100、SMA、Des、CD68、BCL-2、EMA 均阴性。
3.3 组织起源
PHAT组织起源目前尚不清楚。2002年WHO在软组织肿瘤与骨肿瘤的病理学与遗传学分类中将PHAT列入不能确定分化的良性肿瘤[10]。关于其组织起源有3种学说。1)血管源学说。Groisman等[8]支持血管源学说,注意到在大量增生的非透明变性的血管内有大量的毛细血管渗入,研究认为在PHAT的形成过程中血管的形成发挥着重要的作用。首先,通过组织学观察,大量的新生血管主要在肿瘤的周围区域;其次,除了透明变性的簇状血管外,免疫组化显示肿瘤细胞,内皮细胞以及局灶性坏死区域VEGF强阳性表达。研究分析认为,在肿瘤的形成过程中,VEGF直接地和选择性地刺激内皮细胞有丝分裂,在肿瘤组织和周围坏死区由于组织缺氧诱导VEGF的表达。Smith等[1]也提出2种可能的机制解释:首先,肿瘤浸润造成的组织损伤导致肥大细胞产生血管活性物质释放,增加了血管的通透性;其次,肿瘤的不断生长侵蚀正常血管引起内皮细胞的损伤和血浆成分的渗出,血管周围透明物质的沉积,导致透明变性血管的形成。Groisman等[8]的免疫组化研究结果排除了内皮、神经、组织细胞和肌源性的来源,认为这些肿瘤细胞是未分化的原始间叶细胞,可能与间质内纤维母细胞有关。肿瘤细胞表现为Vim和CD34弥漫阳性,FⅧRag和CD99局灶性阳性。CD99通常在幼稚的间叶组织细胞中阳性表达,虽然并非是特异性抗原,但可以推测阳性表达CD99的肿瘤本质可能是原始的,未分类的间叶细胞来源的。2)原始间叶组织来源学说。多数作者[11]认为软组织肿瘤若不是全部也是部分来源于原始多潜能间叶细胞,只是在肿瘤形成过程中,因基因变异的不同,使受损的原始间叶细胞向某一种成分细胞系分化,结果出现了种类繁多的软组织肿瘤。PHAT部分区域见CD99强阳性表达,这表明支持原始间叶组织来源学说。3)纤维组织细胞学说。有研究[12-13]显示CD34表达于早期淋巴造血干/祖细胞、血管内皮细胞、胚胎纤维母细胞和某些神经组织的细胞。CD34表达在神经内皮而并非雪旺细胞,因此对普通型与弥漫型神经纤维瘤、神经鞘膜瘤CD34阳性[11]。PHAT的组织表现主要是以梭形细胞为主的多形性肿瘤细胞,及其相连的血管变化,后者既是肿瘤组织成分,也可以是肿瘤间质内增生血管伴透明变性。PHAT的血管样改变在孤立性纤维性肿瘤和巨细胞血管纤维瘤内并不少见,也并非是PHAT的特异性变化。1997年Silverman等[14]报道1例PHAT,除免疫表型Vimentin和CD34阳性外尚有20%~40%梭形细胞FⅧRAg阳性,认为来源于纤维组织细胞肿瘤,同时认为PHAT是由微血管CD34阳性的树突状细胞和间质FⅧRAg阳性的指突状细胞组成的纤维组织细胞肿瘤。Husek等[15]通过电镜发现肿瘤细胞胞质内有中间丝,提示该肿瘤起源于间质纤维母细胞,像孤立性纤维性肿瘤或巨细胞血管纤维瘤一样,Fukunaga等[7]认为三者属同一家族低度恶性潜能肿瘤。
3.4 鉴别诊断
孤立性纤维性肿瘤(SFP)可发生在全身各部位,肿瘤由梭形细胞和不同比例的胶原纤维组成,增生的间叶梭形细胞被蟹足肿样胶原纤维隔开为特点。细胞稀少区和细胞丰富区交替分布,两者之间有粗的玻璃样胶原和分支状血管外周细胞瘤样血管分隔。间质和血管周围可见玻璃样及黏液变性,局灶见肥大细胞浸润。免疫组化CD99及CD34阳性。
巨细胞血管纤维瘤(GCA)大多位于中年人的眶区和眼睑,也可发生在眶外,如口腔、大腿等部位,属于低度恶性潜能肿瘤。形态特征是丰富的圆形或梭形细胞呈一致性排列,可见单核或散在多核巨细胞,瘤细胞之间基质可伴有不同程度的胶原变性和黏液变性,瘤细胞表达Vim和CD34。有些瘤细胞形成假血管样结构或血管腔隙,内衬断续排列的畸形多核巨细胞,这种形态在PHAT中不见。
巨细胞性纤维母细胞瘤(GCF)主要由2种细胞构成:一种为多形性核的星状或梭形纤维母细胞,另一种为具有诊断意义的怪异的多核巨细胞,相似于杜顿巨细胞。肿瘤中可见血管扩张样腔隙或假性血管腔形成,分布于黏液样基质中,腔隙大小不等,可含有红细胞或富于透明质酸的、灰蓝色无细胞的颗粒状物,与PHAT有相似之处,但腔壁衬覆多形性梭形细胞或多核巨细胞,不被覆血管内皮细胞。免疫 组 化 标 记 :Vim、CD68、HHF-35 阳 性 ,CD34、CD31、FⅧRAg阴性。
血管瘤样恶性纤维组织细胞瘤(AMFH)瘤细胞形态多样,大小不一,核深染,有核仁,部分瘤细胞可见吞噬含铁血黄素,可见多核瘤巨细胞。间质见黏液变性及淋巴细胞浸润。具有诊断意义的是出血灶所形成的囊腔,形状不规则,充满血性内容物,囊壁内衬覆多层瘤细胞,细胞呈血管内皮细胞标记阴性[16]。
3.5 治疗及预后
PHAT是一种具有显著临床病理特征的潜在或低度恶性肿瘤,具有局部高复发率(33%~50%),有时具有侵袭性,临床多采用局部扩大手术,但至目前为止尚无转移报道。Smith等[1]报道的14例患者中,随访8例,其中4例局部复发,1例呈明显的侵袭性生长而做截肢手术,另1例多次复发。Folpe等[2]报道的41例中,有完整随访资料的18例(随访时间平均84个月,最长时间420个月),其中6例复发,手术切除肿瘤后,16例无瘤生长,2例带瘤生长。陈易华等[17]报道的1例随访2年多后局部复发,复发肿瘤组织形态与原发肿瘤相似。
[1]Smith M E F,Fisher C,Weiss S W.Pleomorphic hyalinizing angiectatic tumor of soft parts[J].Am J Surg Pathol,1996,20(1):21-29.
[2]Folpe A L,Weiss S W.Pleomorphic angicelatic tumor:analysis of 41 cases supporting evolution from a disrinctive precursor lesion[J].AM J Surg Pathol,2004,28(11):1417-1425.
[3]范钦和.中间型血管肿瘤[J].诊断病理学杂志,1999,6(2):129-132.
[4]Ide F,Shimoyama T,Horie N.Pleonorphic hyalinizing angiectactic tumor of the buccal mucosa[J].J Oral Pathol Med,2004,33(8):451-453.
[5]王坚,盛伟琪,施达仁,等.软组织多形性透明变性血管扩张性肿瘤[J].临床与实验病理学杂志,2000,16(1):1-3.
[6]Brim S P,Allerding T J,Buck K.Pleomorphic hyalinized angiectatic tumor of soft parts[J].J Am Podiatr Med Assoc,1999,89:307-311.
[7]Fukunaga M,Ushigome S.Pleomorphic hyalinized angiectatic tumor of soft parts[J].Pathol Int,1997,47(11):784-788.
[8]Groisman G M,Bejar J,Amar M,et al.Pleomorphic hyalinized angiectatic tumor of soft parts:immunohistochemical stusy including the expression of vascular endothelial growth factor[J].Arch Pathol Lab Med,2000,124(3):423-426.
[9]张仁亚,韩庶勇,许艳梅.软组织多形性透明变性血管扩张性肿瘤[J].临床与实验病理学杂志,2005,21(5):612-614.
[10]Fletcher C D M,Unni K K,Mertens F.软组织与骨肿瘤病理学和遗传学[M].程虹,译.北京:人民卫生出版社,2002:220-221.
[11]Rosai J.阿克曼外科病理学[M].回允中,译.8 版.沈阳:辽宁教育出版社,1999:2023-2029,2038-2062.
[12]Traweek S T,Kandalaft P L,Mehta P,et al.The human hematopoietic progenitor cell antigen(CD34)in vascular neoplasia[J].Am J Clin Parhol,1991,96(1):25-31.
[13]Weiss S W,Nickoloff B J.CD34 is expressed by a distinctive cell population in petiphetral nerve,nerve sheath tunors,and related lesions[J].Am J Surg Pathol,1993,17(10):1039-1045.
[14]Silverman J S,Dana M M.Pleomorphic hyalinizing angiectatic tumor of soft parts:immunohistochemical case stusy shows cellular composition by CD34+fibroblasts and fac-tor XIIIa+dendrophages [J].J Cutan Pathol,1997,24(6):377-383.
[15]Husek K,Vesely K.Pleomorphic hyalinizing angiectatic tumor[J].Cesk Pathol,2001,37(4):177-181.
[16]刘彤华,刘复生.疑难外科病理诊断与鉴别诊断[M].北京:科学技术文献出版社,2006:559-560.
[17]陈易华,李娟,汪盛贤,等.软组织多形性透明变性血管扩张性肿瘤的临床病理学研究[J].西南国防医药,2008,18(4):560-562.
