人参皂苷Compound K对人膀胱癌T24细胞凋亡的影响
2013-09-19蒋丹丹,王晗,王际辉,叶淑红,肖珊
蒋 丹 丹,王 晗,王 际 辉,叶 淑 红,肖 珊
(大连工业大学 辽宁省食品生物技术重点实验室,辽宁 大连 116034)
0 引 言
近年来,人们在不断地寻求抑制肿瘤的新方法,人参作为我国传统中药受到越来越多的关注[1]。人参的许多生物学活性都是人参皂苷引起的[2],目前已发现人参皂苷有30多种,其中一些稀有人参皂苷具有极高的生理活性[3]。稀有人参皂苷Compound K是其他二醇型人参皂苷在人肠道内的降解产物,具有良好的抑制癌细胞生长的作用[4]。膀胱癌是泌尿系统最常见的恶性肿瘤,发病率居泌尿系统恶性肿瘤的首位,具有晚期恶性度加重和易复发的特点[5]。本实验探讨了人参皂苷Compound K诱导细胞凋亡的作用及机制。
1 材料与方法
1.1 主要材料和仪器
人膀胱癌T24细胞系;人参皂苷Compound K,大连工业大学金凤燮教授惠赠;RPMI 1640培养基;新生小牛血清;MTT;caspase-3、caspase-9单克隆抗体;多功能酶标仪(TECAN SUNRISE);流式细胞仪(Facscalibur Becton Dickinson)。
1.2 细胞培养与传代
将T24细胞置于37℃、5%饱和湿度CO2培养箱中,用RPMI 1640培养液(含10%小牛血清,青霉素100U/mL,链霉素100mg/L)培养。细胞呈单层生长,达80%左右融合时传代,细胞消化采用0.25%的胰蛋白酶和0.02%的EDTA混合消化液,每2~3d传代1次,取对数生长期细胞进行实验。
1.3 MTT法检测细胞活力
取对数生长期细胞,调节细胞浓度为1×104个/mL,接种于96孔板中,同时设立空白对照组。分别培养24、48、72h,换成不含血清培养液,实验组各加入不同浓度的人参皂苷Compound K,使其终浓度分别为5、10、15、20、25μmol/L,每种浓度设4个复孔,继续培养24h,每孔加入5mg/mL MTT溶液100μL,37℃培养4h后弃培养液,加入150μL DMSO,摇床上振荡10min,待甲臜结晶完全溶解后,用酶标仪于570nm处测定每孔光吸收值。
1.4 细胞凋亡的形态学观察
取对数生长期的T24细胞,接种于24孔细胞培养板,同时设立空白对照组。培养24h,加入不同浓度的人参皂苷Compound K,使其终浓度分别为5、10、20μmol/L。继续培养24h,弃培养液,PBS洗涤2次,加入含5μg/mL的Hoechst 33342的RPMI 1640细胞培养液,37℃孵育10min。在荧光显微镜下观察凋亡细胞核的形态变化。
1.5 流式细胞术检测细胞凋亡
利用Annexin V-FITC和PI双染法对细胞凋亡进行检测。取对数生长期的T24细胞,调整细胞密度为5×105个/mL,接种于6孔板内,用浓度分别为5、10、15、20、25μmol/L 人参皂苷Compound K作用24h后收集细胞,同时设立空白对照组,然后利用流式细胞仪对Annexin V-FITC细胞凋亡率进行检测。
1.6 免疫印迹法检测caspase-3和caspase-9蛋白的表达
将传代细胞接种于6孔板内,分别用浓度为5、10、15、20、25μmol/L的人参皂苷 Compound K处理细胞24h,同时设立空白对照组,收集细胞,提取细胞总蛋白。用Bradford法测定含量后,经12%SDS-PAGE处理后转移至PVDF膜上。用体积分数为5%的脱脂奶粉室温封闭1h,分别加1∶1 000稀释的抗人caspase-9、caspase-3抗体,4℃ 孵育过夜,洗膜后加1∶2 000稀释的碱性磷酸酶标记的二抗,室温孵育1h,洗膜后使用ECL试剂进行检测,Bio-Rad凝胶成像图像分析系统照相记录结果。
1.7 统计学处理
用SPSS 10.0软件完成统计学处理,*P<0.05表示差异有统计学意义,**P<0.01表示差异有极显著统计学意义。
2 结果与讨论
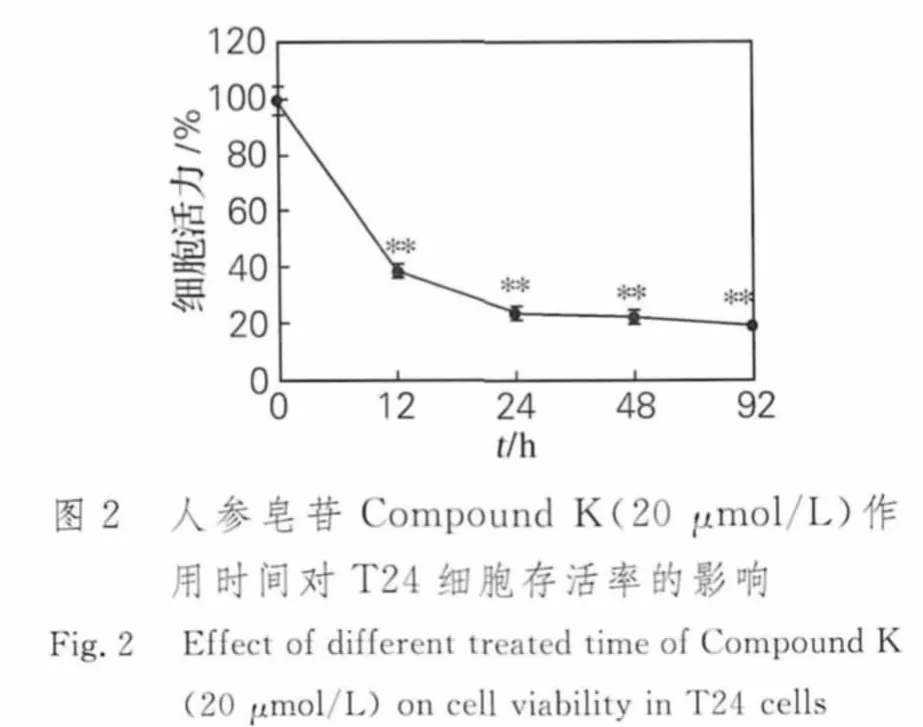
2.1 人参皂苷Compound K对T24细胞存活率的影响
如图1和2所示,人参皂苷Compound K对T24细胞的增殖具有明显的抑制效应。MTT检测结果显示,随着人参皂苷Compound K浓度和作用时间的增加细胞存活率明显下降,呈剂量和时间依赖关系。

2.2 人参皂苷Compound K诱导T24细胞凋亡的形态学
不同浓度人参皂苷Compound K处理T24细胞24h后,如图3所示,荧光显微镜下可观察到明显的凋亡细胞形态,即细胞体积变小,染色质凝集、凋亡小体形成、核内可见致密的颗粒状荧光,并呈剂量依赖关系。对照组则无明显的细胞凋亡特征。

图3 人参皂苷Compound K处理后T24细胞形态观察(荧光显微镜×200)Fig.3 Morphology observation of T24cells treated by ginsenoside Compound K(fluoroscope×200)
2.3 人参皂苷Compound K对T24细胞凋亡的作用
不同浓度人参皂苷Compound K处理T24细胞24h后,收集细胞,用流式细胞仪检测细胞凋亡率。结果显示,随着人参皂苷Compound K浓度的增加(5、10、15、20、25μmol/L),细胞凋亡率明显上升,从11.3%(对照组)分别上升至14.2%、16.8%、19.6%、94.3%、95.4%。
2.4 人参皂苷Compound K对T24细胞caspase-3和caspase-9蛋白表达的影响
用不同浓度的人参皂苷Compound K对T24细胞作用24h后,观察caspase-3和caspase-9蛋白表达情况,与对照组比较。从图4可以看出,随着人参皂苷Compound K浓度的增加,与空白对照组相比,蛋白表达变化渐趋明显,caspase-3和caspase-9蛋白表达水平明显增高。

图4 人参皂苷Compound K对T24细胞中caspase-9和caspase-3蛋白表达的影响Fig.4 Effect of Compound K on expression of caspase-9and caspase-3proteins in T24cells
3 结 论
通过研究人参皂苷Compound K对膀胱癌T24细胞的作用发现,人参皂苷Compound K能够抑制T24膀胱癌细胞生长,诱导癌细胞发生凋亡,呈剂量和时间依赖性,其作用机制和caspase蛋白的激活有关。本研究对人参皂苷Compound K应用于临床膀胱癌的治疗提供了实验依据,人参皂苷Compound K有望成为一种具有良好应用前景的抗癌药物。
[1]KIM J H,CHO S Y,LEE J H,et al Neuroprotective effects of ginsenoside Rg3against homocysteineinduced excitotoxicity in rat hippocampus[J].Brain Research,2007,1136(1):190-199.
[2]YUN T K,LEE Y S,LEE Y H,et al.Anticar einogenic effect ofPanaxginsengC.A.meyer and identification of active compounds[J].Journal of Korean Medical Science,2001,16(Supp1):S6-S18.
[3]李翠翠,庄子瑜,刘廷强,等.转化人参二醇类皂苷为C-K的特异人参皂苷糖苷酶的纯化及性质[J].大连工业大学,2010,29(1):11-14.(LI Cui-cui,ZHUANG Zi-yu,LIU Ting-qiang,et al.Purification and characterization of the special ginsenosidase transforming protopanaxadiol ginsenosides into ginsenoside C-K[J].Journal of Dalian Polytechnic University,2010,29(1):11-14.)
[4]李大磊,李延团.人参皂苷CK乳注射液对新西兰兔的长期毒性试验研究[J].中国中医药现代远程教育,2011,9(3):188-189.
[5]周清,姚善华,韩海彬.预防膀胱癌术后复发的研究进展[J].重庆医学,2011,40(24):2465-2467.
