盐酸青藤碱固体脂质纳米粒药动学和药效学研究
2013-09-17李莎莎危红华宋艳丽韩腾飞鞠大宏赵宏艳郝保华
李莎莎, 程 亮, 危红华, 宋艳丽, 韩腾飞, 鞠大宏, 赵宏艳, 郝保华*
(1.西北大学生命科学学院,陕西西安710069;2.中国中医科学院中医基础理论研究所,北京100700)
盐酸青藤碱 (sinomenine hydrochloride)具有抗炎、抗氧化、镇痛和免疫抑制作用,主治类风湿性关节炎等疾病,临床疗效确切[1-2]。有研究表明[3-4],盐酸青藤碱的镇痛作用有两方面,一方面作用于外周,发挥抗炎镇痛作用,一方面作用于中枢,发挥中枢镇痛作用。但是由于其半衰期短,代谢快,口服给药有严重的胃肠道副反应,限制了它的利用[5]。
固体脂质纳米粒 (solid lipid nanoparticles)是20世纪90年代中期兴起的一种新型纳米粒载药系统,具有可控制药物释放、避免药物泄露以及良好的靶向性等特点[6],又兼具脂质体、微乳等毒性低、能大规模生产的优点,是一种极具发展潜力的新型给药系统[7-9],固体脂质纳米粒的这些优点弥补了盐酸青藤碱口服给药的缺陷。本实验采用高温乳化-低温固化法制备盐酸青藤碱固体脂质纳米粒,以单硬脂酸甘油酯和卵磷脂为载体材料,以泊洛沙姆和聚山梨酯-80为表面活性剂[10]。同时也研究了两种不同给药方式下固体脂质纳米粒对盐酸青藤碱药动学和药效学的影响,为安全、高效、方便利用盐酸青藤碱的镇痛作用提供参考。
1 材料与仪器
恒温磁力搅拌器 (江苏省金坛市医疗仪器厂);FJ—200高速分散匀质机 (上海标本模型厂);YP—5001电子天平 (上海良平仪器仪表有限公司);高效液相色谱仪 (1525型泵,2487型检测器,Waters公司);TGL—16B离心机 (上海安亭科学仪器有限公司);RCY—2型热板测痛仪(上海康为医疗科技发展有限公司)。
盐酸青藤碱 (质量分数≥98.5%,西安小草植物科技有限公司);单硬脂酸甘油酯 (上海山浦化工有限公司);卵磷脂 (天津市科密欧化学试剂研发中心);泊洛沙姆188(德国BASF公司);聚山梨酯-80(药用级,成都市科龙化工试剂厂);甲醇为色谱纯,其余均为分析纯,水为蒸馏水。
昆明种小鼠 (雌雄兼用,体质量18~22 g),SD大鼠 (体质量180~220 g),许可证号:SCXK(军)2007-007,均由第四军医大学实验动物中心提供。
2 方法与结果
2.1 对照品溶液的制备 精密称取在105℃干燥至恒定质量的盐酸青藤碱2.5 mg,加流动相溶解并定容至50 mL棕色量瓶中,配得质量浓度为50 μg/mL的溶液,作为对照品溶液。
2.2 样品处理[11]
2.2.1 血样的处理 将0.2 mL血样加入涂有肝素钠的离心管中,8 000 r/min离心后取50μL血浆置于10 mL试管中,加入0.5 mL氢氧化钠 (0.1 mol/L)混匀,再加入5 mL三氯甲烷涡旋5 min,3 000 r/min离心分离三氯甲烷后按上述步骤重复提取一次,合并三氯甲烷液,于55℃下将溶剂蒸干,残余物用0.1 mL流动相溶解,取20μL进样,记录色谱图和峰面积。
2.2.2 脑组织的处理 取大鼠脑组织,剥离表面血管并用滤纸吸净血迹,称定质量,加入3倍量的生理盐水,使用组织匀浆机匀浆5 min,精密吸取组织匀浆液200μL于1.5 mL离心管中,加入0.1 mol/L的氢氧化钠1.0 mL,4 500 r/min离心10 min,取上清液500μL于10 mL试管中,加入5 mL三氯甲烷涡旋5 min,静置分离三氯甲烷后重复提取一次,合并三氯甲烷液,于55℃下将溶剂蒸干,用0.1 mL流动相溶解,取20μL进样。
2.3 HPLC法测定盐酸青藤碱[12-13]
2.3.1 色谱条件 ODSC18色谱柱 (150 mm×4.6 mm,5μm),流动相为甲醇-磷酸二氢钠 (0.01 mol/L)-乙二胺 (体积比为55∶45∶0.25),体积流量0.8 mL/min,柱温为30℃,检测波长263 nm,进样体积为20μL。
2.3.2 标准曲线的绘制 用甲醇将上述配制好的盐酸青藤碱对照品贮备液依次稀释成质量浓度分别为1、5、10、20、40、60、80、100μg/mL的对照品溶液,取空白血浆和脑组织匀浆液各1 mL,然后分别加入上述配制好对照品稀释液,得到一系列含盐酸青藤碱分别为50、40、20、10、0.4、0.2、0.1μg/mL的溶液。按照2.2项下操作处理上述样品,再按照2.3.1项下操作,以待测物质量浓度C为横坐标,以对照品的峰面积A为纵坐标进行回归运算,得标准曲线方程,如表1。
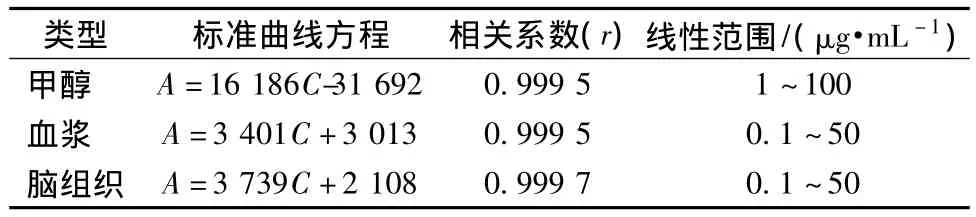
表1 盐酸青藤碱的标准曲线、相关系数、线性范围Tab.1 Standard curves,correlation coefficients,linear ranges of sinomenine hydrochloride
盐酸青藤碱对照品、空白辅料、空白血浆、空白脑组织、含药血浆、含药脑组织的色谱如图1所示。
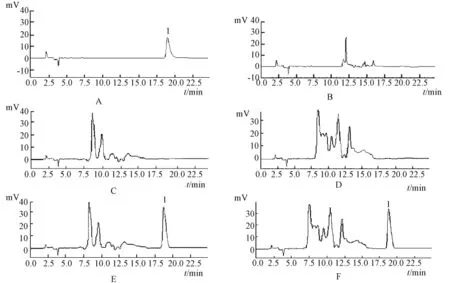
图1 含药标准品 (A)、空白纳米粒 (B)、空白血浆 (C)、空白脑组织 (D)、含药血浆 (E)、含药脑组织 (F)的HPLC色谱图Fig.1 Chromatograms of sinomenine hydrochloride standard(A),blank solid lipid nanoparticles(B),blank blood(C),blank brain tissue(D),blood sam ple of sinomenine hydrochloride(E),brain tissue sample of sinomenine hydrochloride(F)
2.3.3 方法学考察 精密度与回收率实验取不同质量的盐酸青藤碱贮备液分别加入1 mL空白固体脂质纳米粒和1 mL空白血浆中,使盐酸青藤碱质量浓度分别为10、20、40μg/mL,按2.3.1项方法操作,每一质量浓度进样6次,计算其回收率及及精密度,结果见表2。
表2 盐酸青藤碱的回收率和精密度(±s,n=6)Tab.2 Recoveries and precisions of sinomenine hydrochloride(±s,n=6)
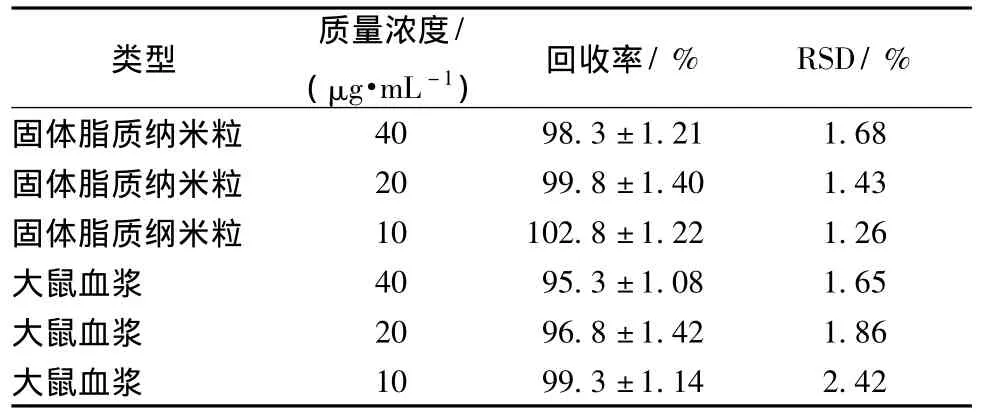
表2 盐酸青藤碱的回收率和精密度(±s,n=6)Tab.2 Recoveries and precisions of sinomenine hydrochloride(±s,n=6)
类型 质量浓度/(μg·mL-1) 回收率/% RSD/%固体脂质纳米粒 40 98.3±1.21 1.68固体脂质纳米粒 20 99.8±1.40 1.43固体脂质纲米粒 10 102.8±1.22 1.26大鼠血浆 40 95.3±1.08 1.65大鼠血浆 20 96.8±1.42 1.86大鼠血浆10 99.3±1.14 2.42
2.4 盐酸青藤碱固体脂质纳米粒的制备
2.4.1 盐酸青藤碱固体脂质纳米粒的制备[14]称取处方量的单硬脂酸甘油酯、卵磷脂,加热至75℃使熔融,作为油相。取处方量泊洛沙姆、聚山梨酯-80加入75℃水中,在搅拌条件下加入处方量的盐酸青藤碱,并搅拌使分散均匀,作为水相。在恒温磁力搅拌器作用下,将油相趁热滴加到同温度水相中,利用高速分散匀质机匀质10 min,用0.22μm微孔滤膜过滤,即得乳白色盐酸青藤碱固体脂质纳米粒胶体分散液。同法制备不含盐酸青藤碱的固体脂质纳米粒,作为空白对照。
2.4.2 盐酸青藤碱固体脂质纳米粒的质量评价[15]
2.4.2.1 形态观察 取盐酸青藤碱固体脂质纳米粒适量,加适量的蒸馏水稀释后滴加至覆盖铜网的碳膜上,用磷钨酸复染色法复染,置于激光透射电子显微镜下观察其外观形态,测定结果可知盐酸青藤碱固体脂质纳米粒呈球形或椭球形,外观圆整规则,分散性好。结果见图2。
2.4.2.2 粒径分布 另取盐酸青藤碱固体脂质纳米粒适量,用适量的蒸馏水稀释后置于激光动态散射仪的样品管中测定其粒径及分布。由测定结果可知盐酸青藤碱固体脂质纳米粒的平均粒径为(145.3±7.2)nm,其分散性指数为 0.091±0.016,与激光透射电子显微镜观察的结果基本吻合。结果见图3。
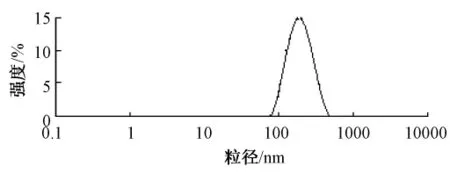
图3 盐酸青藤碱固体脂质纳米粒粒径分布Fig.3 Particle size distribution of sinomenine hydrochloride solid lipid nanoparticles
2.4.2.3 包封率和载药量 精密量取盐酸青藤碱固体脂质纳米粒溶液1 mL,以30 000 r/min的速度离心60 min,对盐酸青藤碱固体脂质纳米粒溶液进行游离药物和纳米粒的分离,精密量取上清液适量,加甲醇稀释至一定倍数,取20μL上述溶液,按2.3.1项测定其游离药物的量。
精密量取盐酸青藤碱固体脂质纳米粒溶液1 mL,直接加甲醇破乳,并超声提取,精密量取破乳后溶液,加甲醇稀释至一定倍数,取20μL上述溶液,按2.3.1项测定其总药物含有量。按下列公式计算,得出包封率和载药量,结果见表3。
包封率=[(m总-m游)/m总]×100%
载药量=[(m总-m游)/m质]×100%
式中m总表示药物总量,m游表示未包封于纳米粒中游离的药物,m质表示含药纳米粒的总质量。

表3 3批盐酸青藤碱固体脂质纳米粒包封率和载药量Tab.3 Encapsulation efficiency and drug loading of sinomenine hydrochloride solid lipid nanoparticles
2.5 体外释放度测定 以去离子水为溶出介质,分别精密量取盐酸青藤碱水溶液和盐酸青藤碱固体脂质纳米粒混悬液各2 mL于透析袋中,放入37℃200 mL溶出介质中。分别在0.25、0.50、1.0、2.0、4.0、6.0、8.0、12.0、24.0、48.0 h取释放液1 mL,过0.22μm滤膜,进行HPLC测定,同时补充同温度的溶出介质1 mL。测定盐酸青藤碱质量浓度,计算累计释放率。以时间 (min)为X轴,以累积释放率 (%)为Y轴绘制释放曲线,结果见图4。
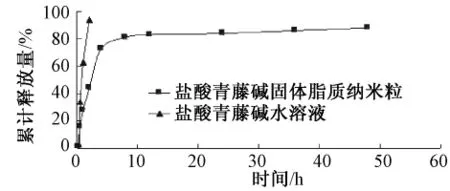
图4 盐酸青藤碱累积释放曲线Fig.4 In vitro release curves of sinomenine hydrochloride
从图4可以看出,盐酸青藤碱水溶液释放在2 h达到平台期,即能完全释放,累积释放为(93.5±0.4)%。盐酸青藤碱从纳米粒中释放2 h的累积释放量为44.6%,表现出明显的缓释性;0~4 h释放速度较快,8 h以后进入平台期,趋于平缓,48 h累积释放量为 (88.3±0.6)%。说明盐酸青藤碱纳米粒缓释性优于盐酸青藤碱溶液,有很好的缓释作用。
2.6 盐酸青藤碱固体脂质纳米粒体内药-时曲线的测定 将12只大鼠随机分成4组,每组3只,其中两组为尾静脉注射组,另外两组为经皮给药组。实验前禁食14 h,经皮给药组大鼠脱去背部2.0 cm×2.0 cm毛,分别涂抹盐酸青藤碱溶液和盐酸青藤碱固体脂质纳米粒 (涂抹量为40 mg/kg),尾静脉注射组分别按照盐酸青藤碱10 mg/kg的剂量分别尾静脉注射盐酸青藤碱溶液和盐酸青藤碱固体脂质纳米粒,在给药 0.25、0.50、1.0、2.0、4.0、8.0、12.0 h分别对各组大鼠眼眶静脉丛取血0.2 mL,按照2.2.1项方法操作,计算血液中药物浓度。药-时曲线结果见图5。尾静脉注射两种制剂后,固体脂质纳米粒组药物在血浆中的分布较水溶液组有明显提高了血药浓度的可维持时间。4 h时,注射盐酸青藤碱水溶液已检测不到药物,而注射盐酸青藤碱固体脂质纳米粒的还能保持一定的血药浓度。
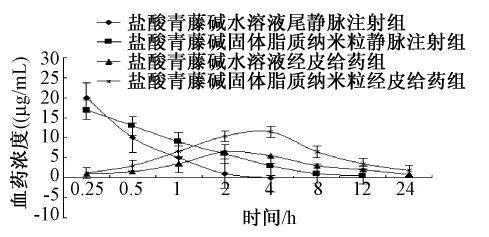
图5 盐酸青藤碱不同给药方式的药-时曲线Fig.5 Concentration-time curve of sinomenine hydrochloride with different adm inistration in rats
2.7 盐酸青藤碱固体脂质纳米粒对大鼠镇痛作用研究
2.7.1 中枢镇痛药效的研究 对药物中枢镇静止痛药效研究常采用小鼠热板痛阈法[16-17],操作如下:取体质量20 g左右的雌性小鼠,置于加热至(55±0.5)℃的热板上测定其痛阈值,以舔后足为指标,每只测2次,间隔5 min,取其平均值作为正常痛阈值,选择痛阈值不超过30 s的小鼠。结果见表4。
表4 镇痛实验(n=4,±s)Tab.4 Analgesic efficacy of sinomenine hydrochloride(n=4,±s)
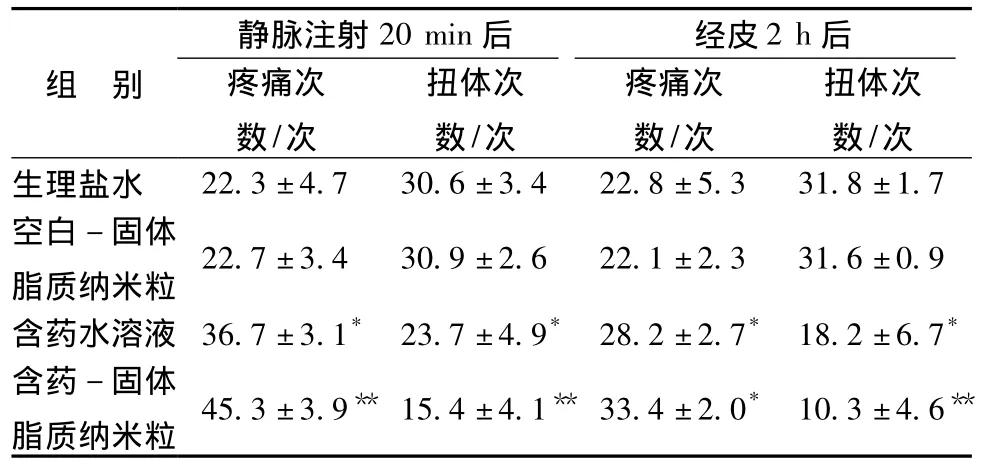
表4 镇痛实验(n=4,±s)Tab.4 Analgesic efficacy of sinomenine hydrochloride(n=4,±s)
注:与生理盐水组比较,*P <0.05,**P <0.01
组 别静脉注射20 min后 经皮2 h后疼痛次数/次扭体次数/次疼痛次数/次扭体次数/次生理盐水 22.3±4.7 30.6±3.4 22.8±5.3 31.8±1.7空白-固体脂质纳米粒22.7±3.4 30.9±2.6 22.1±2.3 31.6±0.9含药水溶液 36.7±3.1* 23.7±4.9* 28.2±2.7* 18.2±6.7*含药-固体脂质纳米粒 45.3±3.9** 15.4±4.1** 33.4±2.0* 10.3±4.6**
静脉注射组将32只小鼠,随机分成4组,每组8只,分别尾静脉注射生理盐水,空白固体脂质纳米粒,盐酸青藤碱溶液,盐酸青藤碱固体脂质纳米粒,给药剂量为10 mg/kg,20 min后测各小鼠的痛阈值。立即处死小鼠取其脑组织,按2.2.2项下操作,测其脑组织中盐酸青藤碱含有量。
经皮给药组取32只雌性小鼠,随机分为4组,每组8只,脱去背部2.0 cm×2.0 cm毛,分别涂抹生理盐水、空白固体脂质纳米粒、盐酸青藤碱溶液、盐酸青藤碱固体脂质纳米粒,给药剂量为40 mg/kg,2 h后测定各组小鼠的痛阈值,然后立即处死小鼠,按2.2.2项下操作,测其脑组织药物含有量。
2.7.2 外周抗炎镇痛药效的研究 对药物外周抗炎止痛药效研究常采取乙酸扭体法[5]。结果见表5。
静脉注射组:操作如下:取32只体质量20 g左右雌雄兼用的小鼠,随机分为4组,每组8只,分别尾静脉注射生理盐水、空白固体脂质纳米粒、盐酸青藤碱溶液、盐酸青藤碱固体脂质纳米粒,给药剂量为10 mg/kg。15 min后分别给各组小鼠腹腔注射0.6%醋酸溶液0.2 mL,记录注射醋酸后20 min内小鼠扭体次数。并从各组小鼠眼眶静脉丛取血0.1 mL,按2.2.1项下操作,测其血药浓度。
经皮给药组取32只小鼠,随机分为4组,每组8只,脱去背部2.0 cm×2.0 cm毛,分别涂抹生理盐水、空白固体脂质纳米粒、盐酸青藤碱溶液、盐酸青藤碱固体脂质纳米粒,给药剂量为40 mg/kg,2 h后腹腔注射0.6%醋酸溶液0.2 mL,记录20 min内小鼠扭体次数。并从各组小鼠眼眶静脉丛取血0.1 mL,按2.2.1项下操作,测其血药浓度。
表5 药效实验(n=4,±s)Tab.5 Pharmacodynam ics of sinomenine hydrochloride(n=4,±s)

表5 药效实验(n=4,±s)Tab.5 Pharmacodynam ics of sinomenine hydrochloride(n=4,±s)
注:与生理盐水组比较,**P <0.01,*P <0.05
组别静脉注射20 min后 经皮2 h后脑组织含药量/(μg·mL -1)血浆含药量/(μg·mL -1)脑组织含药量/(μg·mL -1)血浆含药量/(μg·mL -1)生理盐水 0 0 0 0空白-固体脂质纳米粒 0 0 0 0含药水溶液 2.71±0.02 8.1±0.05 1.56±0.07 6.5±0.05含药-固体脂质纳米粒 4.82±0.06** 11.6±0.04* 3.3±0.04* 13.3±0.02**
表4及表5即静脉注射和经皮两种不同给药方式分别对其中枢镇痛和外周抗炎镇痛药效实验的结果。盐酸青藤碱固体脂质纳米粒较盐酸青藤碱溶液,在两种不同给药方式下,对小鼠痛阈提高率都有很大程度增加,尾静脉注射盐酸青藤碱固体脂质纳米粒30 min后其痛阈值的提升率显著高于经皮给药盐酸青藤碱固体脂质纳米粒。
醋酸扭体实验发现,在小鼠腹部注射0.6%醋酸溶液后,各组动物均出现明显的扭体反应,其中给药组动物的扭体反应明显减轻。在相同剂量的情况下,相比而言盐酸青藤碱固体脂质纳米粒经皮给药途径组小鼠扭体反应次数 (18.2±6.7)明显少于静脉注射途径组小鼠扭体反应次数 (23.7±4.9),说明经皮给药对外周镇痛具有显著的抑制率。
3 讨论
盐酸青藤碱固体脂质纳米粒的各项评价指标均显示该制剂质量良好,工艺简单;比较盐酸青藤碱水溶液和盐酸青藤碱固体脂质纳米粒的体外释药结果可以看出,盐酸青藤碱固体脂质纳米粒比盐酸青藤碱水溶液具有明显的缓释作用,在最初的一段时间内药物释放的速率比较快,但在之后的考察时间内则表现出明显的缓释作用,这是由于突释阶段的药物主要来自吸附在纳米粒表面以及包埋在载体浅表的药物分子,同时纳米粒巨大的比表面积及其表面结合的表面活性剂分子也有利于药物的溶出,导致药物在漏槽条件下的快速释放[18-19],或者是因为盐酸青藤碱固体脂质纳米粒的粒径在200 nm以下能够透过220μm的滤膜[20]。
体内研究证实,盐酸青藤碱固体脂质纳米粒不论是在静脉注射还是经皮给药均有很好的缓释效果,这与前一部分的体外释药结果是一致的。因此在镇痛和醋酸扭体实验中发现盐酸青藤碱固体脂质纳米粒因其缓释作用可以显著的延长其作用时间。静脉注射镇痛药效研究发现,盐酸青藤碱固体脂质纳米粒能使脑组织中药物的量有一定的增加,中枢镇痛作用有所加强。这可能是盐酸青藤碱固体脂质纳米粒中的聚山梨酯-80可以增加固体脂质纳米粒与脑组织细胞融合,使药物透过血脑屏障,增加药物中枢镇痛作用的效果。
[1]刘 强,周莉玲,李 锐.青藤碱的研究概况[J].中草药,1997,28(4):247-249.
[2]蔡 颖,邱赛红,孙必强.盐酸青藤碱治疗风湿类疾病研究概况[J].中医药导报,2006,12(12):84-86.
[3]李 乐,张彩玲,宋必卫.青藤碱的药理研究与临床应用[J].中国新药与临床药理,2006,17(4):310-313.
[4]吴宗群.中药青风藤的药理作用及临床应用[J].中国药师,2006,9(9):857-858.
[5]祝清芬,谢元超,范治云.盐酸青藤碱喷雾剂主药药效试验[J].中成药,2005,27(2):231-232.
[6]乔明艳,李全斌.盐酸青藤碱新剂型研究进展[J].医学理论与实践,2010,23(3):275-276.
[7]Muller R H,Mader K,Gohla S.Solid lipid nanoparticles(SLN)for controlled drug delivery—a review of the state of art[J].Eur J Pharm Biopharm,2000,50(1):161-177.
[8]Muhlen A,Sehw A,Mehnert W.Solid lipid nanoparticles(SLN)for controlled drug delivery—drug release and release mechanism[J].Eur J Pharm Biopharm,1998,45(2):149-155.
[9]李欣玮,孙立新.固体脂质纳米粒作为药物载体的研究进展[J].化学进展,2007,19(1):87-92.
[10]马 莉,魏玉辉,段好刚,等.地西泮固体脂质纳米粒的制备及大鼠经鼻腔给药的药动学研究[J].中国药学杂志,2011,46(1):44-47.
[11]惠 先,徐 坤,豆婧婧,等.青藤碱传递体经皮给药的药动学和药效学研究[J].中国药学杂志,2011,46(5):374-377.
[12]程 亮,韩腾飞,李莎莎,等.盐酸青藤碱微囊的制备及其质量评价[J].中草药,2012,43(5):880-884.
[13]韩腾飞,程 亮,危红华,等.盐酸青藤碱醇质体的制备及其性质考察[J].中草药,2012,43(7):1300-1305.
[14]陈延杰,陈卫东.新藤黄酸固体脂质纳米粒的制备与质量评价[J].中国药业,2011,20(21):36-38.
[15]闫菁华,豆婧婧,徐 坤,等.甘草次酸醇质体水凝胶贴剂的制备与透皮给药研究[J].第二军医大学学报,2011,32(7):763-766.
[16]罗 烈,杨 健,宋金春,等.甲苯酰青藤碱的镇痛抗炎作用[J].中国医院药学杂志,2005,25(3):196-198.
[17]揭金阶,郭咸希.甲酰基青藤碱的镇痛抗炎作用研究[J].中国药师,2010,13(8):1116-1118.
[18]李 萌,王 芳.高温乳化-低温固化法制备芦丁固体脂质纳米粒及理化性质分析[J].临床误诊误治,2010,23(7):606-608.
[19]舒乐新,赵启铎,武昊昀.灯盏花素固体脂质纳米粒的制备及体外释放的研究[J].辽宁中医杂志,2011,38(1):125-127.
[20]张继东,万江陵.丹参酮A固体脂质纳米粒的制备及体外释药[J].中国医院药学杂志,2012,32(6):431-436.
