DJ-1拮抗ROS介导Beclin-1上调在缺氧复氧HL-1心肌细胞中的作用
2013-09-15李文林徐建军朱书强车建鹏
晏 浩,李文林,徐建军,朱书强,龙 翔,车建鹏
(南昌大学1.第二附属医院胸心外科;2.医学院病理生理教研室,江西南昌330006)
癌基因DJ-1(CAP1/RS/PARK7)在肿瘤生物学中发挥极为重要的作用,它可保护肿瘤细胞应对缺氧诱导的细胞死亡和适应氧化应激[1]。DJ-1在人体各正常组织又广泛表达,其通过在亚细胞水平的再分布发挥多重作用。常染色体隐性遗传DJ-1突变可以导致早发型帕金森病,缺乏DJ-1类型的帕金森病患者对中风损伤更易感,而恢复DJ-1表达可以明显减少氧化应激[2]。心肌缺血再灌注后往往同时出现坏死、凋亡和自噬[3];其中,自噬是细胞长存蛋白和细胞器代谢的主要方式。缺血再灌注损伤不同阶段自噬发挥不同作用,缺血阶段AMPKa启动低程度自噬被认为是应急供能的保护作用,而再灌注阶段通过激活JNK导致过表达Beclin-1,过度自噬加重心肌损伤[4]。最近研究认为DJ-1参与自噬调控[5],本研究通过以慢病毒为载体干扰心肌HL-1细胞DJ-1基因表达,探讨其对缺氧复氧损伤中ROS影响对心肌自噬及预后的作用机制。
1 材料与方法
1.1 主要试剂
annexinⅤ-PI凋亡检测试剂盒和活性氧检测试剂盒 (南京凯基公司);monodansylcadaverin(MDC)和N-acetylcysteine(NAC)(Sigma-Aldrich美国);DJ-1shRNA慢病毒(sc-37081)、空对照慢病毒(sc-108080)和抗体 β-actin(Santa Cruz公司);抗体 Beclin-1(Cell Signaling公司)和 DJ-1、LC3(Abcam公司)及辣根过氧化物酶偶联抗体(北京中杉公司);增强型化学发光显色试剂盒(Thermo公司);蛋白提取试剂盒、蛋白酶磷酸酶复合抑制剂(普利莱公司);BCA蛋白定量(碧云天公司);其他试剂均为市售分析纯。
1.2 方法
1.2.1 细胞系培养和sh-DJ-1稳定转染细胞筛选:小鼠心肌HL-1细胞系来源于William Claycomb实验室,采用DJ-1shRNA慢病毒和空对照慢病毒感染HL-1细胞,慢病毒以感染复数值为30孵育HL-1细胞转染,感染后96 h传代培养;感染细胞再培养48 h后嘌呤霉素10 mg/L筛选,再常规培养待实验。
1.2.2 缺氧复氧损伤模型的建立:稳定表达筛选后HL-1细胞进行缺氧复氧培养,37℃预热配置的缺氧液和复氧液,将培养的HL-1细胞换用的预充有95%N2+5%CO2的缺氧液,95%N2+5%CO2的密闭容器中培养2 h。再将缺氧的心肌细胞换用预充95%O2+5%CO2的含糖复氧液,并在95%O2+5%CO2的密闭容器中培养4 h,建立缺氧/复氧损伤模型。
1.2.3 实验分组:根据实验方案实验分为5组:1)正常对照组(control):更换正常培养基后在CO2培养箱正常培养6 h;2)单纯缺氧复氧组(H/R):更换缺氧液缺氧培养2 h,再更换复氧液复氧培养4 h;3)空慢病毒缺氧复氧组(H/R control virus):空慢病毒感染细胞更换缺氧液缺氧培养2 h,再更换复氧液复氧培养4 h;4)慢病毒shDJ-1缺氧复氧组(H/R shDJ-1 virus):慢病毒shDJ-1感染细胞更换缺氧液缺氧培养2 h,再更换复氧液复氧培养4 h;5)慢病毒shDJ-1缺氧复氧 +NAC(H/R shDJ-1 virus plus NAC)组:慢病毒shDJ-1感染细胞更换缺氧液(含5 mmol/L NAC)缺氧培养2 h,再更换复氧液(含5 mmol/L NAC)复氧培养4 h。
1.2.4 细胞蛋白制备和Western blot检测细胞蛋白表达水平:按照细胞总蛋白提取试剂盒说明书提取蛋白,并按BCA法蛋白定量检查蛋白浓度,采用聚丙烯酰氨凝胶电泳,转至PVDF膜2 h,Beclin-1和DJ-1以 β-actin为内参蛋白,LC3蛋白转化以LC3-Ⅱ/LC3-Ⅰ比值参考,胶片曝光,通过ImageJ图像软件分析统计。
1.2.5 流式细胞仪检测各组HL-1细胞内ROS、自噬溶酶体和死亡情况:细胞死亡检测参照AnnexinⅤ-PI细胞凋亡试剂盒说明书,通过流式细胞仪(BD)激发波长488 nm,AnnexinⅤ荧光信号呈绿色,表示早期凋亡细胞,PI荧光信号呈红色,表示晚期凋亡细胞和其他膜完整破坏的死亡细胞;MDC染色检测细胞内的自噬体,收集各组HL-1细胞洗涤后加入50 μmol/L MDC避光孵育10 min,洗涤后通过流式细胞仪激发波长340 nm,而DCFH-DA染色检测细胞内的自噬体,收集各组HL-1细胞洗涤后加入10 μmol/L DCFH-DA 避光孵育20 min,洗涤后通过流式细胞仪(BD)激发波长488 nm。所有数据通过CellQuest软件分析统计。
1.3 统计学分析
采用SPSS 11.0统计软件,所有实验重复3~5次,数据以均数±标准(±s)表示,使用单因素方差分析(One-way ANOVA),组间有显著差异者用Tukey's-t检验进行两两比较。
2 结果
2.1 DJ-1shRNA慢病毒对HL-1细胞DJ-1蛋白的沉默效率
相比正常对照和空慢病毒感染细胞,慢病毒shDJ-1感染细胞均显著下调DJ-1蛋白(图1)。
2.1 各组HL-1细胞内ROS水平变化
相比正常组,单纯缺氧复氧组显著上调HL-1细胞内ROS,而H/R shDJ-1 virus组加剧缺氧复氧导致ROS水平上调。使用自由基清除剂NAC可以有效减少HL-1细胞内ROS水平(图2)。

图1 慢病毒感染HL-1细胞DJ-1蛋白表达变化Fig 1 Expression change of DJ-1 after lentivirus transfection
2.3 各组HL-1细胞内自噬体数量和Beclin-1、LC3蛋白转化的变化
相比空病毒感染缺氧复氧组,慢病毒shDJ-1缺氧复氧组和慢病毒shDJ-1缺氧复氧+NAC组均减少DJ-1表达(图4);空病毒感染缺氧复氧组相比正常对照组增加LC3-Ⅰ转化为LC3-Ⅱ;而相比单纯缺氧复氧组和空病毒感染缺氧复氧组,H/R shDJ-1 virus组显著增加LC3-Ⅰ转化为LC3-Ⅱ,而NAC可以有效减少LC3-Ⅰ转化为LC3-Ⅱ(图5)。对于自噬主要蛋白Beclin-1,相比空病毒感染缺氧复氧组,H/R shDJ-1 virus组显著上调Beclin-1,而NAC可以有效减少Beclin-1上调(图4)。
相比正常对照组,单纯缺氧复氧组显著增加自噬体数量,而且H/R shDJ-1 virus组自噬体数量显著多于空病毒感染缺氧复氧组和单纯缺氧复氧组,但添加NAC并未显著减少自噬体数量(图3)。
2.4 各组HL-1细胞死亡情况
由于缺氧复氧时间较短,各组间PI染色的细胞死亡无明显差异;而在AnnexinⅤ染色中,而相比单纯缺氧复氧组和空病毒感染缺氧复氧组,H/R shDJ-1 virus组显著增加早期凋亡;而添加NAC可以显著减少DJ-1敲除导致的早期凋亡(图6)。

图2 慢病毒感染HL-1细胞缺氧复氧后ROS水平变化Fig 2 Change of ROS level after lentivirus transfection and hypoxia/reoxygenation

3 讨论
DJ-1是位于人染色体1p36.23位点的高度保守蛋白,一般认为DJ-1在细胞缺氧、氧化应激和分子伴侣等方面发挥重要作用。该研究采用心肌HL-1细胞缺氧复氧模型,观察到敲除DJ-1后可增加HL-1细胞内自噬体、上调Beclin-1和增加LC3-Ⅰ转化为LC3-Ⅱ的自噬标志过程,同时增加缺氧复氧HL-1细胞的死亡,而氧自由基清除剂NAC可以消除这些作用。

图5 慢病毒感染HL-1细胞缺氧复氧后LC3-Ⅰ转化LC3-Ⅱ程度变化Fig 5 Conversion of LC3-Ⅰ to LC3-Ⅱ after lentivirus transfection and hypoxia/reoxygenation
DJ-1被认为具有抗氧自由基的作用,在生理条件下DJ-1维持线粒体生理活性和减少氧自由基生成[6],在短期氧化应激就促进大量DJ-1被转运至线粒体,并在外膜形成二聚体直接抵抗氧化应激对细胞的损伤[7]。长时间应激时DJ-1进一步聚集到细胞核,DJ-1通过稳定抗氧化核转录因子Nrf2的结构,促进Nrf2调控的谷胱苷肽、谷氨酰半胱氨酸合成酶等抗氧化物质转录,减少氧化应激损伤[8-9]。
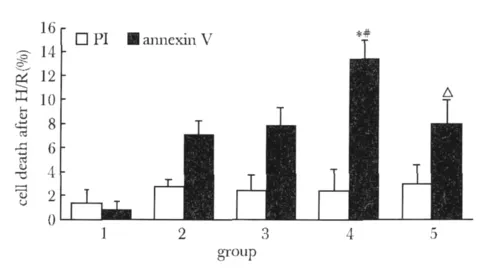
图6 慢病毒感染HL-1细胞缺氧复氧后细胞死亡情况Fig 6 Cell death after lentivirus transfection and hypoxia/reoxygenation
自噬是哺乳动物细胞大分子物质和细胞器的循环代谢的主要降解途径,氧化应激也被认为也是诱导自噬的主要因素[10],该研究发现DJ-1敲除明显上调ROS,而ROS水平增加可以明显上调Beclin-1表达,这与肿瘤细胞中通过JNK信号途径介导自噬相一致[11]。应激条件下,自噬的作用一直有争议,在心肌缺血再灌注损伤中,缺血期轻度自噬被认为有保护作用[12],而在灌注期激活过度Beclin-1介导自噬被认为会加重心肌损伤;而且凋亡和自噬之间关系密切,凋亡启动过程中激活的caspase可以剪切Beclin-1,剪切后形成的C端Beclin-1可以结合线粒体,并促进线粒体细胞色素C释放,导致细胞凋亡[13]。所以,推测在缺氧复氧模型中敲除DJ-1增加凋亡的机制可能也包括Beclin-1介导有害自噬而促进凋亡。
由于在神经元DJ-1、PINK1和Parkin对于大分子物质形成复合体介导异常折叠蛋白的降解过程;对于细胞器,例如线粒体,DJ-1也参与PINK1/Parkin介导的线粒体自噬[14]。而在心肌HL-1细胞敲除DJ-1并未明显影响自噬降解过程,有文献报道DJ-1与PINK1及Parkin的作用是平行互补的,所以可能DJ-1自噬介导作用可能被PINK1及Parkin所替代[15]。
DJ-1参与心肌缺血保护的机制颇为复杂,迄今尚未完全清楚,但抗氧化应激被认为是其主要机制,对DJ-1深入研究将为缺血心肌病的诊疗提供新的靶点。
[1] Vasseur S,Afzal S,Tardivel-Lacombe J,et al.DJ-1/PARK7 is an important mediator of hypoxia-induced cellular responses[J].Proc Natl Acad Sci U S A,2009,106:1111-1116.
[2] Aleyasin H,Rousseaux MW,Phillips M,et al.The Parkinson's disease gene DJ-1 is also a key regulator of stroke-induced damage[J].Proc Natl Acad Sci U S A,2007,104:18748 -18753.
[3]戴日新,李浪.心肌细胞凋亡信号传导通路与心肌损伤[J].基础医学与临床,2010:775-777.
[4]Matsui Y,Takagi H,Qu X,et al.Distinct roles of autophagy in the heart during ischemia and reperfusion:roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J].Circ Res,2007,100:914 -922.
[5]Gonzalez-Polo RA,Niso-Santano M,Gomez-Sanchez R,et al.DJ-1 as a modulator of autophagy:an hypothesis[J].Sci World J,2010,10:1574 -1579.
[6] Hayashi T,Ishimori C,Takahashi-Niki K,et al.DJ-1 binds to mitochondrial complex I and maintains its activity[J].Biochem Biophys Res Commun,2009,390:667-672.
[7]Junn E,Jang WH,Zhao X,et al.Mitochondrial localization of DJ-1 leads to enhanced neuroprotection[J].J Neurosci Res,2009,87:123 -129.
[8]Malhotra D,Thimmulappa R,Navas-Acien A,et al.Decline in NRF2-regulated antioxidants in chronic obstructive pulmonary disease lungs due to loss of its positive regulator,DJ-1[J].Am J Respir Crit Care Med,2008,178:592-604.
[9]Clements CM,McNally RS,Conti BJ,et al.DJ-1,a cancer-and Parkinson's disease-associated protein,stabilizes the antioxidant transcriptional master regulator Nrf2[J].Proc Natl Acad Sci U S A,2006,103:15091 -15096.
[10]Scherz-Shouval R,Elazar Z.Regulation of autophagy by ROS:physiology and pathology[J].Trends Biochem Sci,2011,36:30 -38.
[11] Ren H,Fu K,Mu C,et al.DJ-1,a cancer and Parkinson's disease associated protein,regulates autophagy through JNK pathway in cancer cells[J].Cancer Lett,2010,297:101 -108.
[12]李桂兰,杨洪双,郭彦.自噬在缺血性心脏病发病机制中的作用[J].基础医学与临床,2010:554-556.
[13]Wirawan E,Vande WL,Kersse K,et al.Caspase-mediated cleavage of Beclin-1 inactivates Beclin-1-induced autophagy and enhances apoptosis by promoting the release of proapoptotic factors from mitochondria[J].Cell Death Dis,2010,1:e18.doi:10.1038/cddis.2009.16
[14]Xiong H,Wang D,Chen L,et al.Parkin,PINK1,and DJ-1 form a ubiquitin E3 ligase complex promoting unfolded protein degradation[J].J Clin Invest,2009,119:650-660.
[15]Thomas KJ,McCoy MK,Blackinton J,et al.DJ-1 acts in parallel to the PINK1/parkin pathway to control mitochondrial function and autophagy[J].Hum Mol Genet,2011,20:40-50.
