Wnt2在肝细胞肝癌中的表达及对HepG2细胞增殖的影响
2013-09-15朱卓立李生伟
吴 堃,李 辉,朱卓立,李生伟
(重庆医科大学附属第二医院肝胆外科,重庆400010)
肝细胞肝癌是我国最常见的恶性肿瘤之一。研究肝癌发病过程中相关基因的相互作用不仅有助于更深层理解肝癌发病机制,且有助于发现靶向治疗的新靶点。
Wnt通路是由一系列癌基因和抑癌基因编码的蛋白质组成,其在调节胚胎发育与肿瘤发生、发展等关键的生理、病理过程中起重要作用[1]。Wnt2是Wnt家族中的成员,近年来诸多研究已证实,Wnt2与结直肠癌、胃癌、食管鳞状细胞癌、恶性胸膜间皮瘤、乳腺癌、胶质瘤和恶性黑色素瘤等的发生,发展有关[2-8]。
本研究探讨Wnt2在原发性肝细胞肝癌(Hepatocellular carcinoma,HCC)中的表达情况。同时,采用Wnt2基因特异性siRNA转染的方法,抑制人肝癌HepG2细胞中该基因的表达,以探讨Wnt2基因对肿瘤细胞的影响。
1 对象与方法
1.1 研究对象
收集重庆医科大学附属第二医院肝胆外科2010年11月—2011年10月间住院手术切除肝癌和配对癌旁组织(紧邻癌组织)56对(经病理学证实为原发性肝细胞性肝癌),同时收集正常肝组织20份(所获标本均获得重庆医科大学伦理委员会批准书及患者知情同意书)。新鲜组织在手术离体后立即去掉坏死组织、血块。将收集的标本分为2份,1份于30 min内以液氮冷冻,并置于-80℃低温冰箱保存备用。另1份放入10%甲醛固定。人肝癌HepG2细胞由重庆医科大学附属第二医院中心实验室所保存。
1.2 主要试剂
Trizol试剂盒、反转录试剂盒和SYBR®Green试剂盒(TAKARA公司);免疫组化试剂盒及DAB显色剂(重庆迈凯科技有限公司);Wnt2多克隆抗体、siRNA-Wnt2(Santa cruz公司);蛋白质提取试剂盒及蛋白浓度测定试剂盒(南京凯基生物科技发展公司);ECL化学发光试剂盒(Thermo公司);LipofectamineTM2000(Invetrogen公司)。
1.3 实验方法
1.3.1 荧光定量PCR检测Wnt2 mRNA表达:步骤:采用引物设计软件(Primer 5.0)进行引物序列设计:Wnt2上游引物:5'-CGGGAATCTGCCTTTGTTT A-3',下游引物:5'-TTCCTTTCCTTTGCATCCAC-3',内参基因GAPDH上游引物:5'-CGACCACTTTGTCA AGCTCA-3',下游引物:5'-AGGGGTCTACATGGCAA CTG-3'。按Trizol说明书提取RNA,按照Primescript反转录试剂盒合成cDNA,然后按SYBR Green反应条件进行荧光定量PCR反应,对反应的退火温度,引物浓度进行优化,获得最佳反应体系和条件,用Bio-Rad RealtimePCR仪进行检测。每个样本每次3个复孔,重复3次,反应完成后机器自动得出各样品的CT值,并且自动计算出基因相对表达量值。
1.3.2 免疫组织化学法检测Wnt2蛋白的表达:步骤:常规取材、脱水、石蜡包埋,制片;免疫组化法(SP法),按试剂盒说明进行操作,PBS代替一抗作为阴性对照,用已知阳性片作为阳性对照。Wnt2以胞质或胞核出现棕黄色或棕褐色为阳性信号。采用染色强度和染色细胞百分率综合评估。染色强度:无染色为0分;淡棕色为1分;棕色为2分;深棕色为3分。染色细胞百分率采取每张切片在200倍显微镜下随机选取5个高倍视野计数:阳性细胞数<25%为0分,25% ~50%为1分,51% ~70%为2分,>70%为3分。评分标准将两者积分相乘:0~1分为阴性(-),2~3分为弱阳性(+),4~6分为阳性(++),7~9分为强阳性(+++)。
1.3.3 质粒转染和细胞分组:序列设计:靶基因siRNA序列以及阴性对照序列均己在基因Gene Bank数据库中用BLAST检索,确认与靶细胞其他基因无同源性。Wnt2 siRNA序列为5'-GAAGATG GGAAGCGCCAAG-3',阴性对照siRNA序列为5'-T TCTCCGAACGTGTCAGGT-3'。步骤:制备HepG2细胞悬液接种于12孔板,加入含有10%胎牛血清RPMI 1640培养液于37℃,5%CO2培养箱中常规培养24 h再进行转染,按LipofectamineTM2000说明书步骤分别进行Wnt2-siRNA和阴性对照siRNA质粒转染。实验分为4组:转染Wnt2-siRNA的实验组,转染阴性对照 siRNA的阴性对照组,加入 LipofectamineTM2000和培养液的脂质体对照组,只加入培养液的空白对照组。
1.3.4 RT-qPCR检测转染后Wnt2 mRNA表达:转染24 h后,取1×106细胞 Trizol法提取总 RNA。反转录反应和PCR反应方法同前。
1.3.5 Western blot检测转染后Wnt2蛋白表达:转染48 h后,提取细胞中的总蛋白,SDS-聚丙烯酰胺凝胶电泳行蛋白分离,转移到PVDF模上,小牛血清封闭后,加入一抗(工作浓度1∶600),4 h,37 ℃摇床孵育过夜,洗膜3次,加入二抗(工作浓度1∶2 000),2 h,37℃孵育过夜,洗膜3次,将 PVDF膜置于HRP-ECL化学发光试剂中反应2 min。暗室中使X线片曝光,常规方法显影定影。
1.3.6 MTT法检测细胞增殖:取各组对数生长期的细胞,每孔1 000个接种于96孔培养板,每孔体积200 μL,每个样品设3个复孔,将培养板置入培养箱中,在37℃、5%CO2、含10%胎牛血清RPMI 1640培养液条件下培养24 h。分别于接种后24、48和72 h用MTT法检测。检测时,吸取各孔中培养液,加入新RPMI 1640 培养液180 μL和20 μL MTT 溶液。继续培养4 h,吸去上清液,每孔加入150 μL二甲基亚砜。用酶标仪检测570 nm波长下各孔的吸光度。
1.3.7 流式细胞仪检测细胞周期:取各组对数生长期的细胞,0.25%胰蛋白酶消化细胞,离心,弃上清液,PBS重悬细胞,加入在-20℃预冷的75%乙醇固定,4℃固定12 h,离心,弃冰乙醇,PBS冲洗,弃上清液;加入含有PI(碘化吡啶)和RNA酶的PBS染色液,置4℃避光染色1 h。上流式细胞仪检测细胞周期时相分布,统计各期细胞相对百分比。
1.4 统计学分析
数据采用SPSS17.0统计软件分析,计量资料以均值±标准差(±s)表示,采用单因素方差分析检验组间差异的显著性。计数资料以阳性率表示,采用卡方检验。
2 结果
2.1 肝癌、癌旁和正常肝组织中Wnt2 mRNA的检测
各样本的扩增曲线呈线性关系,溶解曲线呈单峰(图1)。肝癌组,癌旁组和正常组Wnt2基因表达水平分别为 3.492±0.494、2.050±0.416和0.765±0.192(P <0.05)。

图1 PCR扩增曲线和溶解曲线Fig 1 Primary curve and solubility curve

图2 各组中Wnt2蛋白的表达Fig 2 The expression of Wnt2 protein in groups(×200)
2.2 肝癌、癌旁和正常肝组织中Wnt2蛋白的检测
Wnt2蛋白的阳性信号主要定位于胞质和(或)胞核(图2)。肝癌、癌旁和正常肝组织间差异有显著性(P<0.01)(表1)。

表1 Wnt2蛋白在各组中的表达Table 1 The expression of Wnt2 protein in groups
2.3 siRNA转染后人肝癌HepG2细胞Wnt2 mRNA和蛋白的检测
转染后各组Wnt2基因及蛋白表达(表2,3,图3)。实验组低于各对照组(P<0.05)。
2.4 siRNA转染后对人肝癌HepG2细胞增殖的影响
在转染24、48和72 h后检测吸光度值。实验组与对照组相比均P<0.05(表4)。

表2 荧光定量PCR检测Wnt2在各组中的表达Table 2 The expression of Wnt2 in groups subjected to RT-qPCR(x ± s,n=3)

表3 Western blot检测Wnt2在各组中的表达Table 3 The expression of Wnt2 protein in groups subjected to western blot(x ± s,n=3)
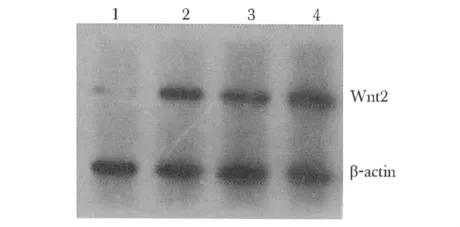
图3 Western bolt检测各组中Wnt2蛋白表达Fig 3 The expression of Wnt2 protein in groups used Western blot

表4 Wnt2-siRNA转染肝癌细胞对增殖活性的改变Table 4 The change of proliferation activity by Wnt2-siRNA transfection liver cancer cell(x ± s,A,n=3)
2.5 siRNA转染后对人肝癌HepG2细胞周期的影响
转染后实验组与对照组相比,G1期细胞数明显增多(P<0.05),S期细胞数明显减少(P<0.05),G2期无明显变化(表5)。
表5 Wnt2-siRNA转染肝癌细胞对细胞周期的影响Table 5 The influence of cell cycle by Wnt2-siRNA transfection liver cancer cell(±s,%,n=3)

表5 Wnt2-siRNA转染肝癌细胞对细胞周期的影响Table 5 The influence of cell cycle by Wnt2-siRNA transfection liver cancer cell(±s,%,n=3)
*P < 0.05 compared with control.
group cell cycle G0/G1 S G2/GM blank 38.6±3.7 43.2±2.5 18.2±2.0 negative control 40.4±1.2 41.2±2.7 18.0±1.5 liposome control 41.8±4.3 41.5±4.7 16.7±2.0 experimental 64.9±1.9* 19.9±1.3* 15.2±2.0*
3 讨论
Wnt基因的发现已有 30年,早在 1982年Nusse[9]等人将鼠乳腺肿瘤病毒整合到小鼠宿主染色体上,激活了该位点的基因并在小鼠中引起了肿瘤的发生,他们将该位点的基因命名为int1,且认为它是一种致癌基因。但后来的研究发现int1基因不仅出现在肿瘤中,在小鼠的胚胎发育中也起重要作用,与果蝇的胚胎发育基因wingless(wg)属同源基因,wg基因突变导致果蝇无翅。因此将二者名字结合提出了Wnt基因的称谓。Wnt基因在细胞正常的生长、发育、分化、凋亡中起作用,但是它也参与细胞的恶性转化,以及肿瘤细胞的侵袭和转移等一系列生理病理过程[10]。
目前,关于Wnt通路与肿瘤关系的研究多数集中于Wnt信号系统成员 E-cadherin、β-catenin、APC和Axin等,Wnt基因本身表达异常与肿瘤之间关系的研究较多的也仅是Wnt1和Wnt5,Wnt2研究的报道较少。为此,本实验一开始在人肝癌中测出了Wnt2基因的高表达,再进一步以Wnt2特异性siRNA转染人肝癌HepG2细胞来观察肝癌细胞的增殖生长情况。
本研究发现肝癌和癌旁中Wnt2 mRNA或蛋白都高于正常肝组织,且Wnt2特异性siRNA转染人肝癌细胞系HepG2后。实验组Wnt2基因表达低于各对照组,说明Wnt2 siRNA转染后能有效抑制细胞相应靶基因的表达。Western blot检测各组Wnt2蛋白表达的变化,发现其与Wnt2 mRNA的变化一致。实验结果证实了siRNA转染后不但能抑制靶基因的转录,也能抑制其蛋白的翻译和表达。MTT法检测显示实验组细胞增殖速度较对照组明显降低,提示用siRNA使Wnt2基因沉默后,能抑制肝癌细胞的增殖;而对照组之间无明显差别,从而排除了载体刺激因素导致细胞增殖力的改变。经流式细胞仪检测细胞周期的结果提示使用siRNA敲低肝癌细胞中Wnt2的表达后,G1期细胞数明显增多,S期细胞数明显减少,能够有效抑制肝癌细胞的生长,并引起肝癌细胞生长周期的停滞。
综上所述,Wnt2在肝癌中高表达,可以作为HCC诊断的一个重要新指标。转染靶向Wnt2的siRNA可有效敲低该基因在人肝癌细胞系HepG2内的表达,且抑制了细胞的增殖能力。因此,对其进一步研究可望提出肝癌治疗的新策略。
[1]Anastas JN,Moon RT.Wnt signaling pathways as therapeutic targets in cancer[J].Nat Rev Cancer,2012,21:11 -26.
[2]Park JK,Song JH,He TC,et al.Overexpression of Wnt-2 in colorectal cancers[J].Neoplasma,2009,56:119 -123.
[3]Cheng XX,Wang ZC,Chen XY,et al.Correlation of Wnt-2 expression and beta-catenin intracellular accumulation in Chinese gastric cancers:relevance with tumour dissemination[J].Cancer Lett,2005,223:339 -347.
[4]Wang W,Xue L,Liu H,et al.Aberrant changes of Wnt2/beta-catenin signaling pathway induced by sodium nitroprusside in human esophageal squamous cell carcinoma cell lines[J].Cancer Invest,2010,28:230 - 241.
[5]Mazieres J,You L,He B,et al.Wnt2 as a new therapeutic target in malignant pleural mesothelioma[J].Int J Cancer,2005,117:326 -332.
[6]Watanabe O,Imamura H,Shimizu T,et al.Expression of twist and wnt in human breast cancer[J].Anticancer Res,2004,24:3851 -3856.
[7]Wang GX,Zhang ZY,Pu PY,et al.Expression of core components of Wnt2 signaling pathway in gliomas[J].Zhonghua Bing Li Xue Za Zhi,2009,38:481 -482.
[8]Kashani-Sabet M,Rangel J,Torabian S,et al.A multi-marker assay to distinguish malignant melanomas from benign nevi[J].Proc Natl Acad Sci U S A,2009,106:6268 - 6272.
[9]Nusse R,Varmus HE.Many tumors induced by the mouse mammary tumor virus contain a provirus integrated in the same region of the host genome[J].Cell,1982,31:99 -109.
[10]Yang SH,Li SL,Dong ZM,et al.Epigenetic inactivation of Wnt inhibitory factor-1 in human esophageal squamous cell carcinoma[J].Oncol Res,2012,20:123-130.
