一株氨基半乳糖产生菌的筛选鉴定及培养条件研究
2013-09-13张荣岭王瑞明李丕武
张荣岭 王瑞明 李丕武
D-氨 基 半 乳 糖(D-Galactosamine), 又 称 2-氨基-2-脱氧-D-半乳糖、半乳糖胺或软骨糖胺(Chondrosamine),广泛存在于寡糖、糖蛋白和糖胺聚糖(glycosaminoglycan,GAG)中。20世纪50年代首次发现其有细胞毒作用[1],但对其特异性致肝损伤机制尚不清楚。最早认为氨基半乳糖能竞争性捕捉UTP生成二磷酸尿苷半乳糖(UDP-galactose,UDP-gal),使磷酸尿苷耗竭,影响了肝细胞的能量代谢及阻碍了核酸、糖蛋白、脂糖合成[2]。但随着研究手段和方法的发展,发现它与肝细胞膜的完整性、谷胱甘肽耗竭及肿瘤坏死因子有关[3]。在肝炎药物药效学研究中,用氨基半乳糖制作的肝损伤模型比用四氯化碳、乙醇、扑热息痛等药物制作的模型优越[4]。如何合理地利用新的科学技术手段,研究其肝损伤的靶向性和毒理学机制,作为药物研究或新类似物合成治疗肝脏肿瘤等,是未来氨基半乳糖毒理学研究的方向。然而,D-氨基半乳糖国际市场价格昂贵,限制了国内外肝炎治疗新药筛选用理想动物模型的建立。
目前,D-氨基半乳糖主要是以硫酸软骨素为原料直接用盐酸水解后,经强酸性阳离子交换树脂分离提纯制得的盐酸盐[5]。该法存在原料来源不足、工艺复杂、环境污染严重等问题,限制了氨基半乳糖的规模化生产。化学合成法研究进展缓慢,直到2001年McGeary等[6]采用苯甲酸钠和三甲磺酸与氨基葡萄糖反应,合成D-氨基半乳糖。因其工艺复杂,产物稳定性差、成本高等原因未能实现产业化。原核生物的糖酵解过程中,少量的6-磷酸果糖在6-磷酸果糖转氨酶(GFAT)作用下,由谷氨酰胺提供氨基,生成6-磷酸氨基葡萄糖,在变位酶作用下生成1-磷酸氨基葡萄糖并立即乙酰化生成N-乙酰-氨基葡萄糖。随后生成中间产物UDP-N-乙酰氨基葡萄糖并在UDP-N-乙酰氨基葡萄糖-4-差向异构酶(GNE)的作用下异构化生成UDP-N-乙酰氨基半乳糖(UDP-GalNAc)[7]。在酸性环境下脱掉乙酰基得到氨基半乳糖。利用微生物以糖质为原料转化生成氨基半乳糖在此前未见文献报道。本研究从东营黄河口湿地一处富含鱼蟹腐烂物的淤泥中分离筛选获得一株产氨基半乳糖的细菌,分析其形态特征、生理生化特征及16S rDNA序列,旨在为氨基半乳糖的生物制造提供帮助。
1 材料与方法
1.1 材料
1.1.1 土样 东营黄河口湿地,黄海深海淤泥,青岛沿海某渔场附近地表下2cm土样。
1.1.2 培养基 (1)富集培养基:LB培养基、高氏一号培养基、查氏培养基;(2)筛选培养基(g/L):盐溶液Ⅰ:NH4Cl 10,NaCl 10,Na2HPO415,KH2PO45,蒸馏水980mL;盐溶液Ⅱ:1mol/L的MgSO4溶液;盐溶液Ⅲ:1mol/L的CaCl2溶液;葡萄糖溶液:20%的葡萄糖;配制方法:将盐溶液Ⅰ在1×105Pa灭菌20min,冷却后向盐溶液Ⅰ中添加2mL经滤膜过滤后的盐溶液Ⅱ和0.1mL盐溶液Ⅲ以及20mL葡萄糖溶液。(3)基础发酵培养基:同筛选培养基。
1.2 方法
1.2.1 分离筛选 采集样品经富集后,分别以LB培养基、高氏一号培养基和查氏培养基为细菌、放线菌、霉菌分离培养基,采用梯度稀释法和平板划线法分离并纯化菌种。将滤纸灭菌后放置于2%的水琼脂平板中,用0.5-1.0mL的筛选培养基浸湿滤纸。将纯化的菌株点种到滤纸上,37℃恒温培养1d。将滤纸片取出晾干,喷洒0.2%的茚三酮溶液,95℃显色15min。观察点样点及周围有无紫红色[8]。将显色的菌株接入装有50mL筛选培养基的250mL摇瓶中,摇床培养1d。将发酵液5000r/min离心3min。取上清液10mL,调pH至7.0。分别用薄层层析(TLC)法、比色法和高效液相色谱法检测,将产生氨基半乳糖的菌株进行多次连续传代,保留产氨基半乳糖性能稳定的菌株并做进一步研究。
1.2.2 氨基半乳糖检测 (1)薄层层析(TLC)法[9]:展层剂的组成为吡啶∶乙酸乙酯∶水∶乙酸 =5∶5∶3∶1[10],点样 25μL 后展开,待展层剂挥发后均匀喷洒0.2%的茚三酮溶液,95℃显色15min。(2)比色法[10,11]:按TLC法展开5次,将样点抠出并溶于1.0mL蒸馏水中。取0.4mL样液加入0.3mL乙酰丙酮试液Ⅰ,混匀于100℃水浴30min,放冷,加入对二甲氨基苯甲醛试液1mL,5min后在535nm处测光吸收值Ah。同样取0.4mL样液加入乙酰丙酮试液Ⅱ,混匀于25℃水浴中加热2h,加1mL对二甲氨基苯甲醛试液,混匀后在50℃下保温15min。取出在室温下放置30min后于530nm处测光吸收值Al。以蒸馏水做空白对照。两种光吸收值比值Ah/Al≈1时为氨基半乳糖,Ah/Al≈10时为氨基葡萄糖。(3)高压液相色谱(HPLC)法[12,13]:HPLC分析条件:色谱柱:Inertsil NH2(4.6mm×250mm,0.5μm),检测器为岛津RID-10A,流动相为乙腈∶水=7∶3(V/V),流速为1.0mL/min,进样量10μL。样品处理:0.22μm 微孔滤膜过滤。(4)氨基半乳糖含量的检测:用高效液相色谱法检测,色谱条件同(3)。
1.2.3 菌种鉴定 对菌株进行形态及生理生化试验[14,15],结合伯杰氏细菌鉴定手册和16S rDNA同源序列比对鉴定菌种。16S rRNA相似性分析采用细菌通用引物,正向引物27F:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物1492R:5'-GGTTACCTTGTTACGACTT-3'(由上海生工生物工程技术服务有限公司合成)。PCR 体系:Pfu体系,dNTP 4μL,5×buffer 5μL,引物Ⅰ 0.5μL,引物Ⅱ 0.5μL,模板1μL,Pfu酶1μL,ddH2O 33μL。PCR 程序设定:94℃ 5min;94℃ 40s,54℃ 40s,72℃ 2.5min,35个 循 环;72℃ 10min。琼脂糖凝胶电泳检测扩增产物。
1.2.4 系统发育学分析 PCR产物送上海生工生物工程技术服务有限公司测序,将测序结果用 BLAST软件比对进行序列相似性分析,从GenBank 选取相关菌种的同源序列,利用MEGA5.0软件进行系统发育分析,采用Neighbor-jointing算法构建系统发育树。
1.2.5 发酵培养基成分优化 (1)在培养条件不变的基础上,按4g/L的添加量,分别用半乳糖、蔗糖、可溶性淀粉、果糖、麦芽糖替换培养基中的葡萄糖,以10g/L的添加量,分别用牛肉膏、蛋白胨、酵母粉、尿素、(NH4)2SO4、NaNO3、NH4NO3、氨水替换发酵培养基中的NH4Cl,按1.2.2(4)中的方法检测氨基半乳糖,做3个平行试验,确定最佳碳源和氮源。(2)培养基成分的正交试验优化,选择最佳碳源和氮源以及4种无机盐Na2HPO4、CaCl2、MgSO4、KH2PO4共6个因素,设置5个水平,选用L25(56)正交表(表1),做3个平行试验,按1.2.2(4)中的方法检测氨基半乳糖。

表1 发酵液成分正交试验的因素和水平
1.2.6 培养条件优化 在培养基优化的基础上,将菌株YR06从斜面接入发酵培养基中,在其它培养条件一致的情况下,设定以下4种不同培养条件,200r/min摇床培养后用1.2.2(4)中的方法测定产物氨基半乳糖含量。①起始pH值对氨基半乳糖产量的影响:用酸度计将培养基的pH值分别调节为6.0、6.5、7.0、7.5和8.0。②装液量对氨基半乳糖产量的影响:装液量分别调节为250mL摇瓶装液30、40、50、60和70mL。③培养温度对氨基半乳糖产量的影响:培养温度分别调节为30℃、33℃、35℃、37℃和40℃。④培养时间对氨基半乳糖产量的影响:在上述优化的条件下,培养过程中每隔2h取样一次,测定发酵液OD600并用1.2.2(4)的方法测定氨基半乳糖含量。
2 结果
2.1 氨基半乳糖生产菌株的筛选
经过富集培养,分离纯化出单菌落139株,初筛中得到24株颜色反应成红色及紫红色的菌株,复筛得到1株产氨基半乳糖的菌株YR06,产量为63.5mg/L。将该菌株作为出发菌株进一步研究。薄层层析结果显示与氨基半乳糖标样的比移值相同(图1)。比色法(Ah/Al≈1)和高效液相色谱(图2)检测并确认产物为氨基半乳糖。
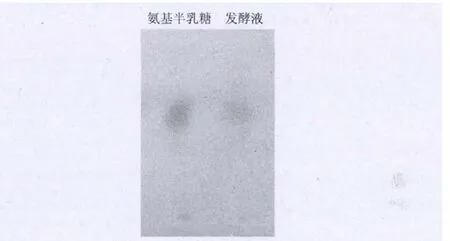
图1 发酵液的薄层层析图

图2 粗提液的液相色谱图
2.2 经典分类学特征
菌株YR06在LB培养基上生长良好,37℃培养12h,形成边缘整齐、表面湿润、中央隆起、光滑、半透明、淡黄色的圆形菌落(图3-A)。发酵液有芳香气味。 两端钝圆,直形短杆菌,革兰氏染色为阴性,单个或成对排列,无芽孢(图3-B)。生理生化试验特征见表2。
2.3 16S rDNA序列系统发育树
经16S rDNA测序,其碱基数为1 451bp,将测序结果提交到GenBank数据库,用BLAST程序进行比对,多序列连配分析后构建系统发育树(图4),结果发现YR06与气单胞菌的多个种16S rDNA序列相似性达到99%,与嗜水气单胞菌位于同一分支。

图3 菌株YR06菌落形态(24h)(A)及革兰氏染色(24h,1 600×)(B)

表2 菌株YR06的生理生化特征

图4 菌株YR06的16S rDNA 基因系统发育树图
综合考虑YR06的形态特征、生理生化特征及16S rDNA序列分析,初步鉴定菌株YR06属于嗜水气单胞菌(Aeromonashydrophila),将其命名为A.hydrophila YR06。
2.4 菌株YR06培养条件的优化
2.4.1 不同碳、氮源对A.hydrophila YR06产氨基半乳糖的影响 以葡萄糖等6种碳源的培养基培养菌株A.hydrophila YR06,均有氨基半乳糖产生,其中以果糖为碳源时产量最大。其次是葡萄糖,而半乳糖、蔗糖、淀粉、麦芽糖果较差(图5)。因此,以果糖为碳源。以牛肉膏等8种氮源的培养基培养YR06,以尿素为氮源时产量最大,以NaNO3、NH4NO3为氮源时产量最小(图6),因此以尿素为氮源。
2.4.2 培养基成分的正交试验 以果糖、尿素、CaCl2、Na2HPO4、KH2PO4、MgSO4为因素,按 L25(56)正交表设计6因素5水平正交试验,优化菌株YR06产氨基半乳糖的发酵液成分(表3)。正交试验极差分析表明,6个因素对氨基半乳糖产量的影响为A>D>B>F>E>C,方差分析表明,果糖添加量对菌株YR06发酵产氨基半乳糖产量影响最大。最优组合为A4B3C3D4E2F3;因此确立培养基配方为:果糖(10g/L)、 尿 素(15g/L)、Na2HPO4(15g/L)、Ca-Cl2(22.2g/L)、MgSO4(0.18g/L)、KH2PO4(5g/L)。
2.4.3 菌株YR06产氨基半乳糖培养条件的优化在确定发酵培养基配方的基础上对发酵条件进行了优化。研究结果表明,将培养基的初始pH调节为6.5,250mL三角瓶装60mL发酵液,33℃,200r/min恒温振荡培养14h,氨基半乳糖产量最高,达到128mg/L。因此选择此培养条件为发酵培养条件。

图5 不同碳源对氨基半乳糖产量的影响

图6 不同氮源对氨基半乳糖产量的影响
3 讨论
传统生产氨基半乳糖的方法不仅原料少,而且生产过程中产生大量的废水,污染环境,产物提纯也较复杂,因此,利用微生物直接发酵法生产氨基半乳糖必将会成为未来最具竞争力的生产方法,实现这一生产方法的核心是能够高效积累氨基半乳糖的菌种。龚霞等[16]采用抑制差减法从嗜水气单胞菌中杂交得到gneJ片段,扩增后并在大肠杆菌中进行异源表达,重组表达蛋白可将UDP-乙酰氨基葡萄糖转化为UDP-乙酰氨基半乳糖,证实gneJ基因编码蛋白为UDP-乙酰氨基葡萄糖-4-差向异构酶。本研究筛选得到的高产氨基半乳糖菌株经鉴定为嗜水气单孢菌(A.hydrophila YR06),而目前对嗜水气单胞菌的研究主要集中在致病性、耐药性以及疫苗等方面,尤其是对水产养殖业的危害及防治方面。未见有这类菌株积累氨基半乳糖方面的报道。从液相图谱可以看出,该菌株的发酵产物相对单一,易于分离,具有较好的工业化开发价值。

表3 菌株YR06产氨基半乳糖培养条件正交试验结果
培养基优化过程中,果糖作为最适碳源出现,其原因可能是果糖和葡萄糖的代谢途径具有高度的相似性,嗜水气单胞菌的糖代谢途径中存在着果糖激酶,该酶受葡萄糖介导的抑制并受果糖诱导,将果糖变为 6-磷酸果糖[17]。同时,UDP-N-乙酰氨基葡萄糖在GNE作用下异构化为UDP-N-乙酰氨基半乳糖并最终导致细胞质中的6-磷酸氨基葡萄糖无法大量积累而减弱了6-磷酸果糖转氨酶的限速作用,该途径得以持续进行。Mg2+是许多酶活性中心必不可少的一部分,能够保证菌体的良好生长。同时,添加Mg2+能有效的激活谷氨酰胺合成酶的活性,提高谷氨酰胺的生成量[18]。Ca2+对产物产量的影响可能是影响了细胞膜的透性,使得产物可透过细胞膜分泌到细胞外部,减弱了对关键酶的反馈抑制作用。
氨基半乳糖转化菌株的筛选和分类鉴定工作对于氨基半乳糖生物转化法生产工艺的建立有重要意义。通过基因工程等手段将编码氨基半乳糖转化的基因导入其他菌株,同时切断菌株将氨基半乳糖转运至细胞内的途径,使之不能再降解氨基半乳糖,有利于持续生物转化生产中产物的累积,实现其高效安全生产。因此,有必要对菌株YR06进行进一步育种及驯化培养等研究。
4 结论
从黄河口湿地一处富含鱼蟹腐烂物的淤泥中筛选到一株具有氨基半乳糖转化能力的菌株,菌株YR-06鉴定为嗜水气单胞菌。优化该菌株的培养基成分及培养条件:果糖10g/L,尿素15g/L,Na2HPO415g/L,CaCl222.2g/L,MgSO40.18g/L,KH2PO45g/L;发酵液初始pH6.5,装液量为60mL/250mL,温度为33℃,培养时间14h。氨基半乳糖的产量达到128mg/L。
[1] 李宏涛, 陈国民.D-氨基半乳糖研究的回顾和展望[J].肝脏,2004, 9(3):209-210.
[2] Mcmillan JM, Jollow DJ.Galactosamine:Hepatotoxicity effect of galactosamine on glutathione resynthesis in rat primaryhepatocyte cultures [J].Toxicol Appl Pharmacol, 1992, 115(2):234-240.
[3] Stachlewitz RF, Seabra V, Bradford B, et al.Glycine and uridine prevent D-galactosaminehepatotoxicity in the rat:role of Kupffer cells [J].Hepatology, 1999, 29:737-745.
[4] 茹仁萍, 吴锡铭, 朱幸芳.小鼠慢性免疫性肝损伤模型建立与筛选[J].医学研究通讯, 2005(12):31-33.
[5] 徐昌喜, 汤先觉.简便法制备D-氨基半乳糖盐酸盐[J].重庆医学院学报, 1979(s):1-4.
[6] McGeary RP, Wright K, Toth I.Conversion of glucosamine to galactosamine and allosamine derivatives:control of Inversions of stereochemistry at C-3 and C-4[J].J Org Chem, 2001, 66:5102-5105.
[7] Piller F, Eckhardt AE, Hill RL.The preparation of UDP-N-acetylgalactosamine from UDP-N-acetylglucosamine employing UDP-N-acetylglucosamine-4-epimerase[J].Analytical Biochemistry, 1982, 127(1):171-177.
[8] 杨敬芳, 时东彦, 李继红, 王鑫.临床分离肠球菌的耐药性监测与分析[J].中华医院感染学杂, 2004, 14(9):1063-1064.
[9] 陈小娥, 方旭波, 余辉.壳寡糖的薄层层析分析[J].浙江海洋学院学报:自然科学版, 2008, 12(4):361-365.
[10] 张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999.
[11] Wagner WD.Amore sensitive assay discriminating galactosamine and glucosamine inmixture [J].Anal Biochen, 1979, 94(2):394-396.
[12] Jamialahmadi K, Behravan J, Fathi M, et al.Enzymatic production of N-Acetyl-D-Glucosamine from chitin using crude enzyme Preparation of Aeromonas sp.PTCC1691[J].Biotechnology, 10(3):292-297, 2011.
[13] 李俊.HPLC-RID法测定氨基葡萄糖盐酸盐的含量[J].海峡药学 , 2011, 23(2):42-44.
[14] 李圆圆, 曹海鹏, 何珊.鳃源致病性嗜水气单胞菌Xl的分离鉴定与药敏特性研究[J].微生物学通报, 2008, 35(8):1186-1191.
[15] 东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
[16] 龚霞, 陆承平, 姚火春.嗜水气单胞菌UDP-乙酰葡萄糖胺-4-差向异构酶基因的克隆表达及酶的性质[J].中国水产科学,2008, 15(1):106-112.
[17] 孙忠科.长双歧杆菌NCC2705果糖代谢途径研究[D].杨凌:西北农林科技大学, 2008.
[18] 汪世华, 白文钊, 吴思方, 等.L-谷氨酰胺高产菌株的定向选育及产胺条件的研究[J].微生物学报, 2002, 42(6):751-754.
