五条蚋(Simulium quinquestriatum)不同地理种群遗传多样性的ISSR标记研究
2013-09-13修江帆张春林陈汉彬
修江帆 张春林 陈汉彬
五条蚋 Simulium(Simulium)quinquestriatum Shiraki,1935,隶属于蚋科(Simuliidae)蚋属(Simulium)蚋亚属(Simulium)盾纹组(stiatum-group),广泛分布于东洋界,现已报道的国家有中国、韩国、日本、泰国和越南等[1]。在我国几乎全境皆有分布,已见记录的省区有台湾、辽宁、福建、江西、陕西、广东、广西、湖南、贵州、四川、云南、西藏等[2]。目前,五条蚋除吸血、骚扰人畜外,其流行病学尚不清楚,在此方面研究报道非常少见,仅见Fukudam于2008年报道五条蚋幼虫能够试验感染微丝蚴(microfilariae)[3]。据观察,五条蚋一般分布于人畜活动频繁的地区,对生境的适应范围广,偏好滋生于有机质含量丰富的水体,往往是该地区的优势蚋种。因此认为五条蚋的分布范围广,适应性强,易于采集,是研究蚋类种群演化及遗传多样性的良好材料。
简单重复序列间区(Inter-Simple Sequence Repeat,ISSR)标记技术是由加拿大蒙特利尔大学Zietkiewicz等[4]于1994年在微卫星标记的基础上发展起来的一种分子标记技术。该标记技术综合了其它标记技术的多种优点,具有操作简单、引物开发费用低、稳定性好、检测多态性能力强、所需DNA模板量少、无需知道基因组序列等特点,已被成功地运用于亲缘关系、遗传多样性、种质鉴定和构建遗传图谱等研究领域[5-9]。关于蚋类的ISSR相关研究仅见于捷克斯洛伐克Dusinsky[10]关于蚋种内和种间的鉴定,及本课题组廉国盛[11]关于中国8亚属23蚋种ISSR分子进化研究;而蚋类种群ISSR研究在国内外均未见相关报道。本研究采用ISSR分子标记技术对中国8个五条蚋种地理群种的遗传多样性及遗传分化进行研究分析,旨在从分子水平对五条蚋种群遗传结构及演化的研究提供基础资料。
1 材料与方法
1.1 材料
试验用五条蚋采自贵州贵阳三江(GZSJ)、贵州青岩(GZQY)、贵州息烽(GZXF)、福建长乐(FJCL)、福建宁德(FJND)、四川夹江(SCJJ)、广西兴安(GXXA)、云南勐腊(YNML)5省8个地理种群(表1),每个种群分别取20条个体进行基因组DNA提取,-20℃冻存备用。
试验主要药品:引物由上海生工生物工程有限公司合成;dNTP,Mg2+,Taq DNA聚合酶,Marker DL2000 DNA Ladder 购置于TaKaRa公司;BSA(牛血清白蛋白)购置于Sigma公司。

表1 用于ISSR分析的五条蚋种群
1.2 方法
1.2.1 基因组DNA的提取及定量保存 参照酚-氯仿抽提法[12],每个种群选取20条五条蚋提取基因组DNA,8个种群共计160个DNA样本,经电泳检测后,用紫外分光光度计将其浓度定量为50ng/μL,-20℃保存。
1.2.2 ISSR分析
1.2.2.1 引物的筛选 经前期试验优化设计的五条蚋ISSR-PCR最佳反应体系中筛选出多态性高、稳定性好、条带清晰的8条引物用于PCR扩增反应(表 2)。
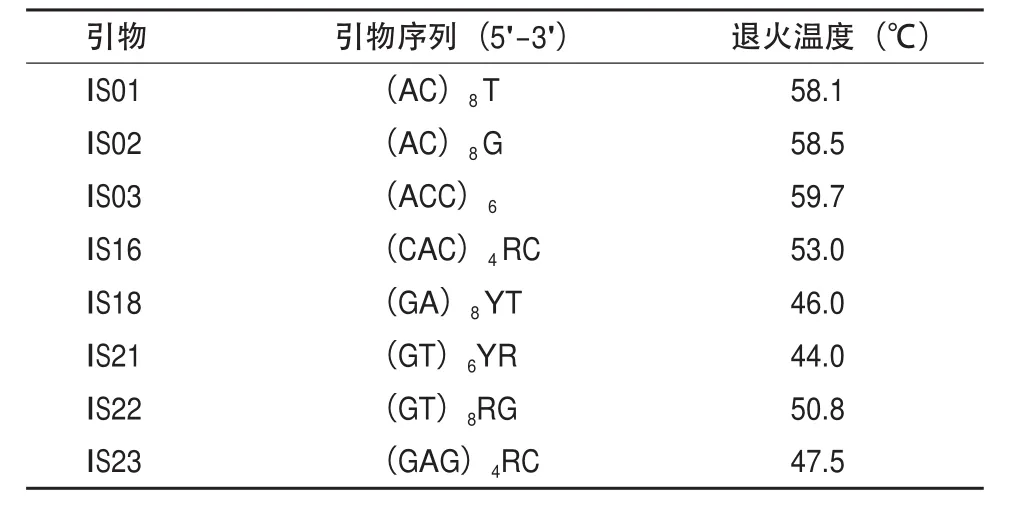
表2 ISSR-PCR 扩增所用引物
1.2.2.2 PCR 扩增 20μL 反应体系中引物1.0μmol/L、模板 50.0ng/μL、dNTP0.15mmol/L、Mg2+1.50mmol/L、BSA 2.00mg/mL、Taq DNA 聚合酶 0.15 5U/μL,ddH2O补齐。PCR反应在5331(德国Eppendorf)基因扩增仪中进行,PCR反应程序为:94℃预变性5min;94℃变性 50s,51℃退火 60s,72℃延伸 90s,35个循环;72℃延长10min,10℃保存[11]。PCR产物与1μL 6×loading buffer混匀后取 6μL,以 TaKaRa公司的DL2000 Marker为对照,用1.0%琼脂糖凝胶(含EB0.05μg/mL),电泳缓冲液为0.5×TBE,电压200 V恒定电泳40min,凝胶成像系统拍照记录。
1.2.3 数据统计与分析 运用Quantity One 4.2.1软件分析ISSR扩增的谱带,在相同迁移位置上,有谱带存在赋值为“1”,无谱带赋值为“0”,建立五条蚋8个种群的二元数据矩阵。将数据导入POPGEN1.32软件[13],计算五条蚋不同种群的遗传距离,Nei氏基因多样性指数H(gene diverdity),Shannon 氏信息指数 I(shannon’s information index),多态性位点比例P(percentage of polymorphic loci),同位点等位基因数A(Observedmean number of alleles per locus),同位点有效等位基因数AE(Effectivemean number of alleles per locus),遗传分化系数(Coefficient of gene differentiation,Gst)[14]。 运 用 软 件MEGA version 4.0[15]选择非加权组平均法UPGMA(unweighted pair-groupmethod for arithmetic averages analysis)和邻位聚类法NJ(Neighbor-Joining)对五条蚋8个种群进行种群聚类分析。Google earth 6.0.1软件计算8个种群的地理距离。GenAlEx 6.41软件对种群间和种群内的遗传变异进行分子方差分析AMOVA[16](Analysis of Molecular Variance),ISSR 表型特征的主成分分析(PCA主成分分析)[17]并检测种群间地理距离与遗传距离的相关性。
2 结果
2.1 五条蚋种群DNA的ISSR扩增结果
筛选的8条引物对8个种群共160条五条蚋DNA进行ISSR-PCR扩增,共获得111条有效条带,这些条带的大小介于200-2000bp之间(图1),其中引物IS18扩增条带数最多,为20条;引物IS22扩增条带数最少,为9条,平均每条引物扩增13.88条条带;不同引物扩增出的多态性条带数和多态性条带比例有一定差异,引物IS01多态性比例最大,为93.33%;引物IS03最小,为76.47%(表3)。不同种群的每一个个体均呈现出为宜的ISSR基因型,这也证明ISSR标记对五条蚋具有很高的鉴别能力,同时也说明五条蚋个体之间存在较大的遗传变异。这些位点在种群中分布不均匀。从五条蚋8个种群的多态性位点比例可看出五条蚋的遗传多样性较为丰富。

图1 引物IS01对五条蚋群体的ISSR扩增电泳图

表3 五条蚋种群ISSR扩增引物产生的多态性条带
2.2 五条蚋种群的遗传多样性
从表4中可看出,五条蚋在物种水平上多态性位点比例为86.47%,单个种群多态性条带比例的变化范围从最低的种群GZQY(P=66.25%)到最高的种群GXXA(P=86.57%)。在物种水平上同位点有效等位基因AE平均数为1.553 2±0.334 5,范围从最低的种群YNML(1.2090±0.2090)到最高的种群GZSJ(1.3811±0.398 6)。Shannon氏多样性指数(I)物种水平为0.484 7±0.203 7变化范围从最低的种群YNML(0.194 3±0.2591)到最高的种群GZSJ(0.314 4±0.305 5)。Nei氏遗传距离(H)物种水平为0.3231±0.157 9,变化范围从最低的种群YNML(0.126 4±0.178 4)到最高的种群 GZSJ(0.215 3±0.2141)。总体结果分析五条蚋物种水平的遗传多样性水平比单个种群的高;种群间相比较同位点有效等位基因AE数、Shannon氏多样性指数(I)、Nei氏遗传距离(H)所反映的变化趋势一致(YNML<FJCL<GXXA<GZQY<GZXF<FJND<SCJJ<GZSJ),但在多态性位点比例上却有所不同(GZQY<FJCL<GZXF<SCJJ<GZSJ<FJND<YNML<GXXA)。

表4 五条蚋种群间的遗传多样性指数
2.3 五条蚋种群的遗传分化
用POPGENE 1.32计算出的遗传变异分析结果(表5)表明,五条蚋种群间存在着一定的遗传分化。8个种群总的遗传多样性Ht=0.3231,其中种群内部的遗传多样性Hs=0.1801,种群间的基因多样度(Dst=Ht-Hs)为0.1430,Nei的遗传分化系数Gst=0.5900,提示有59%的遗传分化存在于种群间,41%的遗传分化存在于种群内部,种群间的遗传分化大于种群内部的分化,种群内部遗传分化水平相对较低。种群间基因流[(Nm=0.5(1-Gst)/Gst)]为0.347 5,基因流较小。用AMOVA进行的基于Nei氏距离平方的遗传变异方差分析结果也显示五条蚋的遗传分化主要存在于种群间,占总分化的59%,种群间的遗传分化占41%(P<0.001)(表6)。

表5 五条蚋种群遗传多样性Nei氏分析

表6 五条蚋种群遗传分化分子方差分析(AMOVA)
2.4 遗传距离、地理距离及聚类分析
遗传距离可以较为直观地反映每个种群间彼此亲缘关系的远近,为确定五条蚋8个地理种群之间的遗传关系,对Nei氏遗传距离进行了计算(表7);根据采集点的地理坐标计算种群间的地理距离(表7)。五条蚋8个种群中种群GZSJ与种群GZQY之间遗传距离最近为0.067 6,种群SCJJ和种群YNML之间遗传距离最远为0.3410;种群GZSJ与种群GZQY之间地理距离最近为42.31 km,种群FJND和种群YNML之间遗传距离最远为908.21 km。
基于种群间Nei氏遗传距离,运用NJ法和UPGMA法对五条蚋8个种群进行聚类分析。结果(图2,图3)显示,五条蚋8个种群分化成为2个大组4个亚组,其中种群GZSJ、GZQY、GZXF、SCJJ组成了第1大组,种群FJCL、FJND、GXXA、YNML组成了第2大组。在第1组中,种群GZSJ、GZQY首先聚集形成1支,后又与种群GZXF聚集形成第1亚组,种群SCJJ单独形成第2亚组;在第2大组中,种群FJCL、FJND汇聚组成第3亚组,种群GXXA、YNML聚集行成第4亚组。NJ法和UPGMA法聚类分析结果基本一致。PCA主成分分析结果显示(图4),PCA轴1将第一组的4个种群(种群GZSJ、GZQY、GZXF、SCJJ)与第二组的4个种群(种群FJCL、FJND、GXXA、YNML)进行分隔,PCA轴2将第一组中种群GZSJ和种群GZQY聚成一分支,将第二组中的种群FJCL和种群FJND聚成另一分支,种群GZXF单独聚为一支;PCA的轴3将第一组中种群SCJJ单独分隔出来成为一亚组,同时将第二组中种群GXXA与种群YNML进行分隔。PCA分析结果支持NJ法及UPGMA法聚类结果。

图2 基于Nei氏遗传距离做出的五条蚋种群的NJ聚类分析图

图3 基于Nei氏遗传距离做出的五条蚋种群的UPGMA聚类分析图

图4 基于ISSR表型特征的主成分分析(PCA)

图5 五条蚋种群遗传距离与地理距离的回归分析
将五条蚋8个种群间的遗传距离以及地理距离进行相关性的检验(mantel test)(图5),建立回归方程为y = 7E-05x +0.164 2,相关性系数| r | =0.510 7(P=0.01<0.05)。结果说明五条蚋各种群间的遗传距离与地理距离间呈现正相关,种群间的基因交流可能被它们之间的地理距离所限制。
3 讨论
3.1 五条蚋的遗传多样性
多态位点比例(P),Shannon氏多样性指数(I),Nei氏基因多样性指数(H),同位点上等位基因数(A)及同位点上有效等位基因数(AE)是衡量种群多样性的常用指标[18]。遗传多样性是物种或居群长期进化的产物,也是其生存发展和进化的基础[19]。一个物种或种群遗传多样性水平越高则说明其对环境变化的适应能力越强。研究对五条蚋8个种群的结果显示,五条蚋物种遗传多样性水平(AE=1.553 2±0.334 5,H=0.3231±0.157 9,I=0.484 7±0.203 7)较其它昆虫高,如角倍蚜(AE=1.403±0.338,H=0.247±0.169,I=0.387±0.221)[20];桃蛀螟(AE=1.249 7±0.238 4,H=0.1750±0.1331,I=0.296 6±0.185 5)[21],可说明五条蚋丰富的遗传多样性证实其对环境变化具有较强适应抵抗力的遗传基础,这也解释了五条蚋广泛分布于东洋界,在我国几乎全境皆有分布的原因;同时研究发现五条蚋物种遗传多样性水平比单个种群的高,是因其分布广泛,滋生生境复杂,决定其丰富的遗传多样性。
3.2 五条蚋的遗传分化
生物种群遗传分化主要决定于种群内遗传漂变与种群间基因流两者的动态平衡。Wright 等[22]提出的遗传分化理论认为:当遗传分化系数(Gst)的值介于0-0.05之间表示种群间遗传分化程度低;0.05-0.15为分化程度中等;0.15-0.25为分化程度高;大于0.25表明种群遗传分化程度极大。本研究结果显示,五条蚋8个种群间的Gst=0.5900,种群分化程度极大;依据分子方差(AMOVA)分析结果,五条蚋种群间分化占遗传分化59%,种群内部分化占遗传分化41%,说明五条蚋的遗传分化发生在种群之间,而种群内部遗传分化相对较低,处于次要地位。究其原因:(1)由于地理隔离,导致种群中的遗传漂变,增加了种群的遗传多样性。本研究的五条蚋种群分别采自贵州、云南、四川、广西、福建5省的8个不同采集点,采集点之间最近相距42.31 km,最远相距1 908.21 km。地理位置经度跨越约18(E:101 34'- E:119 31');纬度跨越约8(N:2128'-N:29 44');海拔 高度差距约1100m(19-1120m);地形有平原、丘陵、盆地和高原。由于采集点之间的地理距离跨度大、地形地貌多样,可能由于天然地理屏障存在,导致五条蚋的种群间的遗传分化水平较高。(2)基因流的影响。通常物种基因流的水平高,物种遗传分化小;基因流的水平低,则物种遗传分化大。依据群体遗传学理论[23],当基因流Nm<1时,就不足以抵制居群内因遗传漂变而引起的居群间遗传分化;当基因流Nm>4时,表明种群间的基因交流比较充分,足以抵制遗传漂变的作用,消弱了种群间遗传分化的产生。五条蚋的Nm=0.347 5<1,说明种群间的基因交流不充分,遗传漂变的作用较强,可能导致种群间遗传分化的产生。同时,本研究对种群间的遗传距离与地理距离的相关性分析,表明8个种群间的遗传距离在0.126 4-0.215 3之间,距离较大,且种群间的遗传距离与地理距离呈正相关,地理距离间隔越远,遗传距离差距越大。也进一步说明五条蚋种群由于受到地理屏障的制约,不能进行充分的基因交流,种群间基因流水平不高。
3.3 五条蚋种群的聚类分析
本研究基于Nei氏遗传距离,分别运用NJ法、UPGMA法和PCA主成分分析法对五条蚋8个种群进行聚类分析。3种聚类分析法显示的结果均保持一致,表明了聚类分析的结果可靠性较高。聚类分析的结果表明,五条蚋8个种群的遗传距离与它们的地理间隔距离具有一致性。贵州与四川的种群聚成一支,而福建、广西、云南的种群聚成一支,分别表明贵州与四川的种群之间遗传距离较近;福建、广西、云南的种群之间的遗传距离较近,基因流水平较高,可能代表五条蚋在这些地区的扩散模式。目前认为蚋类的扩散主要有两种方式:成虫的迁飞和幼虫随流迁移。据相关研究报道[24],蚋成虫的迁飞距离变化较大,如Simulium neavei最大迁飞距离<4 km,而Simulium damnosum及Simulium sirbanum最大迁飞距离可达到400 km。成虫的迁飞可能是蚋类扩散主要方式,与风向、风力有关,而幼虫随流迁移则与水系分布,流速等有关。
4 结论
构建了中国五条蚋8个种群160个体的ISSR指纹图谱,每个种群均显示出独特的图谱特征。
五条蚋在物种水平遗传多样性较高;在种群水平遗传多样性较低,五条蚋丰富的遗传多样性证实其对环境变化具有较强适应能力。
五条蚋遗传分化主要发生在种群之间,地理屏障(高山和平原等)以及栖息地片段化是导致其遗传分化形成的主要因素。
[1] Adler PH, Crosskey RW.World Blackflies(Diptera:Simuliidae):A Comprehensive Revision of the Taxonomic and Geographical Inventory [2010].http://entweb.clemson.edu/biomia/pdfs/blackflyinventory.pdf
[2] 陈汉彬, 安继尧.中国黑蝇(双翅目:蚋科)[M].北京:科学出版社, 2003:258-259.
[3] Fukuda M, Takaoka H, Uni S, et al.Infective Larve of five Onchocerca species from experimentally infected Simulium species in an area of Zoontic Onchocerciasis in Janpan [J].Parasite, 2008, 15(2):111-119.
[4] Zietkiewicz E, Rafslski A, Labuda D.Genome fingerprinting by simple sequence repeat(SSR)anchored polymerasechain re-action amplification [J].Genomics, 1994, 20:176-183.
[5] 周延清.DNA分子标记技术在植物研究中的应用[M].北京:化工工业出版社, 2005:68-70.
[6] Agostini G, Echeverrigaray S, Souza-Chies TT.Geneticrela-tionships among South American species of Cunila D.Royen ex L.based on ISSR [J].Plant Syst Evol, 2008, 274:135-141.
[7] Dje Y, Tahi CG, Bi AI, et al.Use of ISSRmarkers to assess genetic diversityof African edibleseeded Citrullus lanatus landraces [J].Scientia Horticulturae, 2010, 124(2):159-164.
[8] Du XY, Zhang QL, Luo ZR.Development of retrotransposon primers and their utilization for germplasm identification in Diospyros spp.(Ebenaceae)[J].Tree Genetics & Genomes, 2009, 5:235-245.
[9] Gupta S, Pandey-Rai S, Srivastava S, et al.Construction of genetic linkagemap of themedicinal and ornamental plant Catharanthus roseus [J].Journal of Genetics, 2007, 86(3):259-268.
[10] Dusinsky R, Kudela M, Stloukalova V, et al.Use of inter-simple sequence respeat(ISSR)markers for discrimination between and within species of blackflies(Diptera:Simuliidae)[J].Section Cellular and Molecular Biology Biologia, 2006, 61(3):299-304.
[11] 廉国盛.山西蚋类区系研究和中国8亚属23蚋种ISSR分子进化研究[D].贵阳:贵阳医学院,2009.
[12] 范海荣, 夏永静.四种全血基因组DNA提取方法的比较[J].中国动脉硬化杂志, 2002, 10(6):535-536.
[13] Yeh FC, Yang RC, Boyle T, et al.POPGENE, the user friendly shareware for population genetic analysis [M].Edmonton:University of Alberta, 1997.
[14] Nei M, Li WH.Mathematicalmodel for studying genetic variation in terms of restriction endonucleases [J].Proc Natl Acad Sci USA,1979, 76(10):5269-5273.
[15] Kumar S, Tamura K, Jakobsen IB, et al.MEGA2:Molecular evoutionary genetics analysis software [J].Bioinformatics, 2001,17(12):1244-1245.
[16] 陈俊秋, 慈秀芹.樟科濒危植物思茅木姜子遗传多样性的ISSR分析[J].生物多样性, 2006, 14(5):410-420.
[17] 王晓明, 赖燕玲.深圳梅林仙湖苏铁野生种群遗传多样性ISSR分析[J].中山大学学报:自然科学版, 2006, 45(3):82-85.
[18] 朱勋, 杨家强.小菜蛾不同地理种群遗传多样性的ISSR标记研究[J].昆虫学报, 2012, 55(8):981-987.
[19] 陈灵芝.中国的生物多样性—现状及其保护对策[M].北京:科学出版社, 1993:11-15.
[20] 王定江, 杨汉远, 钟扬, 任竹梅.贵州省八个种群角倍蚜ISSR遗传多样性[J].生态学杂志, 2008, 27(10):1729-1733.
[21] 张颖, 李菁, 王振营.中国桃蛀螟不同地理种群的遗传多样性,昆虫学报, 2010, 53(9):1022-1029.
[22] Wright S.Evolution and the genetics of populations.//Variability within and among natural populations [M].Chicago:University of Chicago Press, 1978.
[23] Slatkin M.Gene flow in natural populations [J].Annual Review of Ecology & Systematics, 1985(16):393-430.
[24] Peter H, Adler A.Evolution, epidemiology, and population genetics of black flies(Diptera:Simuliidae)[J].Genetics and Evolution, 2010(10):846-865.
