猫锡兰钩虫rDNA ITS1的扩增及分子鉴定
2013-09-11刘远佳郑国超任邵娜李雅文孟祥龙Loutou李国清
刘远佳,郑国超,刘 田,任邵娜,李雅文,孟祥龙,Loutou H M,李国清
(华南农业大学兽医学院,广东广州510642)
锡兰钩虫(Ancylostoma ceylanicum)属于线虫纲、圆线目、钩口科、钩口属,成虫常寄生于犬、猫等多种哺乳动物消化道,通过吸食宿主血液而引起宿主贫血,严重的可以导致死亡[1]。Wijers等和Carroll等分别于1966年和1986年以实验感染的方式证明了人体能够感染锡兰钩虫[2-3]。而人体自然感染锡兰钩虫的病例在世界各地均有报道,如澳大利亚、荷兰、印度、菲律宾、老挝等[1,4-7]。这表明锡兰钩虫是一种重要的人畜共患寄生虫。研究显示,犬猫锡兰钩虫感染呈现地方性流行,主要分布在东南亚及澳洲一些国家,我国正位于犬猫锡兰钩虫的流行区,然而我国关于猫锡兰钩虫的报道却很少,自金大雄1965年首次在贵州家猫体内发现锡兰钩虫,Yoshida等1968年首次报道了我国台湾省猫锡兰钩虫感染至今,已有近半个世纪未见猫锡兰钩虫感染的报道[8-9]。本研究从广州市流浪猫粪便样品中分离到钩虫虫卵,通过直接提取虫卵基因组DNA,并以钩虫ITS1rDNA作为分子标记,采用PCR方法快速准确地将其鉴定为锡兰钩虫,为锡兰钩虫的分子生物学和分子流行病学研究奠定了基础。
1 材料和方法
1.1 样 品 猫新鲜血便样品来源于一只10月龄雌性波斯猫,经60目过滤筛过滤两次,4500r/m in离心10min,弃上清液,沉淀中加入2倍体积2.5%重铬酸钾溶液,4℃保存待检;对照样品为华南农业大学寄生虫教研室保存的犬钩虫虫卵。
1.2 主要试剂 Ex Taq DNA聚合酶、DL2000DNA Marker、pMD18-T载体、JM 109感受态细胞购自TaKaRa公司;蛋白酶K、DNA提取试剂盒、DNA胶回收试剂盒购自OMEGA公司。
1.3 显微镜检测 取血便样品的重铬酸钾混合液1m L~2m L,加入2倍体积蒸馏水,4000r/min离心5min,弃上层液,加入适量饱和氯化钠溶液混匀,1500r/m in离心3m in,加入饱和氯化钠溶液至满管,在其上放置一盖玻片,静置5m in,将盖玻片置于载玻片上,卢戈氏碘液染色,在400×显微镜下观察。
1.4 虫卵的纯化 将粪样重铬酸钾混合液加入2倍体积蒸馏水,4000r/m in离心10m in,沉淀中加入4倍体积饱和蔗糖溶液悬浮,1500r/m in离心5min,取上清液,加入5倍体积蒸馏水,6000r/min离心10m in,洗涤直至沉淀纯净。
1.5 基因组DNA的提取 将纯化虫卵4000r/m in离心5m in,弃大部分上清液,加入适量玻璃珠,100℃水浴加热5min,立即置于-80℃冷凝5min,反复5次,4000r/min离心5m in,弃上清液,加入适量缓冲液和蛋白酶K,漩涡振荡30m in,55℃水浴消化16h。按粪便DNA提取试剂盒说明书提取基因组DNA。
1.6 ITS1-5.8SrDNA部分序列的扩增、克隆和测序 以锡兰钩虫(DQ381541、DQ780009)、管型钩虫(JQ812691)、 犬 钩 虫 (AM 85010、AM 850105)、 巴 西钩虫(DQ359149、DQ438056)、狭头钩虫(HQ262053、AF194145)ITS rDNA序列作为参考,设计钩口属保守引物AF:5'-CTTTGTCGGGAAGGTTGG-3'和AR:5'-TTCACCACTCTAAGCGTCT-3',对猫源钩虫ITS1+rDNA片段进行PCR扩增,反应体系25μL:10×Buffer 2.5μL,2.5mmol/L dNTP 2μL,上下游引物(50pmol/μL)各 0.5μL,ddH2O 17.3μL,模板DNA 2μL,Ex Taq DNA 聚合酶(1U/μL)0.2μL;反应条件为:94℃5min;94℃30s、60℃30s、72℃50s,35个循环;72℃7min。PCR产物经2%琼脂糖凝胶电泳检测。将PCR产物纯化回收,克隆至pMD18-T载体中,由北京华大生物技术有限公司进行测序。
1.7 序列分析及分子进化树绘制 将测序结果录入GenBank,采用Blast进行比对,初步鉴定其种类。参照GenBank中6种钩虫ITS1相关的基因序列(DQ381541、 DQ780009、 AM 85010、 AM 850105、DQ359149、 DQ438056、 HQ262053、 AF194145、EU344797、 GQ859497、 JQ812691、 JQ812692), 采用Clustal X和MEGA5.1软件计算出各序列间的遗传距离并绘制系统发育进化树。
2 结 果
2.1 虫卵形态 猫粪便样品中检测到虫卵呈椭圆形,两端钝圆,大小约35μm×60μm,卵壳与卵细胞间隙明显,含有两个或4个卵细胞,久置后,可以观察到卵细胞呈桑葚状,未染色无色透明,卢戈氏碘液染色后呈棕黄色(图1)。

图1 锡兰钩虫虫卵(400×)Fig.1Eggs of A.ceylanicum(400×)
2.2 目的基因PCR扩增结果 采用钩虫属保守引物AF和AR对虫卵基因组DNA进行扩增,产物经琼脂糖凝胶电泳,获得约400bp的特异性片段,与预期相符(404bp)(图2)。
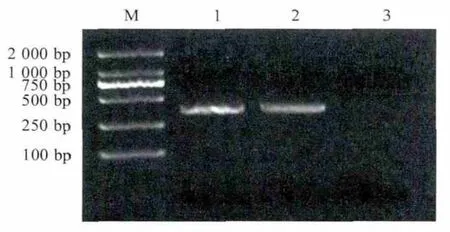
图2 猫源钩虫ITS1+rDNA的PCR扩增Fig.2PCR amplification of ITS1and partial 5.8S rDNA from the cat-derived Ancylostoma sp.
2.3 PCR扩增产物测序结果 将PCR扩增产物克隆至pMD18-T中并进行测序,结果显示,该序列长度为404bp,包括309bp ITS1(1bp~309bp)和95bp 5.8S rDNA(310bp~404bp),其核苷酸序列为:

2.4 测序分析 将测得的ITS1序列与GenBank中登录的序列进行Blast比对,结果显示该序列与DQ780009.1、DQ381541.2的同源性最高,为100%,初步确定该株钩虫为锡兰钩虫。而且采用DNAStar软件中SepEd、MegA lign程序将其与犬钩虫、锡兰钩虫、巴西钩虫、十二指肠钩虫、狭头钩虫、管型钩虫ITS1rDNA相关序列比对显示,该钩虫的ITS1序列与印度犬源锡兰钩虫的相似度为100%,与澳大利亚犬源锡兰钩虫的相似度为99.7%,而与其他钩虫相似度均不高于97.5%,进一步确定该钩虫为锡兰钩虫。
2.5 系统发育进化树 采用Clustal X和MEGA5.1软件,以ITS1序列作为分子标记建立系统发育进化树,从遗传进化的角度确定该株钩虫为锡兰钩虫(图3)。
3 讨 论

图3 猫源钩虫ITS1以邻接法建立的系统进化树Fig.3Phylogenetic relationships of cat-derived Ancylostoma at the ITS1locus assessed by a neighbor-joining analysis
锡兰钩虫主要流行于东南亚各国及澳洲地区,我国正位于该虫的流行区域,周边多国均曾报道过该虫[4-7],自金大雄、Yoshida等分别在贵州省和台湾省首次报道猫锡兰钩虫[8-9]至今,已有近半个世纪未见该虫报道,最近台湾省一例人体感染锡兰钩虫的病例[10]再次提醒我们,我国并非已经消灭了该虫,而是一直未能发现。
管型钩虫、锡兰钩虫、巴西钩虫是感染猫科动物3种常见的钩虫。其虫卵形态相似,显微镜检测难以区分,因此钩虫种类鉴定的早期研究均是通过从动物粪便或体内获取成虫,依据成虫的形态差异加以区分,但该方法耗时、耗力,对镜检人员的专业素质要求较高,并可能造成混合感染的漏检[8-9,11]。所以建立一种更为简便、精确、快速的鉴别方法对于钩虫的分类、流行病学及地理分布研究具有重要意义。
随着分子生物学的发展,研究人员开始尝试应用分子技术从遗传的角度区分不同种类钩虫。Gasser发现ITS序列可以作为区分管型钩虫、锡兰钩虫、犬钩虫、狭头钩虫的分子标记[12],Traub发现ITS序列可以区分犬钩虫、锡兰钩虫、巴西钩虫[11],Leandra再次证明ITS序列种内差异小,种间差异较大,具有高度的保守性,可以作为鉴别不同种钩虫的分子标记[13]。所以本研究选择ITS1作为分子标记,在国内首次采用分子生物学方法鉴定猫源钩虫的种类,通过对该株钩虫ITS1的扩增与测序,鉴定其为锡兰钩虫,测序结果丰富了锡兰钩虫的遗传学信息,为锡兰钩虫的分子遗传学和分子流行病学研究奠定了基础。本研究在近半个世纪以后再次在我国大陆地区发现猫锡兰钩虫,证明锡兰钩虫东南亚流行区域已连成一片,对于其地理分布、种群进化关系、种系发育研究具有重要意义。
[1]Palmer C S,Traub R J,Robertson I D,et al.The veterinary and public health significance of hookworm in dogs and cats in Australia and the status of A.ceylanicum[J].Vet Parasitol,2007,145(3-4):304-313.
[2]W ijers D J,Smit A M.Early symptoms after experimental infection of man w ith Ancylostoma braziliense var.ceylanicum[J].Trop Geogr Med,1966,18(1):48-52.
[3]Carroll SM,Grove D I.Experimental infection of humans with Ancylostoma ceylanicum:clinical,parasitological,haematological and immunological findings[J].Trop Geogr Med,1986,38(1):38-45.
[4]Anten J F,Zuidema P J.Hookworm infection in Dutch servicemen returning from West New Guinea[J].Trop Geogr Med,1964,64(756):216-224.
[5]Chowdhury A B,Schad G A.Ancylostoma ceylanicum:a parasite of man in Calcutta and environs[J].Am J Trop Med Hyg,1972,21(3):300-301.
[6]Velasquez C C,Cabrera B C.Ancylostoma ceylanicum(Looss,1911)in a Filipino woman[J].J Parasitol,1968,54(3):430-431.
[7]Sato M,Sanguankiat S,Yoonuan T,et al.Copro-molecular identification of infections with hookworm eggs in rural Lao PDR[J].Trans R Soc Trop Med Hyg,2010,104(9):617-622.
[8]庄生一,金大雄.贵州省食肉动物的钩口线虫类和锡兰钩虫的生活史研究[J].贵阳医学院学报,1982,7(2):54-69.
[9]Yoshida Y,Okamoto K,Chiu J K.Ancylostoma ceylanicum infection in dogs,Cats,and man in Taiwan[J].Am JTrop Med Hyg,1968,17(3):378-381.
[10]Hsu Y C,Jaw-Town L.Intestinal infestation with Ancylostoma ceylanicum[J].N Engl JMed,2012,366(13):1241.
[11]Traub R J,Robertson I D,Irwin P,et al.Application of a species-specific PCR-RFLP to identify Ancylostoma eggs directly from canine faeces[J].Vet Parasitol,2004,123(3-4):245-255.
[12]Gasser R B,Stewart L E,Speare R.Genetic markers in ribosomal DNA for hookworm identification[J].Acta Tropica,1996,62(1):15-21.
[13]Clara E M,M iranda R C,Santos H A,et al.Differential diagnosis of dog hookworms based on PCR-RFLP from the ITS region of their rDNA[J].Vet Parasitol,2006,140(3-4):373-377.
