动物源食品中聚醚类多残留液质联用检测技术研究
2013-09-05张骏王硕郑文杰许泓林安清
张骏,王硕,郑文杰,许泓,林安清
(1.天津科技大学食品营养与安全教育部重点实验室,天津 300457;2.天津出入境检验检疫局,天津 300461)
近30年来,兽药(包括药物添加剂)在畜牧业和水产养殖业中的应用日益广泛,其在降低发病率与死亡率、促生长、提高饲料利用率和改善产品品质方面的作用是十分显著的。兽药残留除了由于防治疾病用药引起外,将兽药作为饲料添加剂使用是主要原因,而聚醚类药物就是其中代表性的一类兽药。聚醚类抗生素(polyether antibiotics,PEs)是从金色链霉菌的发酵产物分离得到的一类离子载体抗生素,对多种球虫有抑制作用,并能提高饲料转化率,促进家畜生长,在家畜生产中广泛应用。在化学结构上,此类药物分子中通常含有若干环状醚键,分子一端有一羧基(表1),分子两端借助氢键相连而生成环状结构后,容易与Na+、K+等离子结合生成亲脂性络合物,增加离子向球虫细胞内运输,为了平衡渗透压,大量水分进入球虫细胞内,导致球虫肿胀而死亡,因此也被称为离子载体类抗球虫药。此类药物对鸡多种艾美耳球虫有特效,对球虫子孢子,第一代、第二代裂殖子均有抑杀作用,并能促进动物生长发育,增加体重和提高饲料利用率,故亦可用作促生长剂[1-3]。离子载体类药物对动管系统有明显的影响,具有扩张冠状血管和增加心脏冠脉流量的作用。饲养过程中,PEs抗球虫药物的添加量过高导致鸡肉或鸡蛋中的药物残留,可能对人类身体健康产生危害,尤其可能会加剧心血管患者的病情,因此安全范围较窄。不合理给药或饲料污染会导致动物中毒、动物性食品中药物残留及抗药性问题。目前,欧盟不允许PEs作为饲料添加剂使用,我国规定鸡肉中PEs的最高残留限量(MRLs)为:盐霉素(salinomycin,SAL)600 μg/kg;甲基盐霉素(narasin,NAR)600 μg/kg;莫能菌素(monensin,MON)1500 μg/kg;马杜霉素(maduramicin,MAD )240 μg/kg; 拉 沙 里 菌 素(lasalocid,LAS)400 μg/kg(鸡肝)。因此,研究建立动物源性食品中聚醚类药物多残留检测方法,对于有效监控该类药物的合理使用、保障我国动物源性食品安全具有重要的意义。
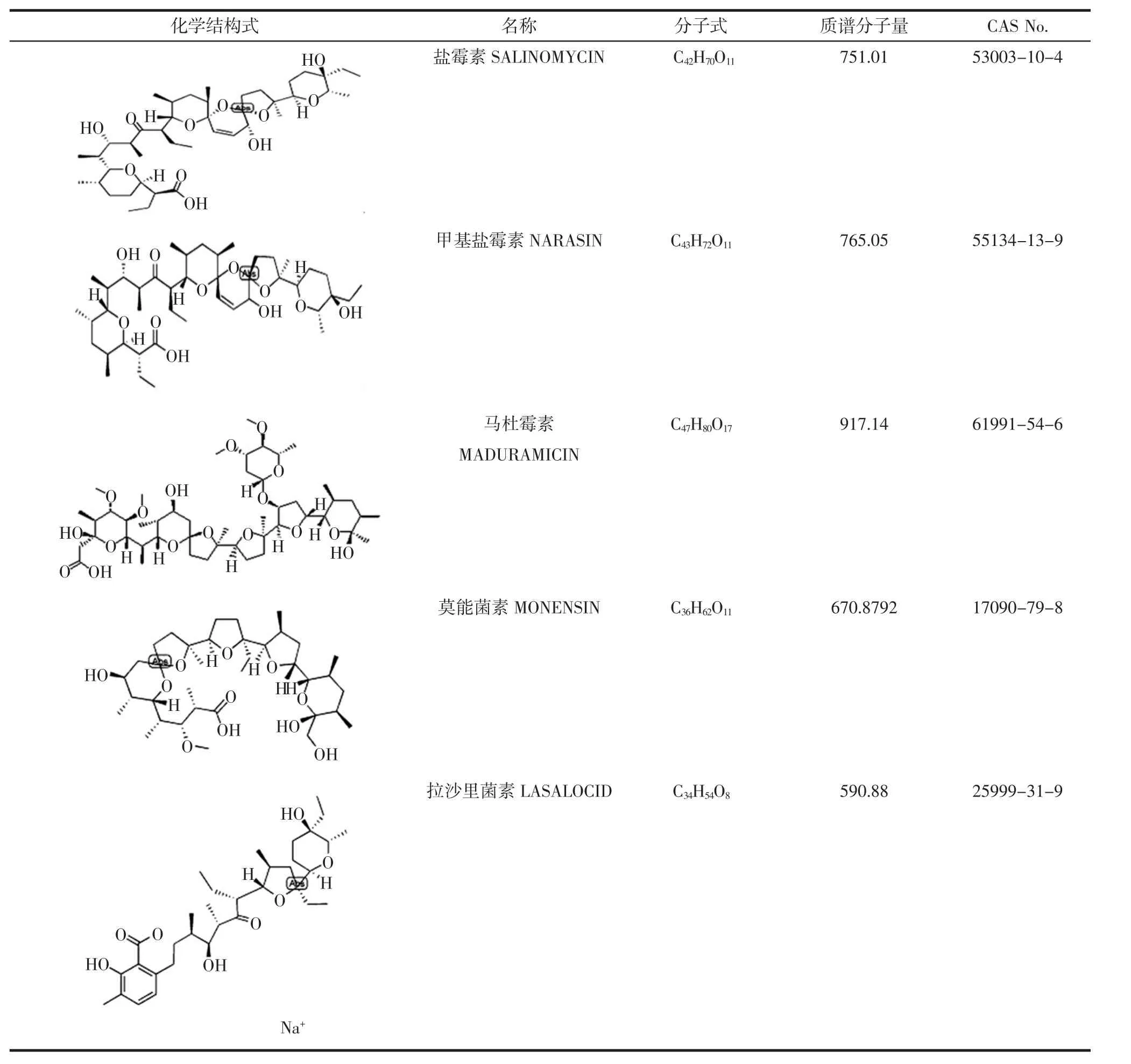
表1 5种目标物化学信息一览表Table 1 Chemical information of 5 PEs
目前聚醚类(PEs)残留的检测方法有微生物法、免疫学法[1]、高效液相色谱法(HPLC)[2-4]、液相色谱-质谱法(LC-MS)、液相色谱-串联质谱法(LC-MS/MS)[5]等。微生物法和免疫学法适用于药物的快速筛选,但无法准确地对其定性定量,且存在假阳性现象。HPLC法多采用柱前衍生化[2-3]或柱后衍生化[4],操作相对繁琐,且未检索到可同时分析盐霉素、甲基盐霉素、莫能菌素、马杜霉素、拉沙洛菌素的方法。LC-MS法、LCMS/MS法不需衍生化,样品处理简单快速,可同时检测上述5种药物,而且后者还能获得更高的灵敏度和更佳的定性效果。
1 材料与方法
1.1 仪器、试剂与样品
1.1.1 仪器
Agilent 1100-API 4000液相色谱-串联质谱联用仪:Agilent公司-AB公司,美国,配有电喷雾电离源和大气压化学电离源,并具有正-负电离方式自动切换功能;ASPEC XLi自动固相萃取仪:Gilson公司,美国;500 mg硅胶固相萃取柱:J.T.Baker公司,美国,使用前用6 mL正己烷分2次预洗;T25高速均质器:转速大于10 000 r/min:IKA公司,德国;N-EVAP112氮气吹干仪:OA公司,美国;231涡旋振荡器:Fisher Scientific公司,美国;离心机:北京医疗器械厂,中国,转速大于3 000 r/min。
1.1.2 试剂和材料
甲醇、乙腈、正己烷、二氯甲烷、甲酸均为色谱纯:0.1%甲酸水溶液:取1 mL甲酸溶解于1 000 mL水中;淋洗液:二氯甲烷-正己烷(50∶50,体积比);洗脱液:二氯甲烷-甲醇(80∶20,体积比);聚醚类标准品:盐霉素,纯度≥99%;甲基盐霉素,纯度≥97%;马杜拉霉素,纯度≥97%;莫能菌素,纯度≥97%;拉沙里菌素,纯度≥97%;聚醚类标准溶液:分别准确称取适量的盐霉素、甲基盐霉素、马杜拉霉素、莫能菌素、拉沙里菌素,用甲醇配制成1 mg/mL标准贮备溶液,保存于-18℃冰柜中,可使用一年,再根据需要以甲醇配制成不同浓度的混合标准溶液作为标准工作溶液,保存于4℃冰箱中,可使用三个月;基质提取液:空白样品,操作同1.2.1处理后得到的溶液;基质标准工作溶液:将标准工作溶液混合后在氮吹仪中吹干,以基质提取液溶解,涡旋30 s后即为基质标准工作溶液。
1.1.3 样品
鸡肉、猪肉、鱼肉:均购自本地超市。
1.2 方法
1.2.1 提取和净化
取有代表性样品,绞碎后搅拌均匀,制成实验室样品。试样分为二份,置于样品盒中,密封,并做上标记。称取绞碎混匀后测试样品约5.0 g(精确到0.1 g)于50 mL离心管中,加入15 mL乙腈,涡动2 min,离心(3 000 r/min)5 min,取上清液于50 mL鸡心瓶中;剩余残渣用15 mL乙腈重复提取1次;合并上清液。于40℃下旋转蒸发至干,用3 mL正己烷洗涤鸡心瓶,涡动30 s,转入10 mL离心管中,再用2 mL正己烷洗涤鸡心瓶,转入相同离心管中。
用6mL正己烷预洗硅胶柱,并使正己烷不流干。将收集的上清液过柱,用15mL二氯甲烷∶正己烷(50∶50,体积比)淋洗,再用 10 mL二氯甲烷 ∶甲醇(80∶20,体积比)洗脱,收集洗脱液,并于40℃下用氮气吹干,然后用1 mL乙腈复溶,过0.22 μm有机滤膜,滤液供LC/MS/MS分析。
1.2.2 测定条件
1.2.2.1 液相色谱条件
色谱柱:Sunfire C18柱,100 mm × 2.1 mm,3 μm(Waters公司,美国);柱温:25℃;流动相:乙腈-0.1%甲酸水(90∶10,体积比);进样量:25 μL;流速:0.4 mL/min。
1.2.2.2 质谱条件
离子化方式:电喷雾电离(ESI);扫描方式:正离子扫描;检测方式:多反应监测(MRM);离子源温度:550 ℃;雾化气压力:12 psi;气帘气压力:10 psi;辅助气1 压力:30 psi;辅助气 2 压力:30 psi;电喷雾电压:5 000 V;监测离子对、去簇电压、入口电压、碰撞能量和碰撞室出口电压见表2。
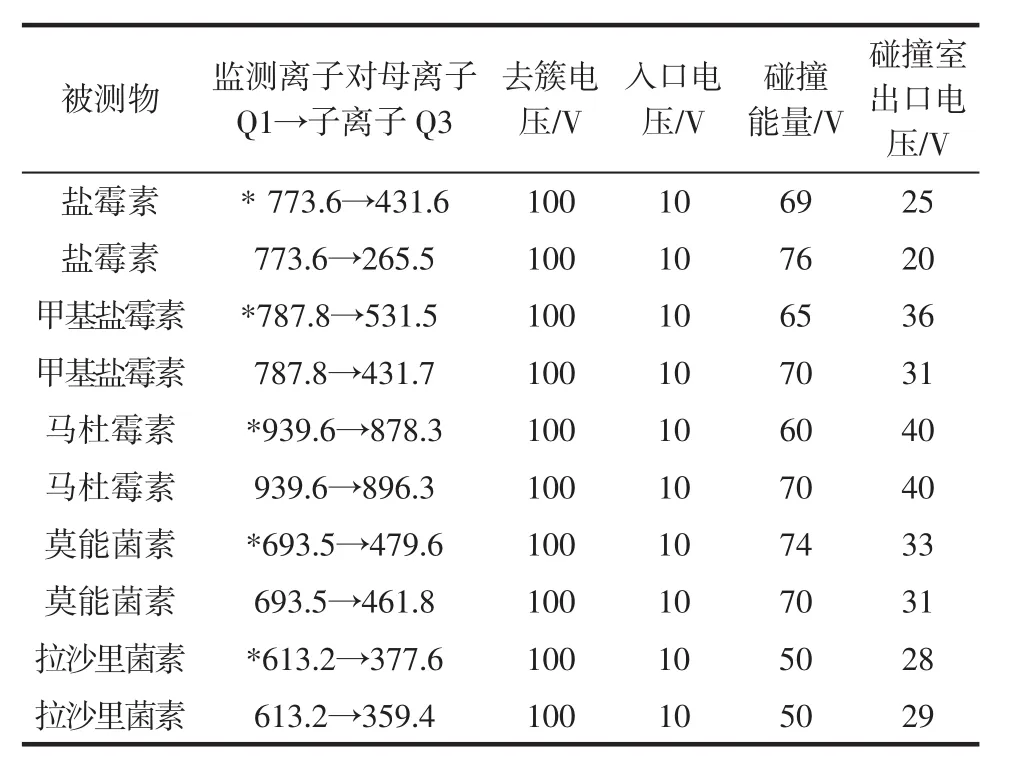
表2 聚醚类目标物质谱检测参数一览表Table 2 MS/MS parameters of PEs
2 结果与讨论
2.1 前处理条件的优化
2.1.1 提取条件的优化
聚醚类抗生素分子中含有多个环状醚键,结构特征是在直链碳骨架上连成多个四氢呋喃、四氢吡喃等含氧杂环;分子一端有1个羧基;在结晶状态,分子两端可借助氢键相连而成环状构型,具有离子载体性质,可形成多种金属盐,常以钠盐、钾盐或铵盐形式存在。微溶或不溶于水,易溶于低级醇、丙酮、氯仿、苯、乙醚、石油醚、乙酸乙酯、四氯化碳及正己烷等。在中性或碱性环境中稳定,其游离酸稳定性较差。根据以上特点,为了同时提取出动物组织样品中的这些化合物,采用了极性有机溶剂提取的方法。选择甲醇、乙腈、乙酸乙酯、丙酮和二氯甲烷为提取剂,对比提取效果。采用甲醇提取的极性杂质较多,尤其是提取蛋白含量较高的液体样品时,需要用酸沉淀其中的蛋白质,而聚醚类抗生素在酸性环境下稳定性较差,回收率较低。用乙酸乙酯、丙酮、二氯甲烷提取时,提取液中脂溶性共提物较多,为下一步净化带来困难。乙腈既可以避免共提出太多的脂溶性杂质,又能得到满意的回收率,实验结果表明,5种聚醚类药物回收率均可>75%。本实验选择乙腈为提取剂。
对振荡或超声的提取方法均进行研究,结果表明,超声或振荡对回收率没有明显的影响。因此最后采用乙腈涡动2 min提取5种聚醚类药物,回收率均达到要求,稳定性好,基质对测定无干扰,且操作过程简单快速。
2.1.2 净化条件优化
本研究采用固相萃取柱净化,比较了硅胶柱、C18柱、Oasis HLB柱的净化效果。由于目标化合物性质差异较大,使用HLB、C18等固相萃取柱,难以同时进行提取和净化并获得较好的回收。进一步的对比实验结果表明采用硅胶柱进行净化处理,可获得全部被测物较满意的回收,净化效果和平行性较理想。因此选用硅胶柱作为样品净化柱。又比较了国内外不同厂家牌号的硅胶柱,结果表明美国J.T.Baker公司Bakerbond SPE Sillica Gel(SiOH)Column(500 mg)回收率相对较高且重现性好,因而最终选择用Bakerbond SPE硅胶柱作为本研究的净化柱。
本研究按有关文献报道的硅胶柱固相萃取方法进行研究时,5种药物在添加水平不大于50 μg/kg时萃取回收率大于90%,添加0.1倍的MRL(鸡肉)时萃取回收率大于65%,添加1倍的MRL(鸡肉)时LAS、MON和MAD的萃取回收率均大于75%,但SAL和NAR低于20%,该结果表明大部分SAL和NAR发生了柱保留。因此,我们先尝试使用4 mL甲醇洗脱,将药物全部洗脱下来,但由于甲醇洗脱能力很强,在获得高回收率的同时也带来了严重的杂质干扰,对质谱仪的污染很大。参考一些文献,本研究以正己烷为上样液,对不同比例的二氯甲烷∶正己烷(体积比分别为60 ∶40、50 ∶50、40 ∶60)作为淋洗液进行了研究,确定了二者体积比为50∶50时,洗涤效果好且回收率高。二氯甲烷∶甲醇(80∶20,体积比)作为洗脱液其溶剂强度比甲醇低,能减少极性杂质的共洗脱,而目标药物的洗脱效果好。因此,最终我们采用正己烷为上样液,二氯甲烷∶正己烷(50∶50,体积比)洗涤,二氯甲烷∶甲醇(80∶20,体积比)洗脱,保证回收率的同时达到去除杂质的作用,使空白无干扰,并减少了有机溶剂的用量,缩短了样品的处理时间。
2.2 液相条件优化
本研究比较了ZORBAX Eclipse SB-C8柱,150 mm×4.6 mm,3.5 mm(Agilent公司,美国);和 Sunfire C18柱,100 mm ×2.1 mm,3 mm(Waters公司,美国)两种液相分析柱对聚醚类药物的分离效果,结果发现,Sunfire C18柱,100 mm × 2.1 mm,3 mm(i.d.)分析柱对目标化合物的灵敏度和分离度都较理想,因此选择该柱为分析柱。
本研究采用电喷雾的电离模式,由于电喷雾是在溶液状态下电离,因此,流动相的组成对目标化合物的电离有很大的影响。本研究考察对比了甲醇+水、乙腈+水、甲醇+甲酸水溶液、乙腈+甲酸水溶液、甲醇+乙酸铵水溶液、乙腈+乙酸铵水溶液做流动相的色谱效果。结果表明,乙腈+0.1%甲酸水溶液(0.1%的甲酸提高离子化效率)作为流动相洗脱时,聚醚类药物分离度和灵敏度较高。
2.3 质谱条件的选择
用10 μg/mL的5种聚醚类药物的混合标准溶液,在ESI+模式下进行母离子全扫描,未出现m/z为 [M+1]+的分子离子峰,却发现在 [M+23]+处的离子峰很强。这与此类药物的化学结构和性质有关:聚醚类药物分子为含有若干杂环醚基的开链结构,通过分子中羧基和羟基间的氢键作用形成环状结构后,很容易“捕获”Na+,形成[M+Na]+离子。优化准分子离子([M+23]+)的毛细管电压、锥孔电压等质谱参数后,分别以5种药物的[M+23]+离子为母离子,对子离子进行全扫描,选择信号强度较大、干扰较小的两个碎片离子为特征离子,最后以多反应监测(MRM)正离子模式优化了各种质谱分析参数,具体质谱参考条件见表2。
2.4 方法的线性范围
配制5种聚醚类药物的系列标准溶液,其浓度分别为 5.0、25、50、100、500 ng/mL 的混合标准溶液,以本方法的测试条件,进样25 μL进行测定,用峰面积对标准溶液中各被测组分的浓度做图,其各目标物在检测范围内均呈线性关系,线性方程和相关系数见表3。
2.5 灵敏度
取20个空白样品进行前处理,LC-MS/MS检测。按信噪比(S/N)=3为检出限(LOD),S/N=10为定量限(LOQ),样品中5种聚醚类药物的检出限为盐霉素

表3 5种聚醚类药物线性方程和相关系数Table 3 Linear equations and related coefficient of 5 PEs
0.002 mg/kg,其余4种为0.005 mg/kg,定量限盐霉素为
0.005 mg/kg,其余4种为0.01 mg/kg。
2.6 方法的回收率
本研究以不含被测药物的空白样品为基质,作了3个水平添加回收率实验,加标鸡肉样品的色谱图见图1,回收率实验结果见表4。所测5种药物的室间平均回收率在89.6%~99.2%之间。
2.7 方法的精密度
采用空白基质中添加标准法进行重复性测定,每个水平为10个样品,精密度(RSD)在5.0%~10.3%之间,结果见表4。
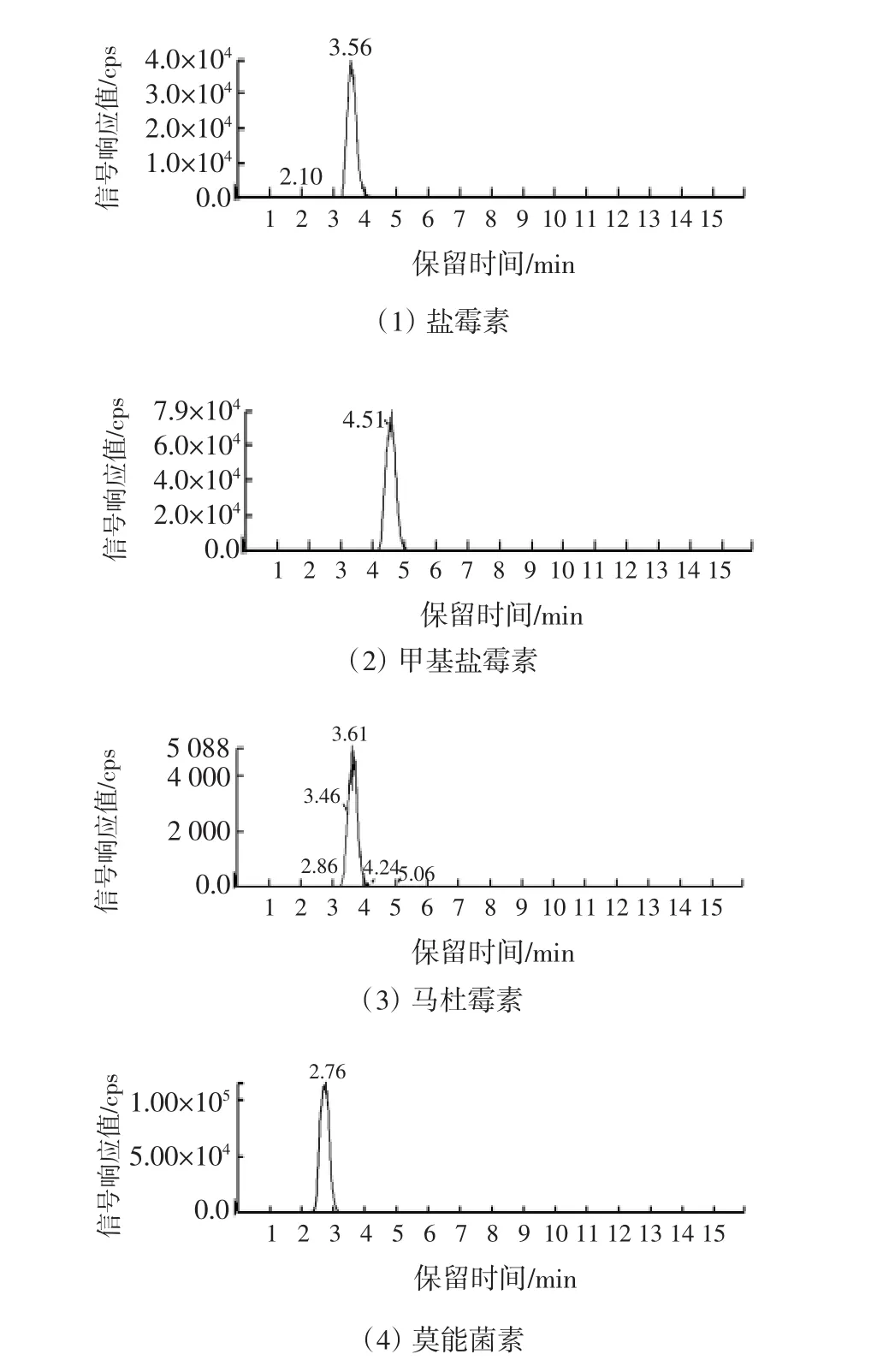
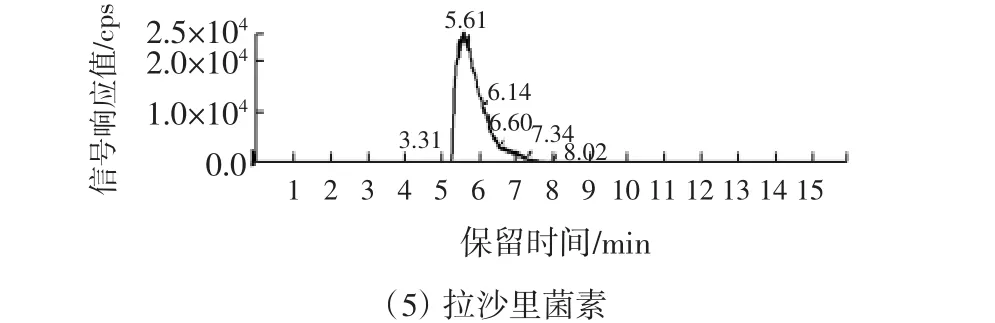
图1 浓度为0.05 mg/kg鸡肉样品添加回收的质量色谱图Fig.1 Total ion current chromatograms of blank chicken muscle spiked with 0.05 mg/kg PEs
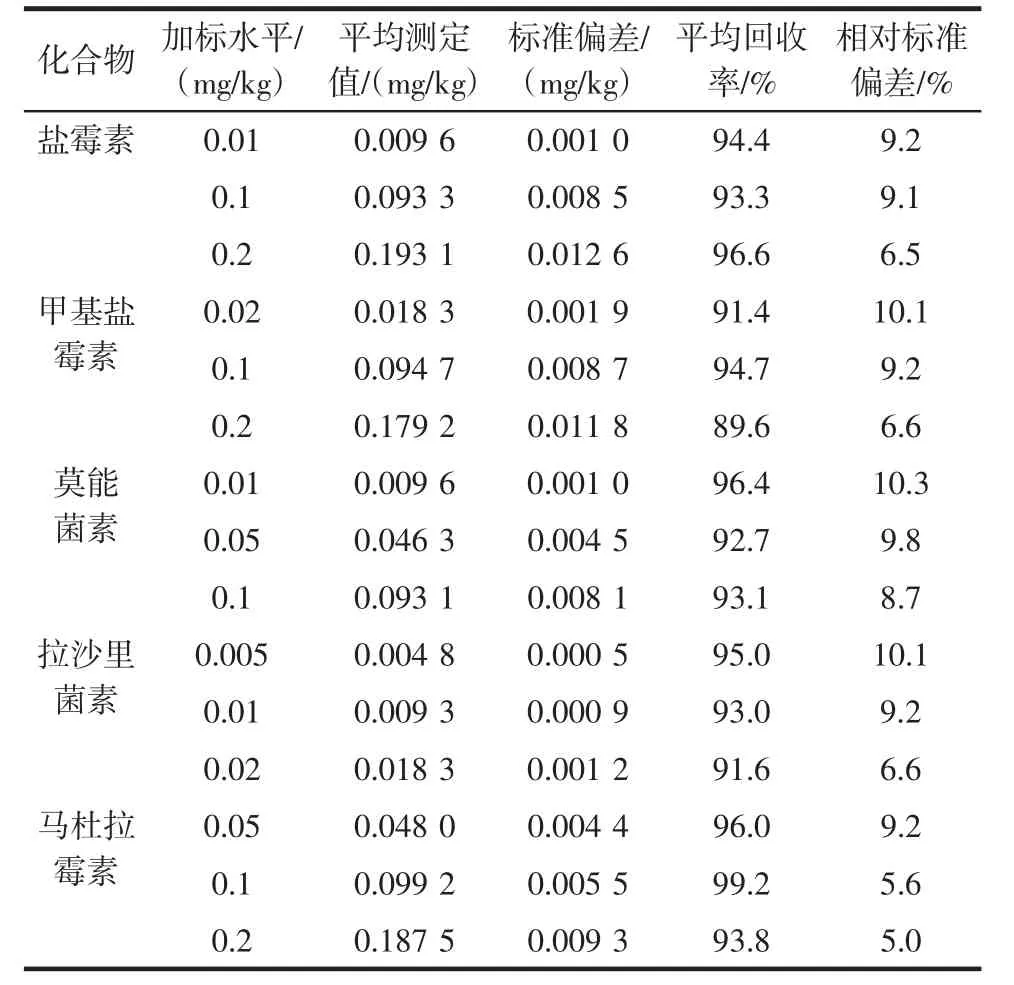
表4 鸡肉中聚醚药物添加回收率和精密度数据(测定次数:10次)Table 4 Average recoveries,relative standard deviations(RSD)of determinations of 5 PEs spiked at 3 levels in chicken muscle(n=10)
2.8 方法的适用性
在本方法研究实验过程中,先后检测过动物源食品有:鸡肉、猪肉、鱼肉等。用不含本方法所测5种聚醚类药物的上述动物源性样品分别做添加回收率和精密度试验,样品添加不同浓度标准后,按本方法进行样品制备、净化和测定,平均回收率为83.8%~99.2%,相对标准偏差CV在3.8%~10.3%之间,表明本方法回收率高,精密度好。
3 结论
本实验建立了可同时检测动物源食品中盐霉素、甲基盐霉素、马杜霉素、莫能菌素和拉沙里菌素多残留的LC-MS/MS方法。在已有的研究基础上对样品的前处理方法进行了优化和改进。该方法简单快速,回收率高,重现性好,适用于动物源性食品中聚醚类药物的多残留检测,方法检出限满足欧盟指令及我国残留监控要求。
:
[1]D Glenn Kennedy,S Armstrong Hewitt,John D G McEvoy,et al.Zeranol is formed from spp.Toxins in cattle in vivo[J].Food additives and contaminants,1998,15(4):393-400
[2]Anton F Erasmuson,Bryan G Scahill,David M West.Natural Zeranol in the Urine of Pasture-Fed Ainmals[J].J Agric Food Chem,1994,42(2):2721-2725
[3]国家质量监督检验检疫总局进出口食品安全局,动植物检疫监管司,国际合作(科技)司,中国进出口商品检验技术研究所.动物和动物源食品中兽药残留物分析方法[M].北京:中国轻工业出版社,2003:140-150
[4]汪正范,杨淑敏,吴侔天,等.色谱联用技术[M].北京:化学工业出版社,2001:122-154
[5]帕拉马尼克,甘古利,格罗斯.电喷雾质谱应用技术[M].蒋宏建,俞克佳,译.北京:化学工业出版社,2005:4-34
