南五味子多糖的提取及其体外抗氧化作用
2013-09-05谭晓虹王志宝李雪金凤张丹参
谭晓虹,王志宝,李雪,金凤,张丹参
(河北北方学院药学系,河北 张家口 075000)
南五味子是木兰科植物华中五味子[Schisandra sphenanthera Rehd.et Wils.]的干燥成熟果实,是一种多功能、多用途的药食兼用型经济植物,主要产于甘肃、陕西、四川等省。为中国药典2010年版一部收录品种,南五味子具有收敛固涩、益气生津、涩精止泻、补肾宁心之功效。南五味子主要含有木脂素、多糖、挥发油、三萜、氨基酸和无机元素等有效成分[1],这些成分对神经系统、心脑血管系统、消化系统等具有多种药理作用。现代研究证明,南五味子还具有对肝细胞的保护作用[2]、抗肿瘤[3]、抗氧化[4]和显著的镇静催眠作用[5],在临床上应用较广泛。此外,五味子作为药食两用植物,在保健食品中有一定的应用,其综合利用的经济价值逐渐引起人们的重视。本实验采用正交设计方案,应用微波法对南五味子多糖提取条件进行研究,优选出南五味子多糖微波辅助提取的最佳条件,并对提取得到的南五味子多糖进行体外抗氧化实验研究,以期为南五味子的临床应用提供新思路,并为综合开发利用南五味子资源提供参考。
1 仪器与材料
1.1 仪器
UV1000单光束紫外可见分光光度计:上海天美科学仪器有限公司;TDL80-2B离心机:上海安亭科学仪器厂;Acculab ALC-210.4电子天平:赛多利斯科学仪器有限公司;MAS-Ⅱ微波辐射萃取仪:上海新仪微波化学科技有限公司;DHG-9070AS新型电热恒温鼓风干燥箱:宁波江南仪器厂;DK-8B型电热恒温水槽:上海精宏实验设备有限公司;SZ-97A自动三重水蒸馏器:上海亚荣生化仪器厂。
1.2 材料
南五味子(产地四川):购于张家口市药材公司;二苯代苦味肼基自由基(DPPH):北京中生瑞泰科技有限公司;葡萄糖、乙醇、苯酚、浓硫酸等均为国产分析纯,实验用水为三重蒸馏水:河北北方学院药物化学教研室。
2 方法
2.1 南五味子多糖提取
准确称取干燥的南五味子粉末10 g,各9份,在单因素分析的基础上,以蒸馏水为提取溶剂,选取料液比、提取时间、提取温度3个因素,并各设置3个水平,按L9(34)正交表设计试验方案,采用微波提取,提取液过滤后,滤液浓缩为100 mL,加入3倍量95%乙醇,静置24 h。抽滤,将沉淀用无水乙醇、丙酮和乙醚依次洗涤,真空干燥,得到南五味子粗多糖。水平因素见表1,正交表见表2。

表1 正交试验的因素与水平Table 1 Factors and levels schedule
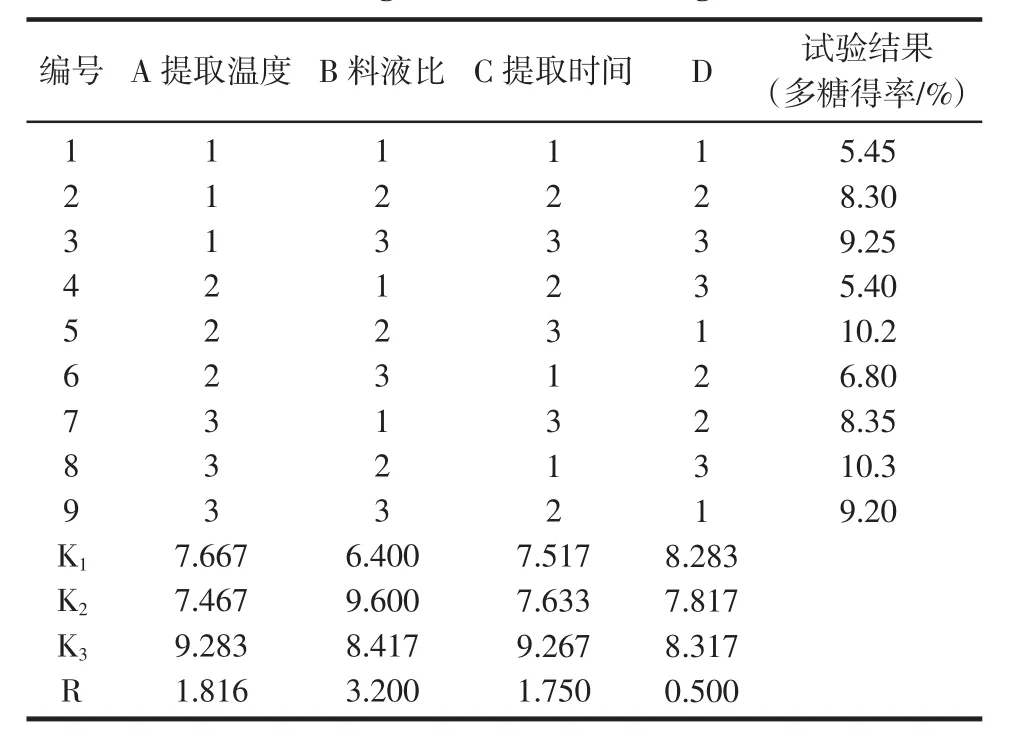
表2 正交试验设计及结果Table 2 Design and results of orthogonal test
2.2 多糖含量测定
2.2.1 标准曲线的绘制
精密称取105℃干燥至恒重的葡萄糖100 mg,加蒸馏水溶解并定容至100 mL容量瓶中,配成1.0 mg/mL的标准贮备液。精密吸取葡萄糖标准贮备液1.0、2.0、3.0、4.0、5.0、6.0 mL分别置于 25 mL容量瓶中,加入5%苯酚溶液1.0 mL,98%浓硫酸5.0 mL,用蒸馏水稀释至刻度,充分摇匀后,于30℃水浴中放置30 min,然后冷却至室温,另以蒸馏水同上操作为空白对照,于波长490 nm处测定吸光度,以葡萄糖溶液浓度C为横坐标,吸光度A为纵坐标,绘制标准曲线。
2.2.2 精密度试验
精密量取同一葡萄糖标准品溶液1.0 mL,同2.2.1方法处理,重复测定5次,结果表明吸光度的RSD为1.35%(n=5)。
2.2.3 重复性试验
精密称取同一批次南五味子药材粉末5份,制备供试品溶液进行测定,结果南五味子多糖含量的RSD为1.94%(n=5)。表明该方法重复性良好。
2.2.4 回收率试验
精密量取已知多糖含量的供试品溶液2.0 mL(5份)分别置于试管中,再分别精密加入一定量的标准溶液,依“2.2.1”项下测定方法测定其吸光度,结果表明:平均回收率为98.96%,RSD为1.43%(n=5)。
2.2.5 稳定性考察
精密量取同一供试品溶液,分别于0、20、40、60、80、100、120 min按“2.2.1”项下方法测定。计算 RSD 为1.24%(n=7)。
2.2.6 换算因子的测定[6]

式中:W为南五味子粗多糖的质量,mg;C为南五味子多糖中葡萄糖的质量浓度,(mg/mL);D为南五味子多糖溶液的稀释倍数。测得f=0.572。
2.2.7 多糖含量的计算
按照最佳条件处理得南五味子多糖提取液定容至 100 mL,吸取溶液 1.0 mL,根据“2.2.1”按照绘制标准曲线的步骤,于波长490 nm处测定其吸光值,计算南五味子多糖的得率。

式中:W为南五味子的质量,mg;C为南五味子多糖中葡萄糖的质量浓度,(mg/mL);D为南五味子多糖溶液的稀释倍数。
2.3 验证实验
分别称取10 g南五味子药材粉末3份,按照所选最佳条件提取南五味子多糖并进行测定。
2.4 南五味子多糖体外抗氧化作用
2.4.1 供试样品的制备
取一定量南五味子粗粉,按所选最佳条件提取多糖。
准确称取制备得到的南五味子多糖1.001 2 g,用蒸馏水溶解并定容于100 mL容量瓶,摇匀,作为贮备液,试验时根据需要进行稀释。
2.4.2 南五味子多糖对DPPH·的清除作用[7-8]
不同浓度的南五味子多糖对DPPH·清除能力的测定,准确称取0.007 9 g DPPH加入无水乙醇配制成100 mL溶液,避光保存。取6支具塞试管,依次编号,各管中准确加入浓度分别为 0.2、0.4、0.6、0.8、1.0 mg/mL南五味子多糖溶液2.0 mL,然后各管分别加入DPPH溶液2.0 mL,摇匀,置于暗室,准确反应30 min,在波长517 nm处测得样品组吸光度值为Ai。以2 mL无水乙醇溶液代替DPPH溶液,步骤同上,于波长517 nm处测得样品本身吸光度值为Aj。以2.0mL蒸馏水与2.0mL DPPH,重复上述步骤,于波长517 nm处测得对照组吸光度值为A0。以等体积蒸馏水作为空白调零。按下式计算清除率:
DPPH清除率%=[A0-(Ai-Aj)]/A0×100%2.4.3 南五味子多糖对·O2-的清除作用[9]
不同浓度的南五味子多糖对·O2-清除能力的测定,取6支具塞试管,依次编号,分别加入浓度为0.2、0.4、0.6、0.8、1.0 mg/mL 的五味子多糖溶液各 1.0 mL,分别加入pH8.2的Tris-HCl缓冲溶液5.0 mL,充分混匀,于25℃恒温水浴20 min,再加入0.1 mL 25℃预热的邻苯三酚溶液,迅速混匀,准确反应4 min,加入12 mol/L的盐酸1.0 mL终止反应。迅速摇匀后,于325 nm波长处测定各试管的吸光度值(Ai)。分别取不同浓度的样品溶液1.0 mL,以蒸馏水代替反应试剂,于325 nm波长处测定样品溶液本身的吸光度值(Aj)。空白管以蒸馏水代替样品溶液,于波长325 nm测吸光度值(A0)。按下式计算清除率:
·O2-清除率=[A0-(Ai-Aj)]/A0×100%2.4.4 南五味子多糖对·OH的清除作用[4,10]
不同浓度的南五味子多糖对·OH清除能力的测定,向6支试管中分别加入浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的五味子多糖溶液1.0 mL,硫酸亚铁2.0 mL,水杨酸-乙醇溶液1.5 mL,最后加入0.03%双氧水0.10 mL启动反应,震荡混合均匀,水浴37℃,反应30 min,在波长510 nm处测量南五味子多糖各浓度的吸光度值为Ai。为消除样品本身颜色的影响,以蒸馏水代替双氧水重复上述操作得到吸光度值Aj,以蒸馏水代替样品作为空白对照得到吸光度值A0。按下式计算清除率:
·OH清除率=[A0-(Ai-Aj)]/A0×100%
3 结果
3.1 多糖测定的标准曲线方程
多糖测定的标准曲线方程为:A=15.955C-0.017 7,R2=0.998 1。在多糖测定中本实验精密度、重复性良好,回收率符合要求,供试品溶液在120 min内基本稳定。
3.2 正交试验结果
方差分析结果见表3。

表3 方差分析表Table 3 Analysis of variance
方差分析表明,因素B(料液比)对南五味子多糖的微波提取有显著影响,而因素A(提取温度)及因素C(提取时间)对南五味子多糖的提取影响不显著。由正交试验结果表2可知,在3个因素中,对南五味子多糖得率的影响程度依次为B>A>C,得到最佳提取条件为 A3B2C3,即采用 80 ℃,料液比为 1 ∶30(g/L),微波作用时间15 min为最佳提取条件。
3.3 验证试验
在最佳提取条件下进行验证试验,结果表明:在此条件下提取南五味子多糖,其平均含量为8.70%(n=3,RSD=2.49%)。
3.4 南五味子多糖体外抗氧化作用研究
南五味子多糖对DPPH·、·O2-及·OH的清除作用结果表4。
由表 4 可知:南五味子多糖对 DPPH·、·O2-及·OH均具有清除作用,并呈现剂量依赖关系。
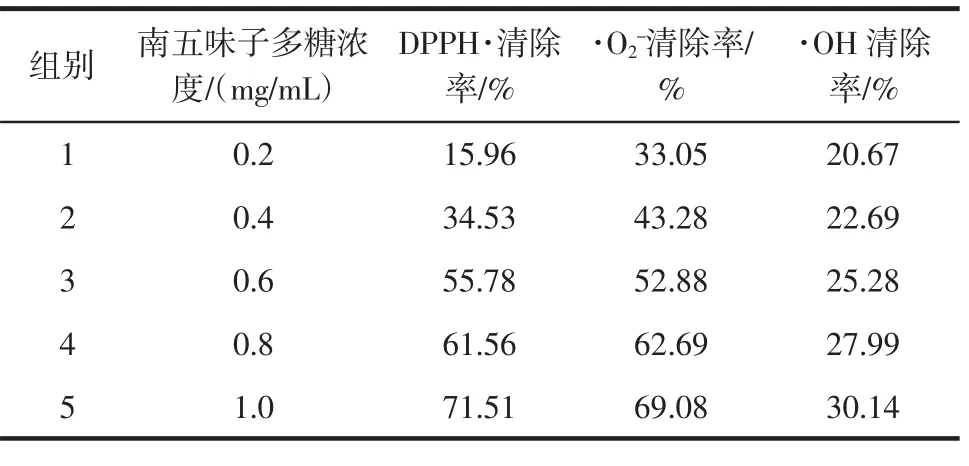
表4 南五味子多糖对DPPH·、·O2-及·OH的清除作用Table 4 Scavenging effects of polysaccharides from Schisandra sphenanthera on DPPH·,·O2-and·OH
4 讨论
1)微波能在短时间内穿透细胞组织内部,使其内部分子极化并迅速升温,达到良好的提取效果[11]。同时,微波提取法可节省提取时间,并可有效保护食品、药品以及其他化工物料中的功能成分,对提取物具有高选择性,提取效率高及耗能低等优点[12]。因而,微波提取法在药物有效成分的提取中被广泛采用。本试验表明,在微波辅助提取南五味子多糖的影响因素中,料液比对南五味子多糖的提取有显著影响,料液比为1∶30时提取效率良好,而提取温度及提取时间对南五味子多糖的提取影响不显著。
2)本实验研究表明,南五味子多糖具有较强的清除 DPPH·、·O2-及·OH 的作用,且呈剂量依赖性,南五味子多糖具有抗氧化作用。五味子是临床常用中药,但一直以来在临床使用中普遍认为南五味子药效较差,临床用药多以北五味子为佳。本实验结果表明,南五味子的有效成分之一—南五味子多糖具有较强的体外抗氧化活性,可作为一种自由基清除剂。由此可见,南五味子是一种具有开发潜能的植物,我们应充分开发利用南五味子资源,更加重视其在医药领域中的应用。从而解决经济发展和生态环境变迁导致的北五味子蕴藏量大幅度下降,供需矛盾尖锐的问题。同时,南五味子作为一种药食两用的植物,可将南五味子多糖开发为抗氧化剂及功能食品,为南五味子新的开发利用开拓思路。
:
[1]许利嘉,刘海涛,彭勇,等.五味子科药用植物亲缘学初探[J].植物分类学报,2008,46(5):692-723
[2]许珂玉,柳春.五味子多糖对CCl4诱导的肝损伤大鼠亚细胞水平的保护作用[J].中国老年学杂志,2011,31(4):1352-1354
[3]刘力生,王勤,郑荣梁,等.五味子乙素对小鼠免疫功能、腹水型肝癌细胞DNA合成和存活率的作用[J].兰州大学学报:自然科学版,1990,26(1):55-59
[4]吴少辉,赵春苏,于新.南五味子提取物清除DPPH·、·OH活性的研究[J].广东农业科学,2012,13(1):134-136
[5]柳燕,李林燕,曹小帅.南五味子总木质素对自由活动大鼠睡眠时相的影响[J].中药药理与临床,2011,27(5):48-50
[6]黄秀香,阮赞华,韦瑞松.半边莲多糖的微波复合酶法提取工艺优化[J].时珍国医国药,2012,23(8):1976-1977
[7]穆怀雪,杨新周,姚福泉,等.不同提取方法对五味子清除DPPH自由基作用的影响研究[J].时珍国医国药,2012,23(6):1454-1455
[8]王锐,周云,何嵋,等.玫瑰茄粗多糖清除DPPH自由基活性研究[J].中国农学通报,2011,27(8):128-131
[9]马永全,刘福瑜,于新.南药五味子提取物清除自由基活性的研究[J].食品工业,2010(3):1-3
[10]赵杰,官守涛,孙设宗,等.半枝莲多糖清除氧自由基及抗脂质过氧化作用[J].中成药,2012,34(7):1361-1364
[11]闵建华,曹旻旻,韦冬菊,等.微波辅助提取红景天苷的工艺研究[J].中草药,2012,4(8):1536-1539
[12]史秀玲,高银辉,梁海英,等.正交试验优选杜仲多糖提取工艺[J].中国药房,2012,23(3):223-225
