TNF-α对骨结核破骨细胞诱导机制的研究
2013-09-04杨德猛王长庚李江伟任世超
宁 旭,杨德猛,王长庚,李江伟,叶 川,任世超
(1 贵阳医学院附属医院,贵阳 550004;2 江西省萍乡市人民医院)
结核杆菌(MTB)是对人类健康威胁最大的病原体之一。骨关节结核是由MTB通过血液或淋巴系统播散至骨与关节,造成血供丰富和负重大或活动较多的骨关节发生坏死,是发病率最高的肺外结核疾病,占肺外结核总发病率的35%[1]。研究表明,TNF-α能通过与破骨细胞前体细胞上的相应受体结合,直接或间接调节破骨细胞的分化、激活和凋亡[2-4]。但在骨关节结核发病过程中TNF-α是否调控破骨细胞分化、激活,导致骨破坏鲜见报道。2011年7月~2012年9月,我们进行了相关研究。现报告如下。
1 材料与方法
1.1 材料 3周龄雄性昆明小鼠6只,由第三军医大学实验动物中心提供;标准MTB(mycobacterium tuberculosis H37rv)由贵阳医学院微生物教研室提供。主要实验材料有α-MEM培养基(Gibico),抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(Sigma),胎牛血清(南美Hyclone),小鼠TNF-α试剂盒(ADL)。
1.2 方法
1.2.1 MTB冻干物的制备 取对数期MTB,加入无菌水,制成混悬液。超声裂解组取MTB混悬液,冰浴条件下超声裂解仪裂解,设置电压300 W,超声时间8 s,超声间隔10 s,裂解30 min,所得混悬液低温离心50 min,取上清液,0.45 μm 滤过膜过滤、分装、冻干,4℃保存备用。热处理组取MTB混悬液,80℃密封水浴30 min×2次,所得混悬液分装、冻干,4℃保存备用。
1.2.2 小牛骨磨片的制备 取新鲜小牛四肢皮质骨,手工修成0.5 cm×0.5 cm 大小骨块并打磨光滑,在5%戊二醛固定2 h后,用Leica硬组织切片机将骨块切成10 μm厚骨片,依次行梯度乙醇脱水、0.25 mol/L稀氨水超声清洗仪清洗3次,自然干燥后用铅笔标记正反面,经γ射线照射消毒后,浸泡在含链霉素和青霉素各1000 U/mL的PBS液中,4℃保存备用。
1.2.3 小鼠破骨细胞的诱导与分组 将6只小鼠用脱髓法处死,75%乙醇浸泡5 min,无菌操作下快速分离肱骨及股骨,剪去两端骨骺,用α-MEM培养液(含1000 U/mL链霉素、1000 U/mL青霉素、15%胎牛血清)反复冲洗骨髓腔至颜色发白。收集骨髓细胞冲洗液,吹打混匀,过滤,离心弃上清;用α-MEM培养液重悬2次后接种于培养皿中,在5%CO2、37℃孵箱培养24 h,收集培养液,离心,重悬,计数,镜下调节单核细胞密度至2.0×106/mL。接种0.5 mL细胞悬液于24孔培养板中(12个含骨磨片)。设热处理组和超声裂解组各5个副孔,其中1个空白对照,其他4孔分别加入热处理MTB冻干物和超声裂解MTB冻干物,调整MTB浓度至0.2、2、20、200 μg/mL,置入 5%CO2、37 ℃孵箱中培养,每48 h更换细胞培养液1次,始终维持各组MTB冻干物浓度不变,诱导7 d。
1.2.4 TNF-α 定量检测 收集诱导 24、48 h后的细胞培养液,采用ELISA法检测细胞培养液中的TNF-α浓度。首先于酶标仪中测定ELISA试剂盒中标准品在450 nm波长处的吸光度(OD)值,以OD值为纵坐标,标准品浓度为横坐标,绘制标准曲线。根据样品的OD计算对应浓度值。
1.2.5 TRAP染色及骨陷窝的观察、计数 细胞诱导7 d,倾去培养板中的培养液,用去离子水冲洗细胞3次,依照TRAP染色试剂盒说明书配置固定液及染色液,并将染色液水浴至37℃。固定液固定细胞30 s,弃固定液,冲洗3遍。每孔加入150 μL染色液,用锡箔纸包裹培养板后,置于37℃孵育箱中反应60 min,去离子水冲洗晾干。将骨磨片放入0.25 mol/L氨水中超声洗涤5 min×3次,去除附着细胞,用1%甲苯胺蓝溶液室温染色3~4 min,1%盐酸乙醇分化,丙酮脱水,蒸馏水清洗,室温晾干。镜下观察每孔中TRAP阳性细胞(阳性细胞核≥3个)计数及骨陷窝情况。
1.2.6 统计学方法 采用SPSS21.0统计软件,结果用表示,组间比较采用方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 热处理组和超声裂解组TNF-α浓度比较 诱导24 h后,热处理组中各浓度组与空白对照组比较均无统计学差异(P均 >0.05);超声裂解组中除0.2 μg/mL组TNF-α浓度与空白对照组无统计学差异(P>0.05)外,其余各浓度组均高于空白对照组(P均 <0.05),且随 MTB 浓度增加,TNF-α 浓度逐渐增加,不同浓度组间比较均有统计学差异(P均<0.05)。诱导 48 h 后,超声裂解组中除 0.2 μg/mL组TNF-α浓度与空白对照组无统计学差异(P>0.05)外,其余各浓度组均高于空白对照组(P均<0.05),且随 MTB浓度增加,TNF-α 浓度也逐渐增加,不同浓度组间比较均有统计学差异(P均 <0.05)。见表1。
2.2 热处理组和超声裂解组TRAP阳性细胞比较诱导7 d后,热处理组中的实验组和空白对照组均有少量TRAP阳性细胞形成,各组间比较无统计学差异(P均>0.05)。超声裂解组中各实验组均有TRAP阳性细胞形成,除0.2 μg/mL组与空白对照组比较无统计学差异(P >0.05)外,2、20 μg/mL组与空白对照组比较均有统计学差异(P均<0.05),200 μg/mL 组在诱导培养 3 d 后,培养液中出现大量漂浮死亡细胞,镜下观察细胞形态及结构模糊、裂解。
表1 热处理组和超声裂解组诱导24、48 h后培养液中的TNF-α浓度比较(pg/mL,)

表1 热处理组和超声裂解组诱导24、48 h后培养液中的TNF-α浓度比较(pg/mL,)
注:与空白对照组比较,*P <0.05;超声裂解组0.2、2、20、200 μg/mL 组间比较,P <0.05
组别 n 诱导24 h的TNF-α浓度 诱导48 h的TNF-α浓度5.160.2 μg/mL 组 30 77.72 ±3.67 94.06 ±6.54 92.24 ±7.68 104.06 ± 6.862 μg/mL 组 30 79.20 ±5.20 122.95 ±5.67* 96.45 ±9.79 314.95 ±10.82*20 μg/mL 组 30 77.40 ±5.03 150.54 ±6.62* 93.07 ±9.78 570.06 ±17.08*200 μg/mL 组 30 79.76 ±4.06 224.75 ±9.06* 96.54 ±9.67 633.64 ±20.17热处理组 超声裂解组空白对照组 30 76.78 ±4.56 92.91 ±4.25 95.81 ±5.84 102.62 ±热处理组 超声裂解组*
2.3 热处理组和超声裂解组骨吸收陷窝计数比较诱导7 d后,各组骨片均出现圆形、椭圆形或腊肠形的连续或不连续骨陷窝,热处理组各浓度组与空白组比较均无统计学差异(P均>0.05)。超声裂解组中除0.2 μg/mL组与空白组无统计学差异(P>0.05)外,其余各浓度组与空白组比较均有统计学差异(P均<0.05),且随浓度增加,骨陷窝计数逐渐增大,但200 μg/mL组与20 μg/mL组比较明显减少。见表2。
表2 热处理组和超声裂解组破骨细胞、骨陷窝计数比较(个,)
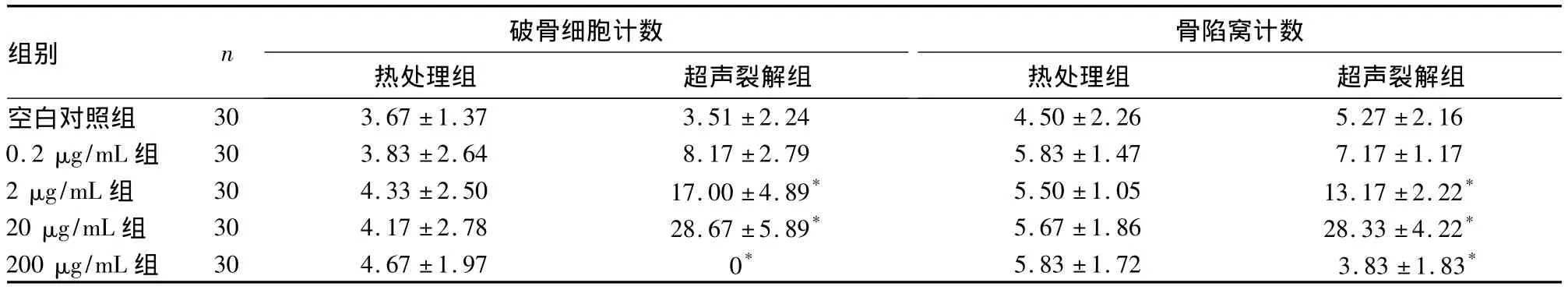
表2 热处理组和超声裂解组破骨细胞、骨陷窝计数比较(个,)
注:与空白对照组比较,*P <0.05;超声裂解组0、2、20、200 μg/mL 组间比较,P <0.05
组别 n 破骨细胞计数骨陷窝计数30 3.67 ±1.37 3.51 ±2.24 4.50 ±2.26 5.27 ±2.160.2 μg/mL 组 30 3.83 ±2.64 8.17 ±2.79 5.83 ±1.47 7.17 ±1.172 μg/mL 组 30 4.33 ±2.50 17.00 ±4.89* 5.50 ±1.05 13.17 ±2.22*20 μg/mL 组 30 4.17 ±2.78 28.67 ±5.89* 5.67 ±1.86 28.33 ±4.22*200 μg/mL 组 30 4.67 ±1.97 0* 5.83 ±1.72 3.83 ±1.83热处理组 超声裂解组空白对照组热处理组 超声裂解组*
3 讨论
骨关节结核患者骨质破坏的具体机制尚不明确。破骨细胞的成熟和活化主要依赖于成骨细胞表达核因子κB受体激活剂配体与破骨前体细胞表面核因子κB受体的结合,通过经典信号通路或旁路,导致破骨细胞成熟和活化[5]。当破骨细胞骨吸收活动与成骨细胞骨形成活动的动态平衡紊乱时,易导致骨吸收发生[6]。TNF-α在控制MTB感染过程中起重要作用。Al-Attiyah等[7]将肺结核患者的外周血单核细胞与MTB相关抗原体外共同培养2 d后,与空白组比较,实验组细胞培养液中的TNF-α浓度明显增高。本研究中,热处理组与空白对照组相比,破骨细胞数目、培养液中的TNF-α浓度、骨陷窝计数均无统计学差异,表明热处理MTB冻干物不能刺激骨髓单核细胞分泌TNF-α和诱导破骨细胞形成;超声裂解组与空白对照组比较,破骨细胞数目、培养液中的TNF-α浓度、骨陷窝计数均高于对照组(0.2 μg/mL组除外),表明超声裂解MTB冻干物能刺激骨髓单核细胞分泌TNF-α和诱导破骨细胞形成,并导致骨质破坏。
超声裂解组中,随着MTB浓度和培养时间延长,细胞培养液中的TNF-α浓度逐渐增高,破骨细胞数量和骨陷窝计数逐渐增加。表明超声裂解MTB冻干物能刺激骨髓单核细胞分泌TNF-α与受体结合,直接或间接激活 NF-κB、JNK、p38、ERK 等信号通路而调节破骨细胞形成、激活,从而调控破骨细胞形成及活化,导致骨质破坏。当超声裂解MTB冻干物达到200 μg/mL时,诱导3 d后培养液出现大量漂浮死亡细胞,骨陷窝数明显降低。其原因可能为培养液中TNF-α浓度过高致骨髓单核细胞及诱导形成的破骨细胞死亡[8],也可能与高浓度超声裂解MTB冻干物直接或间接导致细胞死亡有关。
MTB感染人体后,通过激活MAKP信号传导通路促进单核细胞趋化因子、TNF-α合成及释放,从而调控巨噬细胞、淋巴细胞对炎症的反应,抑制细菌生长和诱导肉芽肿形成[9]。结核病是一种慢性疾病,MTB在肉芽肿和吞噬细胞中持续存在,MTB或其胞内蛋白很可能导致TNF-α高于正常水平;而TNF-α又能通过细胞间信号传导诱导破骨细胞形成及活化,从而导致骨质破坏。这可能是MTB感染人体引起骨关节坏死的原因之一。
[1]Global tuberculosis control:WHO report 2011:20-24.
[2]Braun T,Schett G.Pathways for bone loss in inflammatory disease[J].Current osteoporosis reports,2012,10(2):101-108.
[3]Dempsey PW,Doyle SE,He JQ,et al.The signaling adaptors and pathways activated by TNF superfamily[J].Cytokine Growth Factor Rev,2003,14(3-4):193-209.
[4]Vivareli MS,McDonald D,Miler M,et al.RIP links TLR4 to Akt and is essential for cell survival in response to LPS stimulation[J].J Exp Med,2004,200(3):399-404.
[5]Goessl C,Katz L,Dougall WC,et al.The development of denosumab for the treatment of diseases of bone loss and cancer-induced bone destruction[J].Ann N Y Acad Sci,2012,1263:29-40.
[6]Heymann D,Fortun Y,Redini F,et al.Osteolytic bone diseases:physiological analogues of bone resorption effectors as alternative therapeutic tools[J].Drug Discov Today,2005,10(4):242-247.
[7]Al-Attiyah R,El-Shazly A,Mustafa AS.Comparative analysis of spontaneous and mycobacterial antigen-induced secretion of Th1,Th2 and pro-inflammatory cytokines by peripheral blood mononuclear cells of tuberculosis patients[J].Scand J Immunol,2012,75(6):623-632.
[8]Bekker LG,Moreira AL,Bergtold A,et al.Immunopathologiceffects of tumor necrosis factor alpha in murine mycobacterial infeetion are dose dependent[J].Infect Immun,2000,68(12):6954-6961.
[9]Song CH,Lee JS,Lee SH,et al.Role of mitogen-activated protein kinase pathways in the production of tumor necrosis factor-alpha,interleukin-10,and monocyte chemotactic protein-1 by Mycobacterium tuberculosis H37Rv-infected human monocytes[J].J Clin Immun,2003,23(3):194-201.
