大豆中转基因成分的定性PCR检测
2013-09-03南京晓庄学院郭云鹂俞淑芳张凤红周红霞
南京晓庄学院 郭云鹂 俞淑芳 张凤红 周红霞*
随着转基因技术的飞速发展,转基因产品市场不断拓展,越来越多的转基因农产品商品化。转基因生物(GMO)抗逆性强、产量高、生产成本相对较低,具有较好的市场竞争性和应用前景。但转基因生物的广泛应用是否会对生态环境和人类及其他生物的健康造成不良影响,至今仍无定论(金芜军等,2004)。PCR技术手段由于其高效性而成为转基因食品的最常用检测方法。国际通用方法是以PCR技术为平台,通过特异扩增转基因调控原件花椰菜花叶病毒(CaMV35S)启动子、脂肪碱合酶 (NOS)终止子以及目的基因抗除草剂基因Cp4-EPSPS来筛选检测转基因食品 (Su等,2003)。本实验以转基因大豆为原料,采用CTAB法从中提取了基因组DNA。设计并合成引物对转基因大豆的内源基因Lectin,外源基因CaMV35S启动子、NOS终止子和Cp4 EPSPS基因进行检测,为转基因大豆及产品的检测奠定基础。
1 材料与方法
1.1 实验材料 转基因大豆,由南京农业科学院作物科学研究所提供;非转基因大豆为东北大豆。
1.2 仪器与试剂 PCR仪 (Biomera TGRADIENT)、Y04S-C型凝胶成像分析系统;CTAB缓冲液、酚、三氯甲烷、异戊醇、异丙醇、70%乙醇、TE溶液、RNA酶溶液 (购自南京天为生物科技有限公司)、异丙醇、10×PCR反应缓冲液、氯化镁 (25 mmol/L)、dNTP 溶 液 (2.5 mmol/L)、引 物(自行设计,由南京金瑞斯生物科技有限公司提供)、Taq 酶(5 U/μL)、Maker(购自宝生物工程有限公司)。
1.3 引物设计 根据 《大豆转基因成分的定性PCR检测方法(SN/T 1195-2003)》设计了转基因大豆的Lectin内标基因、CaMV35S启动子基因、NOS终止子基因、Cp4 EPSPS基因的引物序列(表1), 基因检测片段的长度分别为118、195、180 bp和320 bp(Zhang 等,2007;程红梅等,2007)。
1.4 实验方法
1.4.1 大豆DNA的提取 采用CTAB提取法,分别称取100 mg试样在液氮中充分研磨成粉状至
1.5 mL离心管中,同时设空白对照。加入600 μL CTAB缓冲液,振荡均匀,65℃温育30 min。加入500 μL 酚+三氯甲烷+异戊烷(25∶24∶1,V/V/V),振荡均匀,12000 r/min离心15 min。吸取上清液,放入另一新管中,加入等体积的异丙醇,12000 r/min离心10 min。弃去上清夜,加入70%乙醇溶液洗涤,12000 r/min离心1 min。弃去上清夜,干燥,用50 μL TE溶液溶解沉淀。加入5 μL RNA酶溶液,37℃温育30 min。加入400 μL的CTAB溶液,振荡均匀。加入 250 μL 的三氯甲烷+异戊烷(24∶1,V/V),振荡均匀,12000 r/min离心 15 min。吸取上清液,放入另一新管中,加入200 μL的异丙醇,12000 r/min离心10 min。弃去上清液,干燥,用50 μL TE溶液溶解沉淀即为大豆DNA提取液(金红等,2006)。

表1 引物序列与扩增产物长度
1.4.2 PCR反应体系及反应条件 反应体系:10×PCR Buffer 2.5 μL,25 mmol/L MgCl 22.5 μL,dNTP 2.5 mmol/L 2.0 μL,20 pmol/μL 引物 (正:0.25 μL, 反:0.25 μL),5 U/μL Taq 酶 0.125 μL,DNA模板取量为0.6 μL,所补超纯水量随DNA模板量而变化,最终补足25 μL。PCR反应条件见表2,同时设阳性对照、阴性对照、空白对照。
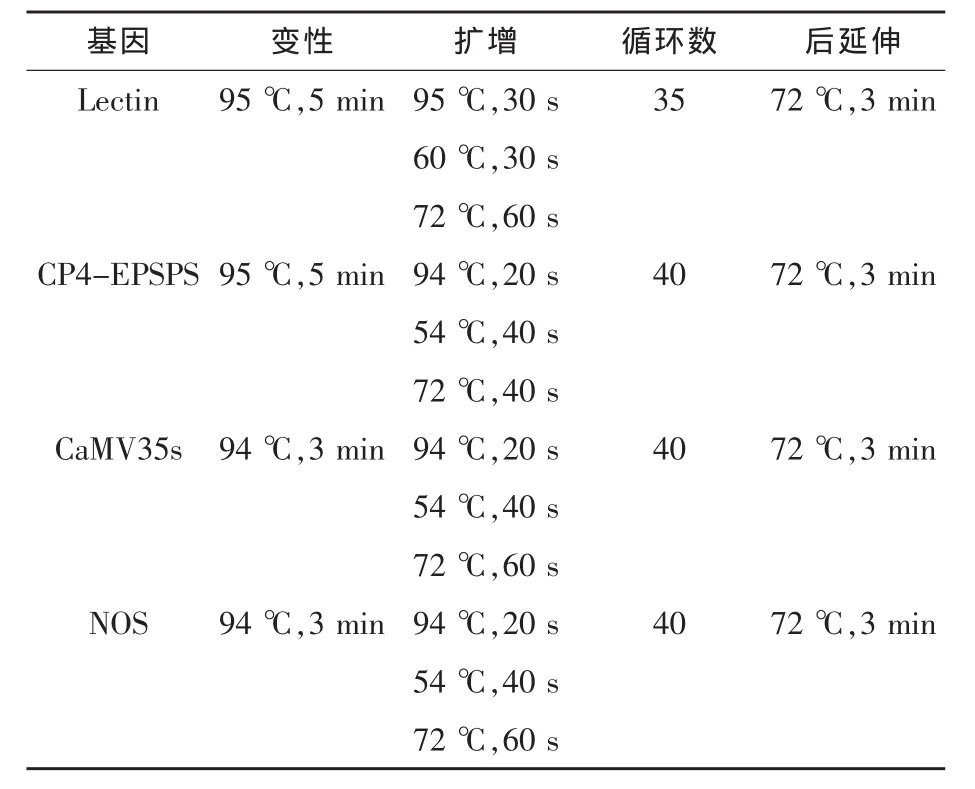
表2 PCR反应条件
1.4.3 琼脂糖凝胶电泳检测PCR产物 PCR产物在2%琼脂糖凝胶中电泳,缓冲液为1×TAE电泳缓冲液,以5 V/cm电压中电泳20 min,用凝胶成像系统观察结果。
2 结果与分析
2.1 转基因大豆的DNA电泳图 将提取的DNA进行琼脂糖凝胶电泳,结果如图1所示。由图1可知,转基因大豆和非转基因大豆均有明显条带,纯度较高,可用于 PCR 扩增(Zhang等,2007)。
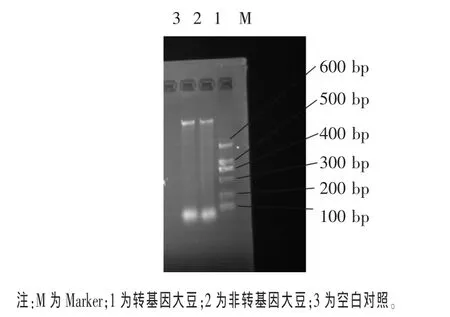
图1 转基因大豆的DNA电泳图
2.2 大豆内源基因Lectin的检测 Lectin基因是大豆所特有的内源性基因,检测内源基因可以判断所提取的DNA是否适合用于PCR扩增,同时还可以判断所提取的DNA是否含有PCR扩增抑制物,从而避免结果出现假阴性。按表2的PCR反应条件首先检测了Lectin基因,以水代替DNA模板作为空白对照。图2为大豆内源基因Lectin的检测结果。由图2可见,转基因大豆、非转基因大豆均能扩增出118 bp片段,说明所提取的DNA质量较好,可用作PCR检测模板。
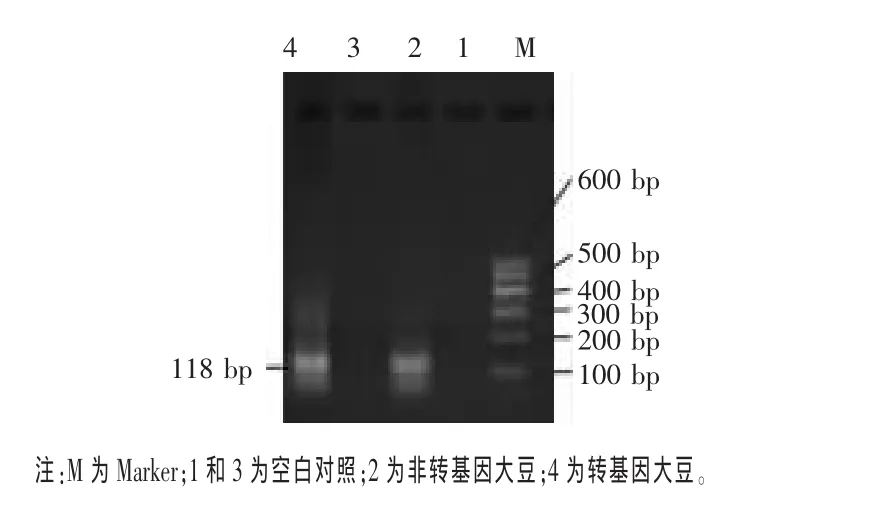
图2 内源基因Lectin的PCR扩增电泳图
2.3 大豆食用油中外源基因检测结果 外源基因的检测通常包括两方面:一是调控基因的检测;二是目的基因的检测。首先对调控基因CaMV35S启动子和NOS终止子按表2的PCR条件进行扩增检测,以水代替DNA模板作为空白对照,结果见图3和图4。从图3和图4可见,转基因大豆能扩增出 195 bp的CaMV35S启动子和180 bp的NOS终止子片段,而非转基因大豆未扩增出这两个基因(程红梅等,2007)。

图3 CaMV35S启动子基因扩增结果
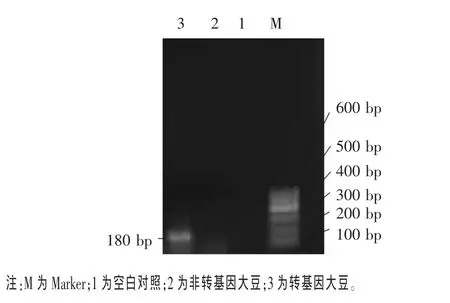
图4 NOS终止子基因扩增结果
由于CaMV35S启动子来源于花椰菜花叶病毒,NOS终止子来源于根际的农杆菌,因此若原料大豆被花椰菜花叶病毒或被根瘤脓杆菌侵染,检测就会有假阳性出现。因此,除了检测调控基因,还要检测目的基因 Cp4-EPSPS(Zhang,2007)。Cp4-EPSPS基因的检测结果见图5。由图5可见,转基因大豆所提取的DNA可以成功检测到目的基因Cp4-EPSPS 320bp片段,而非转基因大豆和空白对照均未检测出该片段。
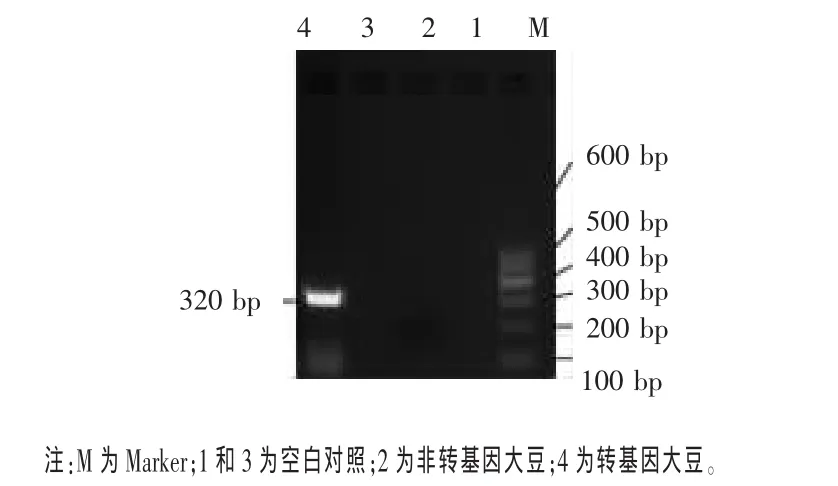
图5 转基因大豆Cp4 EPSPS基因扩增结果
3 结论
本实验建立了转基因大豆定性PCR检测体系,该方法所检测的CaMV35S启动子、NOS终止子、Cp4-EPSPS等基本覆盖了目前已商品化的转基因大豆及其深加工产品,基本满足各国家和地区转基因大豆产品的定性检测。
[1]程红梅,彭于发,金芜军,等.一种快速、简便提取大豆油DNA的方法及转基因大豆油的检测[J].中国农业科学,2007,40(5):1069 ~ 1072.
[2]金芜军,贾士荣,彭于发.不同国家和地区转基因产品标识管理政策比较[J].农业生物技术学报,2004,12(1):1 ~ 7.
[3]Su W,Song S,Long M,et al.Multiplex polymerase chain reaction/menmbrene hybridization assay for detection of genetically modified organisms[J].Journanl of Biotechnology,2003,105:227 ~ 233.
[4]Zhang M H,Gao X J,Yu Y B,et al.Detection of Roundup Ready soy in hihgly processed products by triplex nested PCR[J].Food Control,2007,18:1277~1281.
