夜香树叶甾体皂苷的体外抗肿瘤活性
2013-08-28赵世元农智新叶海洪钟振国张明艳李彩萍
赵世元, 农智新*, 叶海洪, 钟振国, 张明艳, 李彩萍
(1.广西壮族自治区民族医院,广西南宁 530001;2.广西中医学院新药开发中心,广西南宁 530001)
夜香树,又名夜来香,茄科夜香树属植物Cestrum nocturnumLinn.,前期研究发现夜香树叶中正丁醇部位具有体内外抗肿瘤作用[1-7]。为了阐明该部位抗肿瘤的物质基础,本实验对夜香树叶正丁醇部位的化学成分进行了研究,分离出3个皂苷化合物,并对3个化合物以MTT为手段进行体外抗肿瘤活性检测,根据实验结果探讨其构效关系与抗肿瘤活性之间的关系,为获取来源于植物的高效细胞毒类抗肿瘤药物提供理论依据。
1 仪器与材料
1.1 药物 夜香树叶及嫩枝采自广西南宁市郊,经广西中医学院药用植物教研室刘寿养教授鉴定为茄科属植物夜香树Cestrum nocturnumLinn.。
1.2 细胞株 人肝癌细胞BEL7404、宫颈癌细胞株HeLa、人肺癌细胞A549株,由中国科学院上海细胞生物研究所提供。
1.3 试剂 柱层析用硅胶 (100~200目)、薄层层析硅胶 (200~300目)购自青岛海洋化工厂;MTT(四甲基噻唑蓝)为德国 Sigma公司生产;FBS(胚胎牛血清)为美国 Hyclone公司产品;RPMI1640培养基为美国GIB-CO公司产品。
1.4 仪器 UV Agilent 8453紫外可见分光光度计(波长范围190~800 nm,分辨率0.1 nm。)美国安捷伦公司;IR EQUINOX 55型傅里叶变换红外光谱仪 (分辨率优于0.2 cm-1;波数范围7 500~370 cm-1),德国Bruker公司;NMR INOVA 500NB超导核磁共振谱仪,美国varian公司;MS ZAB-HS双聚焦磁质谱仪,英国VG公司;熔点测定仪,XT4—100A(控温型),北京科仪电光仪器厂。
2 方法
2.1 药物提取与分离 取干燥的夜香树叶及嫩枝2.3 kg,用乙醇浸泡24 h,加热回流提取,过滤,减压浓缩得浸膏,乙醇浸膏用硅胶拌匀后,依次用石油醚、乙酸乙酯和正丁醇回流提取,回收溶剂,得石油醚部位、乙酸乙酯部位、正丁醇部位。取正丁醇部位浸膏100 g,用硅胶拌匀后,采用硅胶柱色谱法分离,先用三氯甲烷-甲醇梯度洗脱,经薄层检识后将相同的溶液合并,到三氯甲烷-甲醇比例为20∶1,发现有结晶析出,经反复硅胶柱层析,三氯甲烷甲醇混合物液洗脱,甲醇结晶。得到3种甾体皂苷化合物。
2.2 细胞培养 取对数生长期的人肝癌细胞BEL7404,宫颈癌细胞 HeLa,人肺癌细胞 A549,用0.25%胰蛋白酶消化后,用10%胎牛血清的RPMI-1640培养液配成5 000个/mL的细胞悬液,在96孔培养板中每孔加入200 μL上述细胞悬液,置37℃,10%CO2培养箱中培养24 h后,小心地吸去上清液,实验组分别加入终质量浓度为60、30、15、7.5、3.8 μg/mL 含 10%FBS 的 RPMI-1640培养液的3种皂苷;阳性对照组加入终质量浓度为30 μg/mL的5-氟脲嘧啶含10%FBS的RPMI 1640培养液,对照组则加入200 μL的10%胎牛血清的RPMI 1640培养基的细胞悬液,每组4孔(实验重复3次)。置37℃,10%CO2培养箱培养4 d后弃去上清液,加入200 μL/孔新鲜配制的含0.2 mg/mL MTT的无血清培养液,37℃继续培养4 h,弃去上清液,加入200 μl/孔DMSO,振荡混匀后,在酶标仪上以波长为550 nm,参比波长为450 nm测定OD值,测定时减去空白对照。按下式计算药物对肿瘤细胞生长的抑制率:肿瘤细胞生长抑制率%=(1-实验组平均OD值/对照组平均OD值)×100%。
3 结果
3.1 结构鉴定
化合物1:白色针晶,63.8 mg,负离子FABMS在m/z1 209.6处可见准分子离子峰 [M-H]-,表明相对分子质量为1 209.56。IR(KBr)谱显示有羟基 (3 360 cm-1)和羰基(1 035,895>925 cm-1)吸收。1H-NMR(400.13 MHz,pyridine-d5)δ:4.9(d,J=7.5 Hz,Gal H-1),5.55(d,J=7.8 Hz,Glc-ⅠH-1),5.8(d,J=7.6 Hz,Glc-ⅡH-1),5.14(d,J=7.8 Hz,Glc-Ⅲ H-1),5.08(d,J=7.7 Hz,Glc-Xyl H-1)。13C-NMR(100.77 MHz,pyridine-d5) δ:45.73(C-1),70.66(C-2),84.57(C-3),37.61(C-4),140.08(C-5),121.90(C-6),32.12(C-7),31.61(C-8),50.20(C-9),37.95(C-10),21.20(C-11),39.80(C-12),40.47(C-13),56.52(C-14),32.12(C-15),81.10(C-16),62.85(C-17),16.85(C-18),20.45(C-19),41.99(C-20),15.01(C-21),109.26(C-22),31.84(C-23),29.28(C-24),31.12(C-25),66.80(C-26),17.32(C-27)。根据以上数据,结合相关文献[8]的比较,化合物1可确定为 spirost-5-ene-2,3-diol[2α,3β,25R]3-O-[β-D-glucopyranosyl-(1→3)-β-D-glucopyranosyl(1→2)-β-D-glucopyranosyl{(3→1)-β-D-xylopyranosyl}(1→4)-β-D-galactopyranoside(即nocturnoside A)。结构式见图1。

图1 化合物1的化学结构式Fig.1 Structure of compound 1
化合物2:白色针晶,1.85 g,阳离子 FABMS在m/z可见1 015.5520[M-H]+,869[M+H-146]+,723[M+H-(2×146)]+,577[M+H-(3×146)]+,415 [M+H-(3×146)-162]+,397[M+H-(3×146)-162-18]+,负离子 FABMS在m/z1 209.6处可见1 013.533 0[M-H]-,867[M-H-146]-,721 [M-H-(2×146)]-。IR(KBr)表明相对分子质量为1 015.6。IR(KBr)谱显示有羟基 (3 400 cm-1)和羰基 (1 440 cm-1),亚甲级伸缩振动 (2 910 cm-1)等特征信号。1H-NMR(400.13 MHz,pyridine-d5)δ:4.9(d,J=6.5 Hz,Glc H-1),5.81(d,J=2.8 Hz,Rha-Ⅲ H-1),6.26(d,J=7.6 Hz,Glc-ⅡH-1),5.14(d,J=7.8 Hz,Glc-Ⅲ H-1),5.08(d,J=3.6 Hz,Rha-I H-1);以及 6.37(d,J=3.6 Hz,Rha-II H-1)。13C-NMR(100.77 MHz,pyridine-d5)δ:37.58(C-1),29.34(C-2),77.79(C-3),39.05(C-4),140.92(C-5),121.85(C-6),32.29(C-7),31.91(C-8),50.41(C-9),37.20(C-10),21.10(C-11),39.05(C-12),40.54(C-13),57.74(C-14),31.91(C-15),81.17(C-16),62.99(C-17),16.39(C-18),19.47(C-19),42.06(C-20),15.07(C-21),109.32(C-22),31.92(C-23),29.34(C-24),30.67(C-25),66.95(C-26),17.38(C-27)。
以上数据与文献[9]资料检索比对,特别是氢谱和碳谱的数据对照分析,该化合物鉴定为spirost-5-ene-3-diol[3β,25R]3-O-[{α-L-rhamnopyranosyl-(1→4)α-L-rhamnopyranosyl-(1→2)}-α-L-rhamnopyranosyl-(1→4)]-β-D-glucopyranoside(即nocturnoside B)。结构式见图2。
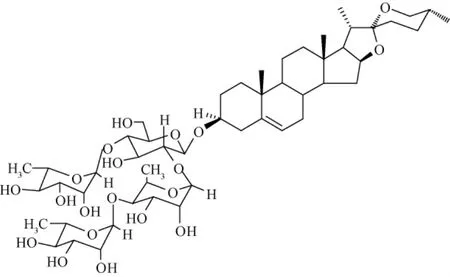
图2 化合物2的化学结构式Fig.2 Structure of compound 2
化合物3:白色针尖状,65.3 mg,mp 278~283℃。FAB-MS:m/z1 047.500[M-H],915[M-H-132],885 [M-H-162],753 [M-H-(132-162)],591 [M-H-132-(2×162)]。IR Vmaxkbr(cm-1):3 410(OH),107(OH),1 420(C==C),1 390(C==C),980,918,8 967。13C-NMR(100.61 MHz,pyridine-d5)δ:45.6(C-1),70.7(C-2),84.5(C-3),37.6(C-4),140.1(C-5),121.7(C-6),32.1(C-7),31.0(C-8),50.1(C-9),37.8(C-10),21.1(C-11),39.1(C-12),40.5(C-13),56.4(C-14),32.1(C-15),81.2(C-16),62.8(C-17),16.2(C-18),20.4(C-19),41.9(C-20),14.9(C-21),109.2(C-22),31.7(C-23),29.2(C-24),30.5(C-25),66.8(C-26),17.2(C-27)。根据以上数据,结合相关文献[10]的比较,化合物3可确定为spirost-5-ene-23-diol[2α,3β,25R]3-O-[β-D-glucopyranosyl-(1→3)-β-D-xylopyranosyl}(1→4)-β-D-galactopyranoside。
3.2 夜香树叶中3种皂苷的体外对3种肿瘤细胞的增殖抑制作用
夜香树叶3种甾体皂苷体外抗肿瘤实验结果见表1。从表1可以看出:3种化合物均可抑制BEL7404、HeLa、A549肿瘤细胞的生长,且对这3种肿瘤细胞的抑制作用呈明显的剂量和时间依赖关系,在质量浓度相同的3种化合物中,化合物2对3种肿瘤细胞生长的抑制作用较明显。
表1 夜香树叶3种化合物对人肝癌细胞BEL7404、宫颈癌细胞HeLa、人肺癌细胞A549增殖抑制作用 (±s,n=6)Tab.1 Proliferation of three compounds on human hepatoma cell BEL7404,cervical cancer cells HeLa and human lung cancer cell line A549(±s,n=6)

表1 夜香树叶3种化合物对人肝癌细胞BEL7404、宫颈癌细胞HeLa、人肺癌细胞A549增殖抑制作用 (±s,n=6)Tab.1 Proliferation of three compounds on human hepatoma cell BEL7404,cervical cancer cells HeLa and human lung cancer cell line A549(±s,n=6)
药物 质量浓度/(μg·mL-1 BEL7404细胞增殖抑制率/% HeLa细胞增殖抑制率/%A549细胞增殖抑制率/%2 18.2±4.4 7.5 12.3±3.4 23.6±5.2 40.61±5.1 48.2±5.2 8.2±2.4 42.53±5.1 15 20.6±3.6 40.2 ±5.5 58.8±6.2 67.6±6.4 20.6±3.2 60.2±5.7 30 40.3±3.5 68.3±5.7 68.6±5.4 76.3±5.7 33.2±3.5 76.5±6.5 60 65.5±6.7 80.2±6.4 78.3±6.3 90.2±9.6 52.6±6.4 86.9±7.3化合物2 3.8 8.4±2.6 16.8±4.5 22.2±5.3 23.4±4.3 6.3±1.5 21.3±4.5 7.5 15.2±3.5 33.3±4.2 43.6±4.5 53.2±4.8 10.3±2.2 45.2±3.8 15 25.8±4.3 63.3±5.8 60.3±4.5 75.2±6.8 23.1±4.3 78.2±6.8 30 56.3±4.8 83.3±7.5 71.6±4.6 80.2±7.6 40.3±5.2 82.9±7.5 60 70.2±5.2 90.3±8.9 82.6±5.3 93.2±9.6 60.5±5.2 91.2±8.4化合物3 3.8 5.3±1.7 7.5±1.4 17.2±3.5 19.6±4.8 4.1±1.4 19.5±4.2 7.5 10.2±3.5 20.5±4.8 38.1±4.2 46.5±5.2 6.8±1.6 39.5±4.2 15 18.4±3.6 38.2±4.5 56.8±5.8 64.2±6.2 18.1±3.4 57.3±5.7 30 37.8±4.5 65.3±5.6 65.5±5.4 73.8±6.3 30.8±5.2 74.1±6.5 60 62.5±5.8 78.4±7.6 75.4±5.6 86.4±6.9 48.8±4.3 83.4±7.8 5-氟尿嘧啶 30 48.2±5.1 63.2±6.5 50.2±5.4 70.2±7.3 45.4±48 h 72 h 48 h 72 h 48 h 72 h化合物1 3.8 6.3±2.1 8.1±3.6 19.4±4.3 21.6±4.2 5.3±1.)3.9 68.6±7.2
4 讨论
甾体皂苷广泛存在于动植物中,很多食物和蔬菜如燕麦、花生、大豆、扁豆、大蒜、菠菜、洋葱、芦笋、枣子和茶叶都含有相当高的甾体皂苷量,很多中药如人参、甘草、马栗树、三叶草、报春花都含有甾体皂苷。研究发现甾体皂苷有很多生理学和药理学活性,如抗肿瘤、抗炎,抗心血管系统疾病和细胞毒活性等。连接在苷元上的糖苷在生理学和药理学发挥很大的作用。据文献[11-12]报道,皂苷分子3号位上的碳原子与糖基连接方式与其抗肿瘤作用有关,糖基数量影响抗肿瘤活性的强度。含有鼠李糖结构的皂苷抗肿瘤活性比阿拉伯糖、半乳糖 (galactopyranoside)和木糖 (xylopyranosyl)强,提示皂苷元上的各种糖基可能影响该化合物对肿瘤细胞的细胞毒性作用。
本实验从夜香树叶和嫩枝的正丁醇部位中分离得3种甾体皂苷,体外实验,从MTT结果可以看出,3种皂苷对BEL7404、HeLa、A549等肿瘤细胞均有显著的增殖抑制作用,其中化合物2对肿瘤细胞的毒性最强。分析这3个化合物的结构发现,化合物2中有3个鼠李糖 (rhamnopyranosyl)和1个吡喃葡萄糖 (glucopyranoside),该化合物在夜香树叶和嫩枝的正丁醇部位的量达1.85%,可能是抗肿瘤作用的主要成分。化合物1、化合物3的量较少,在夜香树叶和嫩枝的正丁醇部位含有量小于0.5%,他们在分子结构中苷元侧链上糖基数量虽多,但没有鼠李糖基团,故抗肿瘤作用稍弱。
从中草药中寻找天然抗肿瘤活性成分是抗癌药物研究的一个重要途径和研究热点。夜香树叶甾体皂苷体外试验的结果可看到肿瘤治疗的希望,本课题组正在研究甾体皂苷的苷元和糖基的连接方式以及抗肿瘤作用的相关性,为下一步结构修辞和合成新的较强的抗肿瘤、低毒的化合物打好基础。
[1]赵世元,钟振国,廖 文,等.夜香树提取物体外抗肿瘤作用的实验研究[J].天然产物研究与开发,2008,20(1):125-128.
[2]钟振国,赵世元,吕金燕,等.夜香树提取物体体内抗肿瘤作用的实验研究[J].中药材,2008,31(11):1709-1712.
[3]钟振国,赵世元.夜香树及其提取物在抗肿瘤方面的应用:中国,1907382[P].2007-02-07.
[4]罗发军,赵世元,钟振国,等.夜香树提取物对小鼠白血病L1210细胞生长的抑制作用[J].时珍国医国药,2009,20(2):335-336.
[5]卢红梅,钟振国,赵世元,等.夜香树花提取物体外抗肿瘤作用的实验研究[J].时珍国医国药,2010,21(7):1704-1705.
[6]赵世元,农智新,叶海洪,等.夜香树叶甾体皂苷对人肝癌细胞株BEL-7404增殖抑制作用机制研究[J].中国实验方剂学杂志,2013,19(7):203-207.
[7]赵世元,黄之虎,叶海洪,夜香树花甾体皂苷诱导K562细胞凋亡机制研究[J].中成药,2013,35(3):15-17.
[8]Mimaki Y,Watanabe K,Sakagami H,et al.Steroidal glycosides from the leaves ofCestrum nocturnum[J].Proc Natl Chem Conf(Ⅱ)Karachi,1990,32(3):288-289.
[9]Ahmad V U,Baqai F T,Fatima I,et al.A Spirostanol glycosides fromCestrum nocturnum[J].Phytochemistry,1991,30(9):357-359
[10]Mimaki Y,Watanabe K,Sakagami H,et al.Steroidal glycosides from the leaves ofCestrum nocturnum[J].J Nat Prod,2002,65(12):1863-1868
[11]Wang Y,Zhang Y,Zhu Z,et al.Exploration of the correlation between the strcture,hemolytic activity,and cytotoxicity of steroid saponins[J].BioorgMedChem,2007,15(2):2528-2532.
[12]Bachran C,Sutherland M,Heisler I,et al.The saponin mediated enhanced uptake of targeted saponin-based drugs is strongly dependent on the saponin structure[J].Exp Biol Med,2006,231(3):412-420.
