葛根芩连汤配伍对黄连生物碱肠吸收特性的影响
2013-08-28张艺竹王新宏
王 跃, 安 叡, 张艺竹, 肖 娟, 陈 烨, 王新宏
(上海中医药大学,上海 201203)
葛根芩连汤出自《伤寒论·太阳病上篇》,有清泄里热、解肌散邪之功效,由葛根、黄芩、黄连、甘草四味药组成,有效成分包括黄酮、生物碱类等[1]。葛根芩连汤为口服给药,其有效成分必先经过肠道的吸收才能进入体内发挥药效。
P-糖蛋白 (p-glycoprotein,P-gp)是一种由MDR1基因编码的ATP依赖性膜转运体,其在消化道上的表达极其广泛[2],近年来的研究发现肠道P-gp蛋白是影响药物吸收及生物利用度的一个关键因素[3],也是目前研究最多的肠道外排蛋白。葛根芩连汤中的有效成分小檗碱及其衍生物是P-gp的底物[4-5],其口服生物利用度低的原因是P-gp的外排作用[6-7]。
本课题组的前期药代动力学研究结果发现,葛根芩连汤中君药葛根能促进黄连中生物碱成分的吸收。故本研究采用目前常用于研究药物吸收机制的模型——大鼠肠外翻生物模型,从肠道转运体P-gp的角度研究葛根芩连汤中黄连有效成分在不同配伍环境中的吸收动力学变化,希冀为探索葛根芩连汤的配伍机制提供科学依据。
1 实验材料
1.1 实验仪器 Waters AcquityTM H-Class超高效液相色谱仪 (PDA Detecter,Sample Manager-FTN,Quaternary Solvent Manager),Empower2色谱工作站。
1.2 动物 SD大鼠,雄性,体质量 (200±20)g,由上海中医药大学实验动物中心提供,合格证号:SCXK(沪)2008-0016。
1.3 药品及试剂 葛根Puerariae lobatae Radix、黄芩Scutellariae Radix、黄连Coptidis Rhizoma购于上海康桥中药饮片有限公司,炙甘草Glycyrrhizae Radix et Rhizoma praeparata cum melle购于上海金桥养和堂药店;上述药材经陈燕军药师鉴定,符合2010版《中国药典》一部规定。盐酸黄连碱(coptisine,批号:201011)购于上海经科化学科技有限公司;盐酸药根碱 (jatrorrhizine,批号:110733-201007)、盐酸小檗碱 (berberine,批号:110713-200911)、盐酸巴马汀 (palmatine,批号:110732-200907)、盐酸维拉帕米 (verapamil,批号:100223-200102)均购于中国药品生物制品检定所 (现为中国食品药品检定研究院)。甲醇为色谱纯,水为超纯水,其余试剂均为分析纯。
2 实验方法
2.1 Tyrode缓冲液的配置 分别称取NaCl 8.0 g,KCl 0.2 g,CaCl20.2 g,NaHCO31.0 g,NaH2PO40.05 g,MgCl20.1 g,葡萄糖 1.0 g,超纯水定容到1 L,调节至pH 7.2~7.4。
2.2 标准品溶液的配置 精密称取盐酸黄连碱、盐酸药根碱、盐酸小檗碱、盐酸巴马汀对照品适量,用甲醇配制成质量浓度分别为21.55、23.30、22.25、20.55 μg/mL的混合对照品贮备液 (以黄连碱、药根碱、小檗碱、巴马汀计)。取盐酸维拉帕米适量,精密称定,用超纯水定容至10 mL,得3.96 mg/mL贮备液备用 (以维拉帕米计)。
2.3 肠外翻溶液的配置 葛根芩连汤全方由葛根15 g、黄芩9 g、黄连9 g、炙甘草6 g组成,按照全方各药的比例确定各组药物之间的比例称取适量黄连、黄连-葛根 (黄连葛根质量比为3∶5)、黄连-黄芩 (黄连黄芩质量比为1∶1)、黄连-甘草(黄连甘草质量比为3∶2),分别加8倍量水,煎煮30 min,过滤;再加8倍量水,煎煮30 min,过滤,合并两次滤液,浓缩定容。取各提取液,用Tyrode缓冲液稀释成黄连提取液、含100 μmol/L维拉帕米的黄连提取液、黄连-葛根提取液、黄连-黄芩提取液、黄连-甘草提取液,各组黄连生药质量浓度均为5 mg/mL,冷藏备用。
2.4 动物手术 SD大鼠,实验前禁食12 h,自由饮水。腹腔注射20%乌拉坦 (0.4 mL/100 g)麻醉,腹主动脉取血后,将大鼠肠管同肠系膜剥离,分别取十二指肠 (从幽门以下约10 cm)、空肠(十二指肠回肠中间肠段)、回肠 (从盲肠向上大约10 cm)、结肠 (盲肠向下)各7 cm,放入4℃Tyrode液中,将内容物冲洗干净,然后小心剥离肠段表面的肠系膜和脂肪,将肠管翻转,用Tyrode液冲洗后,肠管一端结扎塑料套管,另一端结扎,使之形成囊状肠管。注入1 mL空白Tyrode液到肠囊内,放入已有Tyrode液的麦氏浴槽中,实验过程中保持37℃恒温循环水,并向浴槽中通入95%O2/5%CO2,平衡5 min。
2.5 肠外翻实验 将平衡好的麦氏浴槽中的Tyrode液倒出,分别给予配置好的肠外翻溶液,分别在给药15,30,45,60,90,120 min从肠囊内取样200 μL,同时补足相同体积的空白Tyrode液。
2.6 样品处理 取肠外翻实验样品200 μL,定量加入甲醇400 μL,涡旋混匀,14 000×g离心5 min,取上清液过微孔滤膜进样分析。
2.7 肠外翻样品中生物碱类成分的测定 ①色谱条件:Agilent Poroshell 120EC-C18色谱柱 (4.6 mm×50 mm,2.7-Micron);流动相0.2%乙酸水溶液 (A)-甲醇 (B),梯度洗脱 (0~10 min,25% ~35%,B);体积流量1 mL/min;柱温25℃;检测波长345 nm;进样量5 μL。②标准曲线制备:精密吸取混合对照品贮备液10.00、5.00、2.50、1.00、0.50 mL,分别置于50mL量瓶中,用空白Tyrode溶液稀释至刻度,摇匀,取上述不同质量浓度的混合对照品溶液在上述色谱条件下进样分析,以各成分质量浓度为横坐标,峰面积为纵坐标,进行回归计算。③精密度实验:取已知质量浓度的混合对照品溶液,在确定色谱条件下连续进样6次,考察日内和日间精密度。④专属性实验:在确定的色谱条件下,将混合对照品溶液和含药的Tyrode液分别进样检测,考察方法的专属性。⑤稳定性实验:取肠外翻供试品,置于37℃水浴中,分别在0、2、4、8、12、24 h进样检测,考察样品稳定性。⑥加样回收率实验:取已知量的供试品9份,分别精密加入对照品溶液适量,按样品处理方法制备溶液,在上述色谱条件下进样分析,计算平均加样回收率。
3 数据分析
药物累计吸收量按以下公式计算:
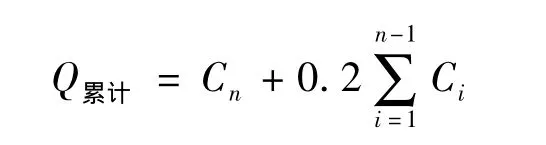
Q累计为药物各时间的累积吸收量,Cn为n时间点的实际检测浓度。
对药物的累积吸收量对时间作相关回归分析,得出的斜率 (L)除以吸收表面积 (A)求得吸收速率常数 (Ka,μg·min-1·cm-2),公式如下。
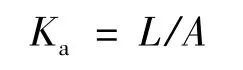
4 结果
4.1 药物浓度的测定 比较Tyrode液、混合对照品溶液、供试品溶液的色谱行为,结果表明在确定色谱条件下,各组分色谱峰处Tyrode液中物质和样品中其他成分对待测组分没有干扰,且各组分的峰形较好,能够完全分离 (图1)。求得标准曲线见表1,结果可见黄连各生物碱成分在考察质量浓度范围内线性良好。本方法测定的各成分日间和日内精密度RSD均小于1%。稳定性实验RSD小于2%。加样回收率在98.3% ~100.4%之间,RSD小于2%(n=5)。
4.2 P-gp抑制剂对生物碱吸收的影响 取含有和不含维拉帕米的黄连提取液进行实验,考察P-gp对生物碱的影响。结果显示 (表2),在各肠段,各生物碱的Ka值均有显著性提高 (P<0.05),说明药根碱、黄连碱、小檗碱、巴马汀均为P-gp的底物。
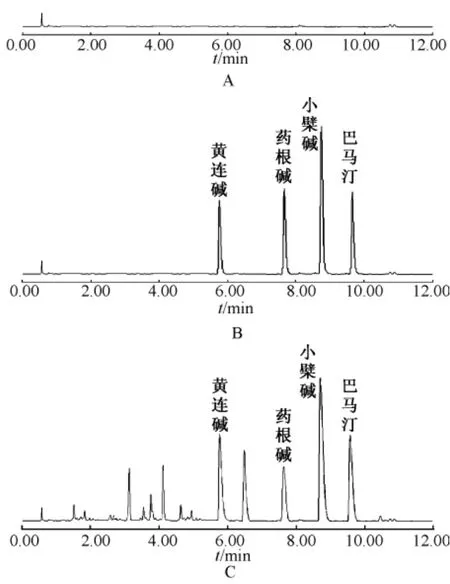
图1 空白tyrode液 (A)、标准品溶液 (B)和样品 (C)的UPLC色谱图Fig.1 UPLC chromatograms of blank tyrode(A),blank tyrode spiked with standard compounds(B)and samples(C)
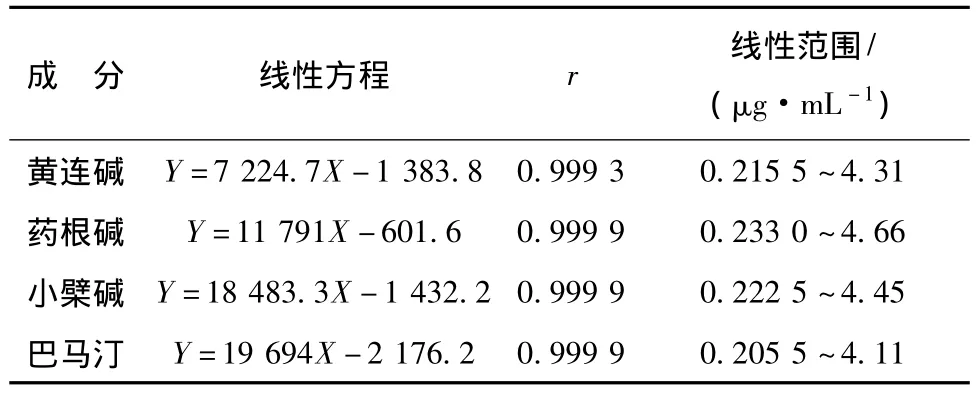
表1 线性关系结果Tab.1 Result of linearity correlations
4.3 各配伍组对生物碱吸收的影响 各配伍组吸收常数Ka值如表3所示。配伍葛根后,在十二指肠、空肠段各生物碱比黄连组均有明显的提高,其中小檗碱和巴马汀的P<0.01,同时在回肠段药根碱的吸收也有增加。在黄芩的作用下,在回肠和结肠段黄连碱、小檗碱和巴马汀均有显著提高,其中在回肠段小檗碱和巴马汀、结肠段巴马汀的P<0.01;在十二指肠段药根碱和巴马汀、空肠段巴马汀的吸收也有提高。在甘草的作用下,仅仅在十二指肠段巴马汀、回肠段药根碱的吸收有所提高(以上P<0.05)。
表2 维拉帕米对4种生物碱的肠吸收参数Ka值的影响[μg/(min·cm2),n=5,±s]Tab.2 Effect of verapamil on Kaof coptisine,jatrorrhizine,berberine and palmatine[μg/(min·cm2),n=5,±s]

表2 维拉帕米对4种生物碱的肠吸收参数Ka值的影响[μg/(min·cm2),n=5,±s]Tab.2 Effect of verapamil on Kaof coptisine,jatrorrhizine,berberine and palmatine[μg/(min·cm2),n=5,±s]
注:与黄连组比较,*P <0.05,**P <0.01。
肠段 组别 黄连碱 药根碱 小檗碱 巴马汀十二指肠 黄连组 0.993±0.033 0.307±0.009 0.975±0.100 0.430±0.021黄连维拉帕米组 3.017±0.172** 1.320±0.065** 4.160±0.253** 1.480±0.054**空肠 黄连组 1.567±0.074 0.623±0.052 1.854±0.222 0.867±0.024黄连维拉帕米组 2.427±0.108* 1.110±0.064* 2.942±0.322** 1.200±0.070*回肠 黄连组 0.997±0.012 0.243±0.025 0.752±0.107 0.453±0.021黄连维拉帕米组 2.883±0.155** 1.227±0.070** 3.552±0.465** 1.367±0.069**结肠 黄连组 1.113±0.050 0.553±0.037 1.244±0.042 0.677±0.012黄连维拉帕米组 2.547±0.144** 0.970±0.051* 2.680±0.362** 1.050±0.036**
5 讨论
肠外翻模型操作简单、快捷、廉价,技术要求低,保持相对完整的组织和黏膜特性,给出的数据可靠且与体内吸收情况比较相似,肠外翻模型是用来研究药物吸收机制最为常用的模型之一[8]。
在维拉帕米的作用下,黄连提取物中的黄连碱、药根碱、小檗碱、巴马汀在各个肠段的吸收有了明显提高,说明黄连碱、药根碱、小檗碱、巴马汀是P-gp的底物,这与文献报道一致[9]。
如表2所示,在十二指肠、空肠,葛根提取物也起到类似P-gp抑制剂的作用,使得各生物碱的吸收有了大幅度的提高,这与本课题组前期实验结果吻合[10];在回肠和结肠,黄芩提取物使得黄连碱、小檗碱、巴马汀的吸收有了明显提高,但提高的程度没有葛根明显,这确定了葛根的君药地位。另有文献报道黄芩苷是多耐药相关蛋白2(Mrp2)的底物[11],也可以起到竞争性抑制作用;由于肠道上除了有P-gp外排蛋白,还有Mrp2外排蛋白、有机阴离子转运摄取蛋白、溶质转运摄取蛋白等,出现这种现象可能是各种转运蛋白一起共同作用的结果,现在对它们的研究比较少,有待进一步进行研究。甘草在各肠段对黄连成分吸收促进均无明显作用,甚至有减弱的趋势。葛根为方中的君药,起到最主要的作用,能大幅提高黄连中的有效成分小檗碱及其衍生物的吸收;黄芩为臣药,辅佐君药,进一步增加小檗碱及其衍生物的吸收;甘草为使药,起到调和诸药的作用,使其保持在安全的质量浓度范围。小檗碱及其衍生物是有效成分,具有广谱的抗菌作用,能用来治疗糖尿病,高血脂等[12-13],同时也是毒性成分[14],所以保证其在体内的浓度在安全的范围内显得尤为重要。根据中医理论,方中以葛根为主药,具有解肌透表的作用,黄芩、黄连苦寒,清除里热,甘草和中安正,解热毒。诸药合用共奏解表清里之功,临床常用用于消化系统、心血管系统疾病,对糖尿病也有很好的效果[15]。各药协同作用,使方中的有效成分生物碱保持在合适的范围内,发挥抗菌、降胆固醇及改善葡萄糖耐量的药理活性作用,辅助全方发挥治疗作用。通过观察不同配伍组的实验结果,初步尝试从药物转运蛋白的角度来解释复方配伍的合理性。
表3 4种生物碱在各配伍组各肠段中的Ka值[μg/(min·cm2),n=5,±s]Tab.3 Kaof coptisine,jatrorrhizine,berberine and palmatine in different groups[μg/(min·cm2),n=5,±s]

表3 4种生物碱在各配伍组各肠段中的Ka值[μg/(min·cm2),n=5,±s]Tab.3 Kaof coptisine,jatrorrhizine,berberine and palmatine in different groups[μg/(min·cm2),n=5,±s]
注:与黄连组比较,*P <0.05,**P <0.01。
肠 段 组 别 黄连碱 药根碱 小檗碱 巴马汀十二指肠 黄连组 0.993±0.033 0.307±0.009 0.975±0.100 0.430±0.021黄连葛根组 1.453±0.058* 0.573±0.041* 1.644±0.196** 1.320±0.057**黄连黄芩组 1.047±0.017 0.527±0.012* 1.088±0.134 0.737±0.005*黄连甘草组 1.297±0.033 0.367±0.019 1.172±0.119 0.953±0.042*空肠 黄连组 1.567±0.074 0.623±0.052 1.854±0.222 0.867±0.024黄连葛根组 2.480±0.123* 0.730±0.033* 2.888±0.399** 2.480±0.062**黄连黄芩组 1.537±0.066 0.603±0.026 1.406±0.174 1.283±0.066*黄连甘草组 1.053±0.033 0.523±0.037 1.062±0.136 0.770±0.014回肠 黄连组 0.997±0.012 0.243±0.025 0.752±0.107 0.453±0.021黄连葛根组 1.043±0.054 0.473±0.034* 0.926±0.148 0.463±0.012黄连黄芩组 1.320±0.024* 0.293±0.012 1.500±0.175** 1.440±0.033**黄连甘草组 1.087±0.017 0.405±0.039* 0.972±0.184 0.687±0.021结肠 黄连组 1.113±0.050 0.553±0.037 1.244±0.042 0.677±0.012黄连葛根组 0.913±0.029 0.587±0.021 1.104±0.119 0.890±0.094黄连黄芩组 1.563±0.085* 0.540±0.029 1.534±0.184* 1.063±0.025**黄连甘草组 1.327±0.066 0.353±0.025 0.908±0.060 0.563±0.021
肠外翻模型得到的数据与体内吸收最为相似,保持了比较完整的组织和黏膜特性,但是具有同体内一样的复杂情况,导致数据的解读难度大。
Caco-2细胞来源于人的直肠癌细胞,结构和功能类似于人小肠上皮细胞,并含有与小肠刷状缘上皮相关的酶系,细胞亚显微结构研究表明,Caco-2细胞与人小肠上皮细胞在形态学上相似,具有相同的细胞极性和紧密连接。且Caco-2细胞能特异性的过量表达P-gp外排蛋白,因此,本课题组将采用Caco-2细胞模型进行进一步的研究。
[1]陈丽红,唐于平,王 强.葛根芩连汤的现代研究进展[J].中草药,2010,41(4):676-680.
[2]刘志浩,刘克辛.肠道药物转运体及其研究方法[J].药学学报,2011,46(4):370-376.
[3]Wagner D,Spahn-Langguth H,Hanafy A,et al.Intestinal drug efflux:formulation and food effects[J].Adv Drug Deliv Rev,2001,50(Suppl 1):S13-31.
[4]Maeng H J,Yoo H J,Kim I W,et al.P-glycoprotein-mediated transport of berberine across Caco-2 cell monolayers[J].J Pharm Sci,2002,91(12):2614-2621.
[5]吴安国,曾 宝,王春玲,等.HPLC考察小檗碱和黄连提取物中小檗碱在Caco-2细胞模型的转运[J].中国药理学通报,2011,27(7):1007-1011.
[6]Yang H T,Wang G J.Transport and uptake characteristics of a new derivative of berberine(CPU-86017)by human intestinal epithelial cell line:Caco-2[J].Acta Pharm Sin,2003,24(12):1185-1191.
[7]张新峰,裘福荣,蒋 健,等.LC-MS/MS测定药根碱、巴马汀和小檗碱在Caco-2细胞的摄取特性[J].中国药学杂志,2010,45(19):1504-1508.
[8]Barthe L,Woodley J,Houin G.Gastrointestinal absorption of drugs:methods and studies[J].Fundam Clin Pharmacol,1999,13(2):154-168.
[9]张新峰,裘福荣,蒋 健,等.左金丸类方的小檗碱、巴马汀、黄连碱和药根碱在Caco-2细胞转运的比较研究[J].中华中医药杂志,2011,26(5):999-1003.
[10]张 华,安 叡,徐冉驰,等.葛根芩连汤及不同配伍组中生物碱类成分的肠外翻吸收研究[J].中成药,2012,34(4):620-625.
[11]Akao T,Hanada M,Sakashita Y,et al.Efflux of baicalin,a flavone glucuronide ofScutellariae Radix,on Caco-2 cells through multidrug resistance-associated protein 2[J].J PharmPharmacol,2007,59(1):87-93.
[12]Zhang H,Wei J,Xue R,et al.Berberine lowers blood glucose in type 2 diabetes mellitus patients through increasing insulin receptor expression[J].Metabolism,2010,59(2):285-292.
[13]Holy E W,Akhmedov A,Luscher T F,et al.Berberine,a natural lipid-lowering drug,exerts prothrombotic effects on vascular cells[J].J Mol Cell Cardiol,2009,46(2):234-240.
[14]谭正怀,张 媛,程 蕾,等.小檗碱、巴马亭及黄连总生物碱对胆碱能神经的作用[J].中药药理与临床,2006,22(06):20-22.
[15]陈宪海,刘 伟.葛根芩连汤[M].北京:中国医药科技出版社,2009.
