玉山黑猪H-FABP基因的遗传多态性和表达研究
2013-08-27周泉勇万明春霍俊宏唐艳强黄江南
周泉勇,万明春,杨 群,霍俊宏,唐艳强,黄江南
(江西省农业科学院 畜牧兽医研究所,江西 南昌 330200)
随着人们生活水平不断提高,居民的生活方式和消费观念逐步发生变化,消费者对猪肉产品的需求向高档、特色、风味等方向发展,对猪肉的品质要求也越来越高,生产和消费优质猪肉逐渐成为主流。肌内脂肪,即沉积在肌肉内的脂肪,其含量与猪肉的嫩度和风味直接相关,是猪肉品质的重要性状之一。研究显示,猪IMF含量的下降是造成猪肉质量下降的主要原因之一[1],2% ~3%的肌内脂肪含量就可产生理想的口感,但长期的高瘦肉率选择已使现有商品猪的肌内脂肪含量下降到1% ~1.5%,导致肉品质量逐渐不能满足当前消费者的需求。如何在保证瘦肉率的情况下,提高猪肌内脂肪的含量,满足当前市场中消费者的需求,已成为育种者的新目标之一。
心脏脂肪酸结合蛋白(heart fatty acid binding protein,H-FABP)是现已发现的影响猪肌内脂肪含量的候选基因之一[2]。其定位于6号染色体SW376-S0003区间内,与6号染色体上影响肉质的QTL紧邻,编码一个大小为15 KDa的包浆蛋白。H-FABP在细胞内与脂肪酸结合,使细胞内外保持一定的浓度差,促使细胞摄取脂肪酸。Gerbens等最早发现并报道该基因具有3个多态性位点,其中HaeIII位点位于5’UTR,HinfI和MspI位点位于第2内含子,HaeIII有D和d等位基因,HinfI则有H和h等位基因,MspI酶切位点有A和a等位基因。进一步的关联分析发现,aaddHH基因型比AADDhh基因型猪的肌内脂肪含量高0.4%,且差异显著[3]。近年来,国内对该基因的研究报道也逐渐多起来。李长龙,曲亮,彭淑红等分别对松辽黑猪,撒坝猪,金华猪等多个地方品种进行了该基因的多态性研究[4-6]。
与当前市场中的杜、长、大等外来品种猪相比,我国地方猪品种肉质均较优,这与肌内脂肪含量有直接关系,其含量远高于外来品种,均达3%以上[7]。而以优良肉质闻名中外的玉山黑猪更是其中翘首,其含量甚至高达 7.41%[8]。
本研究以玉山黑猪为研究对象,利用PCR-RFLP技术调查了H-FABP基因的5’-UTR和内含子2中遗传突变位点在玉山黑猪和外来猪种中的基因型分布情况,并利用Real-time-PCR技术对该基因在外来猪种和玉山黑猪骨骼肌组织中的表达进行了比较研究,以期为玉山黑猪的保种及利用提供一定的科学依据。
1 材料与方法
1.1 实验材料
实验材料分别采自江西省农业科学院畜牧兽医研究所实验猪场和江西省玉山黑猪原种场。用于遗传多样性分析的样本为玉山黑猪耳组织32份,长白猪耳组织20份,大白猪耳组织20份,杜洛克猪耳组织19份。耳号钳取耳组织后放入装有75%乙醇的Eppendorf管中保存于-20℃冰箱。用于基因表达分析的样本为3头成年大白猪和3头成年玉山黑猪的心、肝、脾、肺、肾、脂肪和骨骼肌组织。屠宰取样后迅速置于液氮中,-80℃冰箱保存。
1.2 组织DNA和RNA的提取
DNA的提取采用酚-氯仿法,总RNA的提取采用天根生化科技(北京)有限公司的动物组织总RNA提取试剂盒(DP431),具体操作步骤详见试剂盒说明书。提取的RNA用Thermo scientific公司的NanoDrop 2000核酸蛋白测定仪测定总RNA浓度。
1.3 表达检测样本的制备
在DEPC处理过的无 RNase污染的的0.2 mL的离心管中加入2 μg的总 RNA,0.4 μg的 oligo(dT)引物和0.1 μg的随机引物,70℃温育5 min,迅速置于冰上,然后一次加入10 μL 5×反转录缓冲液,2.5 μL 10 mmol/L dNTP mix,1 μL RNase inhibitor和 1.5 μL M - MLV 反转录酶(200 U/μL),用无核酸水将终体积补至50 μL,混匀离心后于37℃温育10 min,42℃温育50 min,最后85℃温育5 min以灭活反转录酶。反转录后的cDNA于-20℃ 保存备用。
1.4 引物设计
根据Gerbens等发表的序列,应用Primer Premier5.0软件分别设计酶切引物和定量检测引物。合成由上海生工生物工程技术服务有限公司完成。引物序列、PCR产物的大小、Tm值见表1。
1.5 PCR -RFLP
PCR 扩增反应体系为 25 μL:基因组 DNA 1 μL(约 50 ng),引物(10 umol/L)各 1 μL,dNTPs(10 mmol/L)2 μL,10 × PCR Buffer 2.5 μL,Taq 酶(5 U/μL)0.2 μL,灭菌水 17.3 μL。PCR 扩增程序:95℃预变性5 min,94℃变性40 s,适宜退火温度40 s,72℃延伸30 s,36个循环,最后72℃延伸10 min。PCR扩增产物经2%琼脂糖电泳检测合格后,用于酶切。酶切体系为10 μL:扩增模板3 μL,内切酶(10 U/μL)1.5 μL,灭菌水5.5 μL。适宜温度酶切过夜后经2%琼脂糖电泳检测,用于分型。

表1 H-FABP基因PCR引物序列及片段大小Tab.1 The primer sequences and product size for H -FABP PCR
1.6 Real-time PCR
反应体系为 20 μL,其中 cDNA 各 0.8 μL,SYBR green I Mix 10 μL,正反向引物各 0.4 μmol/L,剩余用灭菌纯净水补足。样品在96孔板混合均匀后直接放入ABI 7 300实时定量PCR仪上进行扩增反应,反应程序为95 ℃ 10 s,1 个循环,95 ℃15 s,60 ℃30 s,40 个循环,95 ℃15 s,60 ℃30 s,95 ℃15 s,60℃1 min,1个循环。检测基因与内参基因同时扩增,表达的相对量以目标基因与内参基因Ct值(取3个重复的平均值)的差值ΔCt计算,再选取ΔCt最大作为参照,用其它样品的ΔCt减去参照ΔCt得到ΔΔCt,Ct值大于35的视为无效数据。
2 结果与分析
2.1 PCR产物的酶切结果
扩增H-FABP基因HaeIII多态位点所在序列的PCR产物长度为583 bp。HaeIII酶切后,酶切的片段为583 bp时,定义为D,酶切的片段为(212+371)bp时,定义为d(图1)。

图1 H-FABP基因HaeIII多态位点酶切图。Fig.1 The digested map of HaeIII polymorphic site of H -FABP

图2 H-FABP基因HinfI多态位点酶切图。Fig.2 The digested map of HinfI polymorphic site of H -FABP

表2 H-FABP基因多态位点基因型分布和基因频率Tab.2 Genotype and allele frequencies of the H -FABP gene polymorphism size
扩增H-FABP基因HinfI多态位点所在序列的PCR产物长度为291 bp。HinfI酶切后,酶切的片段为(172+119)bp时定义为h,酶切的片段为(114+59+119)bp时定义为H(图2)。
2.2 不同猪种H-FABP基因的PCR-RFLP基因型及基因频率
利用PCR-RFLP方法,检测了H-FABP基因HaeIII和HinfI位点在玉山黑猪、长白、大白和杜洛克猪中的基因型分布和基因频率,统计结果见表2。
2.3 H-FABP基因组织表达谱
以β-aCtLin为内参,利用Real-time PCR方法检测H-FABP基因在心、肝、脾、肺、肾、脂肪和骨骼肌组织中的表达情况,发现H-FABP基因主要在心、肾、脂肪和骨骼肌组织中表达,并在心和骨骼肌组织中的表达量最高(图3)。
2.4 玉山黑猪和大白猪中H-FABP基因差异表达情况
以β-aCtLin为内参,检测H-FABP基因在玉山黑猪和大白猪心、肾、脂肪和骨骼肌组织中的表达差异情况,发现玉山黑猪在心和骨骼肌组织中H-FABP基因的表达均高于大白猪,差异倍数分别为3.34和3.42,且差异显著,在肾和脂肪组织中的表达与大白猪不存在显著性的差异(图4)。
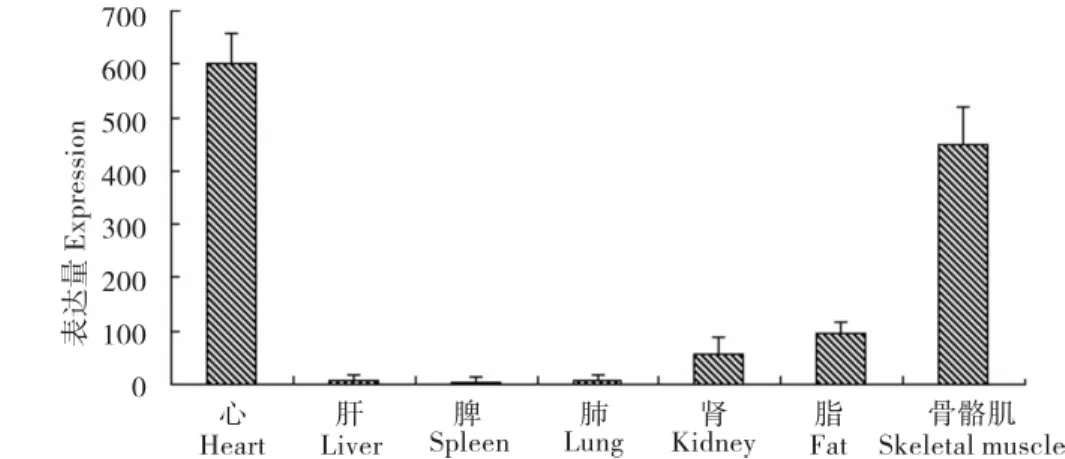
图3 H-FABP基因在玉山黑猪成年个体组织表达图。Fig.3 the expression of H -FABP gene in different tissues of Yushanhei pigs.

图4 H-FABP基因在玉山黑猪和大白猪组织中表达差异图。Fig.4 The expression levels of H -FABP gene in Yushanhei pigs and Yorkshire different tissues.
3 结论与讨论
H-FABP基因在不同猪种中的多态性研究表明,HaeIII和HinfI位点在外来品种中存在丰富的多态性,而在国内地方品种中多表现为单态或以某一等位基因为主。变异在中外猪种中分布极不均衡。HinfI位点的等位基因H为肌内脂肪含量的有利等位基因。研究表明,HH型肌内脂肪含量比 hh型高0.4%[1]。对含有较高的肌内脂肪并以肉质鲜美著称的国内地方猪种如金华猪、撒坝猪等进行检测,发现其均具有较高频率的等位基因H,分别为0.66和0.60。在本试验中,H基因在玉山黑猪中的频率更高,达到了0.98,这也与玉山黑猪高达7.41%的肌内脂肪含量(金华猪为3.95%)相符合[9]。HaeIII位点在国内地方猪种中主要以D等位基因为主,在苏淮猪和金华猪中,D等位基因分别为0.73和1[6,10]。本试验中,同样检测发现玉山黑猪均表现为D型单一等位基因,与国内其它地方品种检测结果一致,说明在玉山黑猪中HaeIII位点同样不能提供肌内脂肪的有效遗传标记。
利用Real-time PCR方法,本试验进一步检测发现H-FABP基因主要在心、肾、脂肪和骨骼肌组织中表达,且心肌组织中的表达量高于骨骼肌。这一结果与雅南猪中的检测结果一致[11],与黄河等人对藏猪H-FABP基因在脂肪中的表达最高不一致[12],推测可能与不同地域的猪品种有关。H-FABP是影响猪肌内脂肪含量的候选基因之一[2],在细胞内与脂肪酸结合,使细胞内外保持一定的浓度差,促使细胞摄取脂肪酸。Gerbens等研究显示,H-FABP基因在mRNA水平上与肌内脂肪含量显著相关。与外来品种长白、大白、杜洛克等相比较,玉山黑猪的肌内脂肪明显较高。在本试验的检测结果中,玉山黑猪在心和骨骼肌组织中H-FABP基因的表达量显著高于大白猪,差异倍数分别为3.34和3.42。这也进一步证明了高表达的H-FABP基因有利于猪肌内脂肪的沉积。
[1]Gerbens F,Verburg F J,Van Moerkerk H T,et al.Associations of heart and adipocyte fatty acid - binding protein gene expression with intramuscu Lar fat content in pigs[J].J Anim Sci,2001,79(2):347 -354.
[2]Urban T,Mikolásová R,Kuciel J,et al.A study of associations of the H - FABP genotypes with fat and meat produCtLion of pigs[J].J Appl Genet,2002,43(4):505 - 509.
[3]Gerbens F,Rettenberger G,Lenstra JA,et al.Characterization,chromosomal localization,and genetic variation of the porcine heart fatty acid - binding protein gene[J].Mamm Genome,1997,8(5):328 -332.
[4]高妍,肖书奇,李毅,等.松辽黑猪H-FABP基因位点多态性研究[J].中国畜牧兽医,2007,34(3):63-66.
[5]李国治,连林生,鲁绍雄,等.云南撒坝猪H-FABP基因多态性及与部分生产性能的关系[J].家畜生态学报,2008,29(6):13-16.
[6]林万华,黄路生,任军,等.H-FABP基因型对二花脸猪相关性状影响的初步分析[J].遗传学报,2002,29(1):12-15.
[7]陈效华.猪育种的理论与实践[M].北京:农业出版社,1990:32-35.
[8]邹志恒,谢金防,韦启鹏,等.玉山黑猪肉质特性研究[J].猪业科学,2009,12:92 -95.
[9]徐继初.中国金华猪[M].上海:上海科学技术出版社,1995:18-19.
[10]彭淑红,徐宁迎,章胜乔.金华猪H-FABP基因位点多态性研究[J].江苏农业科学,2003,54(3):54-55.
[11]罗献梅,陈代文,张克英.不同品种猪肌肉组织心型脂肪酸结合蛋白基因的表达差异[J].畜牧兽医学报,2006,37(7):727-730.
[12]黄河,帅素容,余先琼,等.藏猪心脏脂肪酸结合蛋白基因(H-FABP)组织表达差异性研究[J].四川农业大学学报,2007,25(4):480 -483.
