镉在北京褐潮土中对玉米幼苗及其根际微生物的毒性效应
2013-08-20贺萌萌徐猛杜艳丽颜增光王林权周友亚郭观林侯红李发生
贺萌萌,徐猛,杜艳丽,颜增光,* ,王林权,周友亚,郭观林,侯红,李发生
1.西北农林科技大学资源环境学院,杨凌712100
2.中国环境科学研究院环境基准与风险评估国家重点实验室,北京100012
3.北京农学院植物科学技术学院,北京102206
土壤重金属污染是近年来国内外普遍关注的环境问题,最受瞩目的污染物包括汞(Hg)、镉(Cd)、铅(Pb)、铬(Cr)和类金属砷(As)等,其中镉因其移动性强、毒性大、污染范围广、检出频率高而被美国有毒物质与疾病登记署列为超级基金场地优先污染物(Priority List of Hazardous Substances)中的第7大有害物质(http://www.atsdr.cdc.gov/SPL/index.html)。土壤中镉的来源除母质母岩风化、火山喷发等自然源释放外,与人类活动相关的污染源主要有大气沉降、工业(如电池生产)废物排放、矿山资源开发、交通污染以及污泥和化肥(尤其是磷肥)应用等[1]。镉进入土壤后,可通过溶解、沉淀、凝聚、络合、吸附和解吸等行为与土壤组分发生相互作用[2],并可通过植物根系吸收在植物体内发生积累,达到一定程度时会对植物产生一系列的毒害效应,如引起水分和养分失衡、激素失调、气孔导度下降和气体交换能力减弱、蒸腾和光合作用降低、细胞膜发生脂质过氧化损伤、相关酶系(如ATP酶)和色素(如叶绿素)的生物合成与生理功能受损、氮固定与碳同化能力下降等,从而导致植物生长迟缓、叶片失绿、坏死或卷叶、植物根系受损、植株矮化和生物量下降,严重时甚至可导致全株死亡[3-5]。此外,土壤中的镉还可以通过孔隙水接触暴露等途径,对土壤动物(如蚯蚓、跳虫、线虫等)和微生物产生毒害效应[6],如引起土壤动物生殖量下降[7],土壤微生物群落结构发生变化及土壤功能部分或全部丧失[8],从而对土壤生态系统的安全与稳定构成威胁。
已有研究表明,镉对植物生长的早期生命阶段有很强的毒性,如可抑制种子发芽、阻碍幼苗生长、延缓根系发育,以及诱导植物产生生理生化异常或病理变化等。目前,水稻、玉米、小麦、大麦、燕麦、大豆、豌豆、绿豆、辣椒、烟草和向日葵等植物幼苗已被广泛用于研究土壤中镉的生物富集特性及生态毒理效应[5]。近年来,我国对镉污染土壤的生态毒理研究也日益重视和关注,但出于保护人体健康和食品安全等考虑,现有的研究多集中于作物产量对镉胁迫的响应及镉在植物体内的累积富集特性等方面[9-14],或是偏重于从机制上解释镉对植物结构与组分(如叶绿体和叶绿素)、生理过程(如氧化胁迫反应)以及生化指标(如抗氧化酶活性)的影响[15],而从生态毒理效应角度考虑镉对植物苗期生长和根系发育的毒理学研究还相对偏少[16],从保护土壤功能方面探讨镉对植物根际微生物群落结构变化的影响也只略有涉及[17-18],相关的毒理效应指标和浓度阈值还有待建立。本文研究了镉在北京褐潮土中对玉米幼苗及其根际微生物的毒害效应,探讨了镉在玉米幼苗根、茎、叶中的累积富集特性,明确了镉影响玉米幼苗生长和发育(以生物量、株高等作为代表性测试终点)的效应浓度阈值,研究结果可为镉污染土壤的生态风险评估和我国土壤环境质量标准的制/修订提供基础参考数据。
1 材料与方法(M aterials and methods)
1.1 试剂和材料
氯化镉(CdCl2·5/2H2O)购自国药集团化学试剂有限公司,纯度>98%。实验所用玉米品种为郑单958,购自中国农业科学院,选取颗粒饱满,大小均一的玉米种子用于实验。供试土壤为采自中国环境科学研究院梨园的表层(0~20 cm)土壤,土壤在使用前先于温室内自然风干,剔除植物根系,然后过2 mm筛除去大的砾石土块。实验土壤的干容重为2.96 kg·dm-3,pH 值7.28,有机质含量1.13%(质量百分比),阳离子交换量7.2 cmol·kg-1,最大持水量 29.3%(质量百分比),黏粒、粉粒和砂粒含量分别为11.63%、15.12%和73.25%(体积百分比)。实验土壤中典型重金属砷、汞、铜、镉、铬、锌、镍和铅的本底浓度分别为 7.3、0.09、19.0、0.30、56.5、78.5、32.6 和26.0mg·kg-1。
1.2 玉米盆栽实验
在预实验确定毒性范围的基础上,选择10、22、46、100、220、460 和1 000 mg·kg-1等 7 个成几何等差系列的镉浓度进行实验,以不添加镉的土壤为对照(CK)。详细操作过程为:先将适量氯化镉溶于200 mL去离子水配成系列浓度的氯化镉水溶液,加入到2 kg干燥土壤中,充分混匀后,再用去离子水将土壤湿度调节至其含水量的20%,然后将土壤装到塑料花盆中(直径210 mm,高240 mm),室温下放置、平衡7 d后用于实验。实验开始前先将玉米种子用去离子水浸泡12 h,至种子吸胀后挑选个大、饱满的颗粒,按每盆10粒播种(约2 cm深)于实验土壤中,移入温室,自然光照,温度22℃ ~28℃,湿度60%的条件下培养,并根据需要每天浇1/2 Hoagland营养液[19]1~2次,以保持水分相对平衡(通过称取质量来辅助判断)。待种子出苗后5 d,疏苗,每盆保留长势均匀的幼苗4株。在实验的第28天,检查并记录玉米株高、地上部鲜质量和干质量、根鲜质量和干质量等指标,并利用抖土法收集根际土壤用于微生物群落结构分析。玉米根和地上部干质量的测定方法是,先将鲜样在90℃烘箱中烘烤30 min,然后降温至60℃烘48 h至恒重,称取质量。每个测试浓度重复4次。
1.3 玉米根际微生物群落结构DGGE分析
盆栽实验结束时(第28天),用抖土法采集玉米根际土壤,用MO BIO PowerSoil®DNA Isolation Kit试剂盒提取土壤基因组DNA。将纯化所得总DNA进行稀释后,选用 357F-GC(GC-clamp-5'-CCTACGGGAGGCAGCAG-3’,其中 GC-clamp序列为5'-CGCCCGCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGG-3’)和517R(5'-ATTACCGCGGCTGCTGG-3’)扩增 16S rDNA V3区域,扩增的片段长度为180 bp左右。PCR反应体系为50 μL:10×Buffer 5 μL、dNTP 4 μL、引物(10 μmol·L-1)各1 μL、模板DNA 40 ~50 ng、Takara Ex Taq DNA Polymerase(Takara,大连)1.5U、灭菌高纯水补齐至50μL。PCR扩增反应条件为:94℃预变性5 min,94℃变性1min,48℃退火1 min,72℃延伸 1 min,共进行30个循环,72℃最终延伸10 min。PCR产物经浓缩后,加入到10%(m/V)聚丙烯酰胺凝胶中,凝胶的变性范围为40% ~65%。利用Bio-Rad公司的Dcode System电泳仪,在60℃,85 V,采用1×TAE Buffer电泳16 h。电泳结束后,使用1∶10 000 sybre green染色15min,使用Bio-Rad Gel Doc XR成像并进行条带判读,以配套软件Quantity One进行迁移率、强度、面积计算,选择Jaccard指数计算各样品间的相似性指数,其计算公式为:

式中,Cj为Jaccard指数,j为2个样品共有物种数,a、b分别为2个样品各自物种数。
采用QIAquick试剂盒对DGGE胶进行割胶回收,以357F/517R为引物进行PCR扩增并测序,将所得序列结果通过Blast程序与GenBank中核酸数据进行比对分析,通过16S rDNA获得菌株的初步生物学信息。
1.4 样品测试
土壤中镉残留浓度的测定过程为:在实验的第28天,从每个盆中取土样约20 g(湿质量),风干、研磨并过100 目筛,取0.2 g在9mL HNO3、HCl和 HF(体积比5∶2∶2)混合消解液中,用微波消解仪(MARS,美国CEM公司)消解。消解过程首先升温至120℃,保持2 min,然后再升温至160℃,保持10 min,最后将温度升至180℃,保持20 min。消解完成后,将消解液转移至消煮管中,加1 mL HClO4,在电热板上150℃赶酸至1mL,冷却,转移至50 mL的容量瓶中,用质量分数为1%的HNO3定容,过滤,然后用ICP-MS(7500,美国Agilent公司)测定镉的浓度。测试过程中,同时测定空白和标准土壤样品(中国计量科学研究院土壤成分分析标准物质(GBW07410)进行质量控制。
玉米组织(根、茎、叶)中镉累积浓度的测定过程为:将收获的玉米苗先用自来水洗涤,去除植株表面和根部粘附的土壤,再用去离子水洗涮2~3次,然后用剪刀把玉米苗分解为根、茎、叶 3部分,在90℃烘箱中烘30 min,降温至60℃烘48 h至恒重。干燥样品用剪刀剪碎,取0.2 g在6 mL HNO3和H2O2混合消解液(体积比5∶1)中,用电热板150℃消解2 h,然后赶酸至1 mL,冷却后转移至25 mL的容量瓶中,用质量分数为1%的HNO3定容,过滤,ICP-MS测定镉浓度。测试过程中,同时测定空白和标准植物样品(中国计量科学研究院生物成分分析标准物质绿茶(GBW10052)进行质量控制。
1.5 统计分析
利用Logistic回归方程进行曲线拟合并计算镉引起玉米幼苗株高、根部和地上部生物量下降10%、20%和50%的效应浓度值(即 EC10、EC20和EC50)。回归分析采用SYSTAT 11.0统计分析软件完成,用SigmaPlot 12.0软件作图。镉在玉米组织中的生物富集系数(BAF)用下式进行计算:
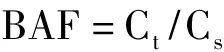
式中,BAF是生物富集系数,Ct是玉米组织中镉浓度,Cs是土壤中镉浓度。
2 结果与讨论(Results and discussion)
2.1 镉对玉米幼苗的毒性
在所测定的镉污染浓度范围内,镉并不影响玉米的正常萌芽与出苗,所有实验浓度下种子的出苗率均达到了100%,证明玉米种子发芽率的确不是测定镉污染土壤毒性效应的敏感指标[16]。第28天时观测发现,高浓度(如100 mg·kg-1及以上)镉污染土壤中玉米幼苗的生长与发育受到明显的抑制,出现植株矮化,植物叶片失绿、卷叶、烧尖或斑点型病变等症状(图1),但没有出现幼苗死亡的现象。外源镉抑制玉米幼苗生长及诱导叶片发生病变等影响在其他研究中已有报导,如在不同类型的水稻土中,当添加镉浓度大于5 mg·kg-1时,玉米叶片会出现不同程度的失绿,株高和生物量也较对照显著降低[20]。植株矮化是镉胁迫下植物对水分的吸收不足以及光合作用受阻的结果[21-22],而叶部病变则可能是高浓度镉抑制植物对铁、锌、钙、镁、磷等元素的吸收或阻碍植物体内锰元素运输的结果[23],因为镉可以通过竞争细胞膜上运输营养物质的跨膜载体蛋白而妨碍植物对钾、钙、镁、铁、锰、铜、锌、镍等元素的吸收和运输[4,24-25],从而导致植物出现矿质营养元素缺乏症[26]。然而,由于镉对植物的影响具有多靶标、多效应、多作用位点以及全局性、复杂性、系统性等特点,目前对其毒理作用机制还没有比较系统和完整的了解[4,27],镉对植物的毒性及其毒理学机制仍是将来值得深入探讨的重要研究方向[5]。

图1 镉胁迫下玉米的形态变化及其浓度响应
定量观测结果发现,玉米株高随着镉污染浓度的增加而降低(图2),根部和地上部鲜质量和干质量也随着镉浓度的增加而趋于减少(图3),表明高浓度镉对玉米茎叶生长和根系发育均有明显的毒害效应[28]。基于不同的测试终点(株高、根鲜质量和干质量、地上部鲜质量和干质量)和土壤中镉的实测浓度,分别计算得到各终点的效应浓度阈值(表1)。镉在北京褐潮土中引起玉米幼苗株高下降1/2或导致玉米根部及地上部生物量(干质量)下降1/2的效应中浓度(EC50)分别为654.6、323.6 和110.2 mg·kg-1。
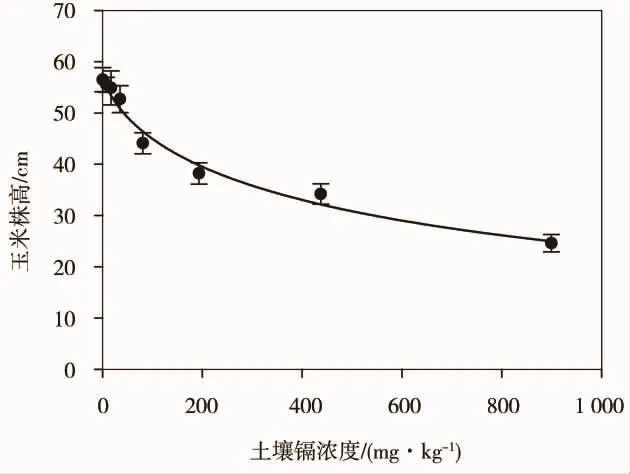
图2 不同镉浓度对玉米株高的影响(平均值±标准差,n=4)Fig.2 Effects of different Cd concentrations on height ofmaize seedlings(Means± SD,n=4)

表1 褐潮土中镉对玉米株高及根部和地上部生物量的 EC10、EC20和 EC50值Table 1 Effective concentrations(EC10,EC20 and EC50)of Cd formaize height and biomass of root and shoot in fluvo-aquic soils

图3 不同浓度镉对玉米幼苗根部和地上部鲜质量(A)和干质量(B)的影响(平均值±标准差,n=4)Fig.3 Effects of different Cd concentrations on fresh(A)and drymass(B)of rootand shootofmaize seedlings(Means ± SD,n=4)
镉对植物早期生长阶段的毒害效应已得到了普遍的证明,但不同物种间幼苗的毒性响应差别很大[5,29],即使是同种植物的不同品种(系)间对镉胁迫的耐受性也有很大的差异[30-31]。镉对玉米幼苗的潜在毒性也早有认识[32],近年来,围绕镉对玉米的毒性效应、毒害症状和毒理机制开展了较为广泛和深入的研究,所涉及的测试终点或评估指标包括镉对玉米株高和根伸长的影响、镉对玉米叶绿体结构、叶绿素含量及光合作用的影响、镉对玉米抗氧化酶活性的影响、镉在玉米体内的吸收与富集特性等[33-34]。其中,镉对玉米生长的抑制作为一种易于观测且与生态效应直接相关联的毒性指标,在镉的毒理评价与机理研究中使用最为广泛。笔者的研究也表明,镉对玉米幼苗的株高以及根部和地上部鲜、干质量都有不同程度的抑制作用(图2和3)。从不同测试终点的效应阈值来看(表1),玉米地上部生物量终点的敏感性略高于根部生物量测试终点,而株高测试终点则相对不敏感。有趣的是,与鲜质量相比,玉米根部和地上部干质量的敏感性相对要低一些,表明针对同一评估指标(生物量),因使用的测量方法或表征方式不同,所得到的效应浓度阈值可能会存在一定的偏差。此外,从经济效益和生态相关性的角度,玉米地上部茎、叶生长性状及生物量可能是影响其未来产量的直接相关因素[35],因此在选择植物幼苗进行污染物生态效应评估时,地上部(茎和叶)生物量应该是一个较为理想的测试终点。
2.2 玉米幼苗对镉的吸收和富集
随着土壤中镉污染浓度的增加,玉米幼苗根、茎和叶中镉的浓度也相应增加(图4),但在相同的暴露浓度下,玉米根部组织中镉的浓度要高于地上部组织中镉的浓度,而玉米茎、叶中镉的浓度则大体相当,没有显著的差异。其他的研究也证明,玉米吸收的镉主要富集于根部,只有少量会转移到地上部分[33,36]。本实验中,相同镉暴露浓度下玉米根部组织中镉的浓度往往是地上部组织中镉浓度的3~6倍,从生物富集系数(bioaccumulation factor,BAF)来看(图5),根部对土壤中的镉有一定的累积富集效应(BAF>1),而茎、叶中镉的浓度与相应的土壤镉浓度基本一致,没有明显的富集。诸多的研究表明,植物根部中积聚的镉的浓度往往比其他组织中镉的浓度要高得多,镉在植物组织间浓度分配的一般规律是:根>茎>叶>果实>种子[37],本研究结果(图4)基本与此相符。

图4 土壤镉浓度与玉米根、茎、叶中镉浓度的关系(平均值±标准差,n=4)Fig.4 Relationship between Cd concentrations in soil and that inmaize root,stem and leaf(Means ± SD,n=4)

图5 生物富集系数(BAF)随土壤镉浓度的变化Fig.5 Bioaccumulation factor(BAF)as a function of Cd concentrations in soil
2.3 镉对玉米根际微生物群落结构的影响
根据玉米根际微生物16S rDNA V3可变区片断DGGE指纹图谱(图6),镉污染胁迫对微生物的群落结构有显著的影响。与对照相比,低浓度镉胁迫下部分微生物的种群数量有所降低(如b,e,o等3个条带亮度变弱),而在高浓度(如 >1 000mg·kg-1)时,有的微生物种群完全被抑制(如h,j,n等3个条带完全消失),但也有一些微生物(如条带f,g,k等所代表的种群)对镉污染胁迫表现出较高的耐性,种群数量在所测试的浓度范围内基本不受影响,甚至有的微生物其种群数量(如条带a,c,d,i,l,m等所代表的种群)在高浓度镉作用下反而得到了加强,这可能与高浓度镉抑制敏感微生物种群后,耐性微生物因种间竞争减少而得以繁盛有关[38]。
通过对玉米根际微生物的DNA片段进行测序分析,发现多数微生物种群为目前不可培养的细菌(表2),但通过对不同镉处理浓度下微生物的群落组成相似性进行UPMAGA聚类分析(图7),可以证明镉污染浓度与微生物群落构成之间存在着很好的浓度-效应关系,镉浓度为10 mg·kg-1时微生物群落结构与对照组最为接近(与对照的相似性达到82%),相邻处理浓度间(如3#、4#和5#泳道)微生物群落也具有较高的相似性,而镉浓度为1 000 mg·kg-1时根际土壤中微生物的种类明显减少,与对照组的Jaccard相似性指数最低(约为22%)。土壤微生物尤其是根际微生物对改善植物根系微环境,促进植物对水分和养分的吸收和利用有着重要的作用[39],而镉污染可降低土壤及植物根际微生物的种群数量[17,40],间接影响到植物对营养元素的吸收,这也是镉污染胁迫导致植物养分吸收不足的一种毒性作用机制。由此可见,综合研究镉对植物及其根际微生物的毒性影响,有助于全面揭示和了解镉污染胁迫下植物的响应过程以及植物-微生物之间的相互作用与机制,这也是目前污染生态学重点关注的研究方向[41]。
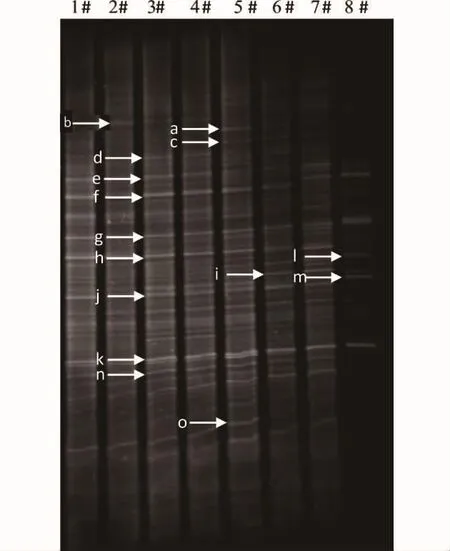
图6 不同浓度镉暴露下玉米根际微生物16S rDNA片断DGGE分析图谱
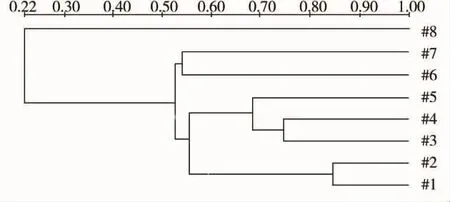
图7 不同浓度镉暴露下玉米根际微生物群落组成相似性系统树Fig.7 Similarity dendrogram for composition ofmaize rhizospheremicrobial community from soils treated with different concentrations of Cd

表2 测序克隆序列与GenBank最相似序列的对比结果Table 2 Alignment of sequenced clone to itsmost-similar GenBank sequence
综上所述,可以得到以下结论:
(1)高浓度(100 mg·kg-1及以上)镉对玉米幼苗生长发育有明显抑制作用,镉在北京褐潮土中引起玉米幼苗株高下降1/2或导致玉米根部及地上部生物量(干质量)下降1/2的效应中浓度(EC50)分别为 654.6、323.6 和 110.2 mg·kg-1。
(2)随着土壤中镉污染浓度的增加,玉米幼苗根、茎和叶中镉的浓度也相应增加,镉在玉米幼苗各组织中的浓度分布为根>茎>叶,根部对镉有一定的累积富集效应(BAF>1)。
(3)镉污染胁迫对根际微生物的群落结构有显著的影响,在高浓度(如1 000mg·kg-1)下可显著降低微生物的种群数量和生物多样性。
[1] Hutton M.Sources of cadmium in the environment[J].Ecotoxicology and Environmental Safety,1983,7(1):9-24
[2] McLaughlin M J,Singh B R.Cadmium in soils and plants[M]//McLaughlin M J,Singh B R.Cadmium in Soils and Plants.Dordrecht:Kluwer Academic Publishers,1999:1-9
[3] Toppi L S,GabbrielliR.Response to cadmium in higher plants[J].Environmental and Experimental Botany,1999,41(2):105-130
[4] Benavides M P,Gallego SM,Tomaro M L.Cadmium toxicity in plants[J].Brazilian Journal of Plant Physiology,2005,17(1):21-34
[5] Wahid A,Arshad M,Farooq M.Cadmium phytotoxicity:responses,mechanisms and mitigation strategies:A review[M]//Lichtfouse E.Organic Farming,Pest Control and Remediation of Soil Pollutants.Berlin:Springer-Verlag,2010:371-403
[6] McGrath SP.Adverse effects of cadmium on soilmicroflora and fauna[M]//McLaughlin M J,Singh B R.Cadmium in Soils and Plants.Dordrecht:Kluwer Academic Publishers,1999:199-218
[7] Lock K,Janssen C R.Cadmium toxicity for terrestrial invertebrates:Taking soil parameters affecting bioavailability into account[J].Ecotoxicology,2001,10(5):315-322
[8] Vig K,Megharaj M,Sethunathan N,et al.Bioavailability and toxicity of cadmium to microorganisms and their activities in soil:A review[J].Advances in Environmental Research,2003,8(1):121-135
[9] 朱志勇,李友军,郝玉芬,等.镉对小麦(Triticum aestivum)干物质积累、转移及籽粒产量的影响[J].农业环境科学学报,2012,31(2):252-258 Zhu Z Y,Li Y J,Hao Y F,et al.Effects of Cd on accumulations and translocation of biomasses and yield of different wheat(Triticum aestivum)cultivars[J].Journal of Agro-Environment Science,2012,31(2):252-258(in Chinese)
[10] 黄冬芬,王志琴,刘立军,等.镉对水稻产量和品质的影响[J].热带作物学报,2010,31(1):19-24 Huang D F,Wang ZQ,Liu L J,et al.Effect of cadmium on the rice yield and grain quality[J].Chinese Journal of Tropical Crops,2010,31(1):19-24(in Chinese)
[11] 范仲学,单世华,杨志艺,等.重金属镉在五类花生不同部位的分布特征及其对产量的影响[J].中国农业科技导报,2009,11(5):102-107 Fan Z X,Shan S H,Yang Z Y,et al.Effects of Cd stress on distribution characteristics at different parts of five peanut genotypes and their yields[J].Journal of Agriculture Science and Technology,2009,11(5):102 –107(in Chinese)
[12] 林君锋,高树芳,陈伟平,等.蔬菜对土壤镉铜锌富集能力的研究[J].土壤与环境,2002,11(3):248-251 Lin JF,Gao S F,Chen W P,et al.Study on the concentrating characteristics of vegetables for Cd,Cu and Zn[J].Soil and Environmental Sciences,2002,11(3):248-251(in Chinese)
[13] Guo X F,Wei Z B,Wu Q T,et al.Cadmium and zinc accumulation inmaize grain as affected by cultivars and chemical fixation amendments[J].Pedosphere,2011,21(5):650-656
[14] Cheng W D,Yao H G,Zhang H M,etal.Influences of cadmium on grain mineral nutrient contents of two rice genotypes differing in grain cadmium accumulation[J].Rice Science,2009,16(2):151-156
[15] Zhao Y.Cadmium accumulation and antioxidative defenses in leaves of Triticum aestivum L.and Zea mays L.[J].African Journal of Biotechnology,2011,10(15):2936-2943
[16] Cao H C,Wang JD,Zhang X L.Ecotoxicity of cadmium tomaize and soybean seedling in black soil[J].Chinese Geographical Sciences,2007,17(3):270-274
[17] 段学军,闵航.镉胁迫下稻田土壤微生物基因多样性的DGGE分子指纹分析[J].环境科学,2004,25(5):122-126 Duan X J,Min H.Diversity ofmicrobial genes in paddy soil stressed by cadmium using DGGE[J].Environmental Science,2004,25(5):122-126(in Chinese)
[18] 李廷强,舒钦红,杨肖娥.不同程度重金属污染土壤对东南景天根际土壤微生物特征的影响[J].浙江大学学报:农业与生命科学版,2008,34(6):692-698 Li TQ,Shu Q H,Yang X E.Effects of heavymetalcontaminated soils at different levels on rhizosphere microorganisms of Sedum alfredii Hance[J].Journal of Zhejiang University:Agriculture and Life Science,2008,34(6):692-698(in Chinese)
[19] Hoagland D R,Arnon D L.The water culture method for growing plantswithout soil[J].Circular California Agricultural Experimental Station,1950,347(2):1-32
[20] 王翠红,周清,黄启为,等.不同类型水稻土上外源镉对玉米生长发育影响的研究[J].农业环境保护,2001,20(5):293-296 Wang C H,Zhou Q,Huang QW,et al.Effects of added cadmium on growth ofmaize under different types of paddy soil in Hunan Province[J].Agro-Environmental Protection,2001,20(5):293-296(in Chinese)
[21] Perfus-Barbeoch L,Leonhardt N,Vavasseur A,etal.Heavymetal toxicity:Cadmium permeates through calcium channels and disturbs the plant water status[J].The Plant Journal,2002,32(4):539-548
[22] Chugh L K,Sawhney S K.Photosynthetic activities of Pisum sativum seedling grown in presence of cadmium[J].Plant Physiology Biochemistry,1999,37(4):297-303
[23] Clarkson D T,Luttge U.Mineral nutrition:Divalent cations,transport and compartmentalization[M]//Behnke H,Esser K,Runge M,et al.Progress in Botany.Berlin:Springer-Verlag,1989:93-112
[24] Rivetta A,Negrini N,CocucciM.Involvement of Ca2+-calmodulin in Cd2+toxicity during the early phases of radish(Raphanussativus L.)seed germination [J].Plant Cell and Environment,1997,20(5):600-608
[25] 安志装,王校常,施卫明,等.重金属与营养元素交互作用的植物生理效应[J].土壤与环境,2002,11(4):392-396 An Z Z,Wang X C,ShiW M,etal.Plantphysiological responses to the interactions between heavy metal and nutrients[J].Soil and Environmental Sciences,2002,11(4):392-396(in Chinese)
[26] Maynard D N.Nutritional disorders of vegetable crops:A review[J].Journalof PlantNutrition,1979,1(1):1-23
[27] Hasan S A,Fariduddin Q,Ali B,et al.Cadmium:Toxicity and tolerance in plants[J].Journalof Environmental Biology,2009,30(2):165-174
[28] 李勇,黄占斌,王文萍,等.重金属铅镉对玉米生长及土壤微生物的影响[J].农业环境科学学报,2009,28(11):2241-2245 Li Y,Huang Z B,Wang W P,et al.Effects of heavy metals lead and cadmium on Zeamays L.growth and the soil microorganism [J].Journal of Agro-Environment Science,2009,28(11):2241-2245(in Chinese)
[29] 丁枫华,刘术新,罗丹,等.23种常见作物对镉毒害的敏感性差异[J].环境科学,2011,32(1):277-283 Ding F H,Liu SX,Luo D,et al.Different sensitivity of 23 common crop species to cadmium toxicity[J].Environmental Science,2011,32(1):277-283(in Chinese)
[30] Belimov A A,Safronova V I,Tsyganov V E.Genetic variability in tolerance to cadmium and accumulation of heavy metals in pea(Pisum sativum L.)[J].Euphytica,2003,131(1):25-35
[31] Ghani A,Wahid A.Varietal differences for cadmiuminduced seedlingmortality and foliar-toxicity symptoms in mungbean(Vigna radiata)[J].International Journal of Agriculture& Biology,2007,9(4):555-558
[32] Rascio N,Vecchia F D,FerrettiM,et al.Some effects of cadmium on maize plants[J].Archives of Environmental Contamination and Toxicology,1993,25(2):244-249
[33] Wang M,Zou J,Duan X C,etal.Cadmium accumulation and its effects on metal uptake in maize(Zea mays L.)[J].Bioresource Technology,2007,98(1):82-88
[34] Ekmekci Y,Tanyolac D,Ayhan B.Effects of cadmium on antioxidant enzyme and photosynthetic activities in leaves of twomaize cultivars[J].Journal of Plant Physiology,2008,165(6):600-611
[35] Ghassemi-Golezani K,Tajbakhsh Z.Relationship of plant biomass and grain filling with grain yield ofmaize cultivars[J].International Journal of Agriculture and Crop Sciences,2012,4(20):1536-1539
[36] An Y J.Soil ecotoxicity assessment using cadmium sensitive plants[J].Environmental Pollution,2004,127(1):21-26
[37] Blum W H.Cadmium uptake by higher plants[C]//IskandarIK.Proceedings of Extended Abstracts from the Fourth International Conference on the Biogeochemistry of Trace Elements.Berkeley:University of California,1997:109-110
[38] Ipsilantis I,Coyne M S.Soilmicrobial community response to hexavalent chromium in planted and unplanted soil[J].Journal of Environmental Quality,2007,36(3):638-645
[39] Hrynkiewicz K,Baum C.The potential of rhizosphere microorganisms to promote the plant growth in disturbed soils[M]//Malik A,Grohmann E.Environmental Protection Strategies for Sustainable Development.Berlin:Springer,2012:35-64
[40] Roane TM,Pepper IL.Microbial responses to environmentally toxic cadmium[J].Microbial Ecology,1999,38(4):358-364
[41] Dong J,Mao W H,Zhang G P,et al.Root excretion and plant tolerance to cadmium toxicity—A review[J].Plant,Soil and Environment,2007,53(5):193-200 ◆
