三氯生对羊角月牙藻生长及其抗氧化系统的影响
2013-08-20李义刚刘滨扬彭颖廖伟武小燕苏甜欧瑞康聂湘平
李义刚,刘滨扬,彭颖,廖伟,武小燕,苏甜,欧瑞康,聂湘平
暨南大学生命科学技术学院生态系水体富营养化与赤潮防治广东普通高校重点实验室,广州510632
三氯生(2,4,4'-三氯-2'-羟基二苯醚,triclosan)是一种广泛使用的广谱抗菌剂,对革兰氏阳性菌、革兰氏阴性菌、酵母及病毒均有广泛高效的杀灭及抑制作用。三氯生应用领域十分广泛,包括医药、化妆品与洗涤剂等领域,目前已经开发出200余种日化产品及专业新产品[1]。伴随着各种医药、化妆品及洗涤剂用品的广泛使用,三氯生排放进入水体以及其他环境介质中,甚至还可能进入食物链,最后在植物、动物和人体中蓄积[2-3]。周世兵等[4]报道在污水处理厂排污口附近水域能普遍检出三氯生。Peng等[5]报道在珠江水域中检测出三氯生的含量在35~1 023 ng·L-1之间。Coogan等[6]在北德克萨斯州某河流的藻类中检测到三氯生的富集含量达到50~400 ng·g-1(以鲜质量计);Adolfsson-Erici等[7]在人的奶汁中发现三氯生的质量浓度为0.07~300 ng·g-1(以鲜质量计)。三氯生作为药品与个人护理品中的添加物,在低浓度的情况下,毒性并不显著,因此尚未得到足够重视[4],但是在一定条件下,三氯生可生成其他有毒中间产物。Milagros等[8]发现水中的三氯生在紫外线照射的条件下,会光解生产2,7/2,8-二氯二苯并-对-二恶英。二恶英是一类强烈致癌物质,美国药典对于三氯生中的二恶英含量规定不得大于 0.25mg·kg-1[9]。此外,三氯生可被自由氯离子氧化,生成氯仿、2,4,6-三氯苯酚等有毒化合物[10]。李林朋等[11]的研究表明,三氯生可导致人体正常干细胞的DNA断裂损伤,且具有明显的剂量-效应和时间-效应关系。Gee等[12]研究发现,三氯生可对人类乳腺癌细胞产生雌激素和雄激素效应。大量文献表明三氯生对生态环境和人体健康具有不容忽视的潜在毒性效应,开展其对生态系统和人体健康的风险评估非常必要。
藻类作为水生生态系统的初级生产者,一般位于食物链的最底端,藻类与其他水生生物的关系十分密切,它对维持水生生态系统的结构和功能稳定具有总要意义,所以藻类是监测和评价水环境质量的重要指示生物[13]。羊角月牙藻是淡水水体中常见的藻类之一,其生长速度快,便于观测,已有研究证实其对环境条件变化及污染物很敏感,是水环境生态毒理学研究的标准实验生物(ISO 8692-1989)。目前,对三氯生的研究大多集中在日化产品中其含量检测方法的建立及其在废水中含量的检测[4,14],国内外只有少数文献报道其对生物的影响或毒性效应[15-16],然而关于三氯生对藻类的光合作用以及抗氧化酶系影响方面目前还鲜见报道。
以羊角月牙藻为实验材料,从藻类生长速率、叶绿素含量、叶绿素荧光动力学参数以及抗氧化酶系统等方面评价三氯生羊角月牙藻的毒性效应,探究不同质量浓度的三氯生暴露后藻类的变化及其响应规律,为进一步研究和评价水体环境中三氯生的生态毒理效应及其潜在的生态风险提供理论依据。
1 材料与方法(M aterials and methods)
1.1 仪器和试剂
仪器:冷冻高速离心机(sigma 2-16k,德国);超低温冰箱(Thermo forma,美国);超声波细胞粉碎仪(UH-950B,天津);恒温水浴锅(HH.S21-6,上海);超声波清洗器(Branson 3510,美国);显微镜(Olympus CX21,日本);计数器(KWTRIO,上海);烘箱(GZX-9076,上海);分析天平(PrecisaXS 125A-SCS,瑞士);自动蒸汽灭菌锅(D-1,上海);酸度计(BeckmanΦ350,美国);三温区光照培养箱(FPG3,宁波莱福);紫外可见分光光度计(HachDR 5000,美国)。
试剂:三氯生购于北京百灵威科技有限公司,纯度≥96%,药品于实验当天用蒸馏水配制成母液,母液浓度为5 mg·L-1。所用其他试剂均为分析纯。
1.2 实验材料
藻种:羊角月牙藻(Selenastrum capricornutum)藻种由中国科学院水生生物研究所淡水藻种库提供。藻种置于恒温光照培养箱内培养,用AAM培养基培养,每升培养基参照文献[17],光暗周期12 h∶12 h,于光照强度60 μmol·m-2·s-1,温度(23 ±1)℃。每天人工摇动3次,隔96 h移动1次,反复3次以上,使之达到同步生长。每次移动前进行显微镜境检,检查藻是否污染。
1.3 毒性实验
1.3.1 生物量测定
培养的藻液分别在0、24、48、72、96 h 取样,通过在显微镜下用血球计数板进行藻细胞计数,同时在波长680 nm下测定的藻液光密度,建立不同藻细胞浓度和光密度之间的线性关系,实验中以测定的光密度和根据线性方程计算出的藻细胞浓度表示细胞数。预实验在250mL锥形瓶中进行,三氯生设置了5个间隔较大的浓度梯度(0.002、0.010、0.050、0.250、0.500 mg·L-1)和空白对照,每个浓度组设3 组平行,于0、24、48、72、96 h后定时取样,测定680 nm波长下各实验组藻液吸光值,用概率单位法计算96 h-EC50。
1.3.2 叶绿素a含量测定
参照王学奎的方法[18],取经过三氯生暴露处理0、24、48、72、96 h 后藻液,3 500 × g离心分离藻体细胞,加入5 mL体积分数为95%的乙醇,振荡摇匀,于黑暗处4℃下提取24 h。将提取液以7 000 r·min-1离心,取上清液,1 cm光径比色皿,以体积分数为95%乙醇为空白,分别在470、663和645 nm波长下测定吸光值,根据公式叶绿素 a=13.95A663-6.88A645计算叶绿素 a[18]。
1.3.3 叶绿素荧光测定
叶绿素荧光利用植物效率仪(PEA,Hansatech Ltd.,英国)于室温下测定。分别取不同处理浓度暴露96 h后样品藻液,测试前藻液样品暗适应20min。
采用的参数及其计算方法见表1,叶绿素荧光参数的分析主要是根据Appenroth和Strasser的方法[19-20]。放氧复合体的比例按公式(1)与(2)进行计算[23]。

1.4 酶活性的测定
三氯生在预实验中96 h内使羊角月牙藻抑制率为100%的浓度为0.500 mg·L-1,急性毒性实验设置1个空白对照和5 个三氯生暴露组(0.000、0.004、0.016、0.064、0.128和0.256mg·L-1)。实验条件跟预实验相同。暴露96 h后,分别取100mL的藻液于3 500×g、4℃下离心10min,弃去上清液,藻泥冷冻在-80℃冰箱待测。
测定时将离心所得藻泥再悬浮于3.0 mL 0.1 mol·L-1(pH 7.8)的磷酸盐缓冲液中,冰浴下超声波不连续破碎30 min,其中破碎时间3 s,间隔时间7 s,超声波破碎仪工作功率为15 W,破碎后于4℃、7 150×g下离心15 min,上清液为粗酶液,用于酶活性的测定。
蛋白含量、GSH含量、GST活性、MDA含量和CAT活性测定均采用南京建成生物公司的试剂盒进行测定。蛋白测定采用考马斯亮兰法,蛋白以样品蛋白含量μg·mL-1表示。GSH含量在波长412 nm处测定吸光度计算,GST活性以在37℃反应1 min扣除非酶促反应,使反应体系中GSH浓度降低1μmol·L-1为1个酶活力单位(U)。MDA含量测定采用硫代巴比妥酸法(TBA法),以μmol·mg-1表示。CAT测定采用紫外吸收法,定义每毫克蛋白每秒钟分解1μmol的H2O2的量为1个活力单位(U)。GST、CAT的活性和GSH、MDA的含量均以每毫克蛋白含量为标准计算,每个平行测定3次,取其平均值计算。
1.5 数据处理
同一处理时间的各指标内差异显著性采用单因素方差分析(One-Way ANOVA,LSD),分析软件为SPSS 13.0,实验结果用平均值±标准偏差(Mean±SD)表示,P<0.05和 P<0.01表示处理组与对照组差异显著和极显著。

表1 JIP-测定中快速叶绿素荧光诱导动力学曲线(O-J-I-P)的参数Table 1 Parameters in analysis of O-J-I-P chlorophyll a fluorescence transients in JIP-test
2 结果(Results)
2.1 三氯生对羊角月牙藻的毒性实验
2.1.1 三氯生对羊角月牙藻细胞生长的影响
由图1可见,随着暴露时间的延长,除了高浓度组0.500 mg·L-1,各实验浓度组藻细胞密度均逐渐升高。但随着三氯生浓度的升高,羊角月牙藻生长受到抑制,藻细胞密度逐渐降低,并且二者呈负相关关系,有比较明显的剂量-效应关系。三氯生浓度为0.050 mg·L-1时,羊角月牙藻的生长开始受到抑制,当三氯生浓度达到0.250 mg·L-1时,羊角月牙藻的生长受到显著抑制,藻细胞密度显著下降。当三氯生浓度达到0.500 mg·L-1时,藻细胞密度出现负增长,在显微镜下观察,发现部分藻细胞壁受到破坏,藻细胞的颜色变浅。计算三氯生对羊角月牙藻的96 h-EC50为 0.112 mg·L-1,按照水生生物毒性分级[21],三氯生对羊角月牙藻的急性毒性属于高毒。

图1 三氯生对羊角月牙藻生长的影响Fig.1 Effects of triclosan(TCS)on growth of S.capricornutum

图2 三氯生对羊角月牙藻叶绿素a的影响Fig.2 Effects of TCS on chlorophyll a of S.capricornutum
2.1.2 三氯生对羊角月牙藻叶绿素a的影响
在不同浓度三氯生的处理下,羊角月牙藻叶绿素a含量的变化趋势与细胞密度的变化趋势基本吻合,随着三氯生浓度的增大,培养液中的叶绿素a含量下降,96 h时0.500 mg·L-1处理组叶绿素含量为对照的14.6℅,48 h后开始出现负增长。
2.1.3 三氯生对羊角月牙藻叶绿素荧光诱导动力学影响
由图3可见,在藻细胞光合作用的PSII供体中,羊角月牙藻放氧复合体(OEC)比例随着三氯生浓度的升高而出现了大幅度下降,三氯生浓度为0.064 mg·L-1时,羊角月牙藻的放氧复合体的比值为对照的72%,当三氯生浓度达到0.256 mg·L-1时,羊角月牙藻的放氧复合体的比值还不及对照组的40%。
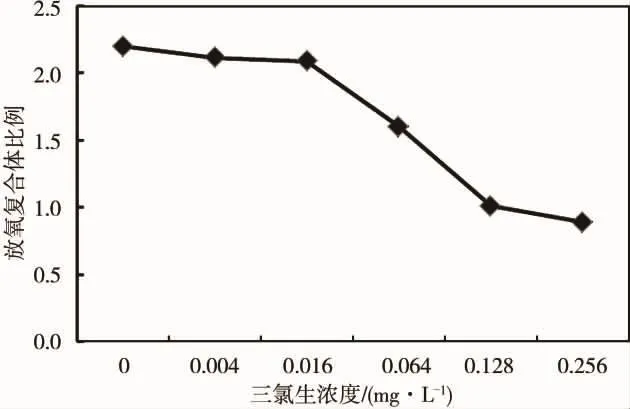
图3 三氯生处理后羊角月牙藻放氧复合体比例的变化Fig.3 Changes of fraction of OEC in S.capricornutum after TCS treatment
由图4可见,羊角月牙藻单位反应中心吸收的光能(ABS/RC)随着三氯生浓度的升高而出现大幅升高,单位面积反应中心的数量(RC/CSo)出现明显下降,单位反应中心所捕获的光能(TRo/RC)略有上升,但是用于电子传递的量子产额(φEo)、最大光化学效率(φPo)、捕获的激子能推动电子传递的效率(ψo)均有明显下降,表明随着三氯生浓度的升高,用于原初光化学反应及电子传递的能量出现降低,多余的光能通过热耗散的形式进行释放,从而导致用于热耗散的量子产额(φDo)出现大幅升高,最终导致羊角月牙藻PSII性能指数(PIabs)大幅下降,当三氯生暴露浓度为0.256 mg·L-1,羊角月牙藻(PIabs)还不及对照组的2%。
Mo、Sm、φEo和 ψo等参数主要反映 PSII受体侧变化。PSII受体侧主要包括QA、QB和PQ库等。Mo反映了QA被还原的最大速率,即O-J过程中QA被还原的速率[20],它与反应中心色素、捕光色素和QA所处的状态有关;Sm则反映了QA完全被还原所需要的能量,即PSII反应中心受体侧PQ库的大小[22],电子从QA进入电子传递链越多,则达到 FM所需要时间越长,Sm的值也就越大。随着三氯生浓度的增高,Sm出现下降,Mo上升,使得羊角月牙藻PSII受体侧PQ库变小,电子传递体数量减少,QA向下传递的电子受到抑制,加快了QA还原效率,减少了QA还原次数,即N变小。这表明,三氯生使羊角月牙藻的PSII反应中心受损,抑制了光合作用的原初反应,阻碍了光合电子传递的过程。
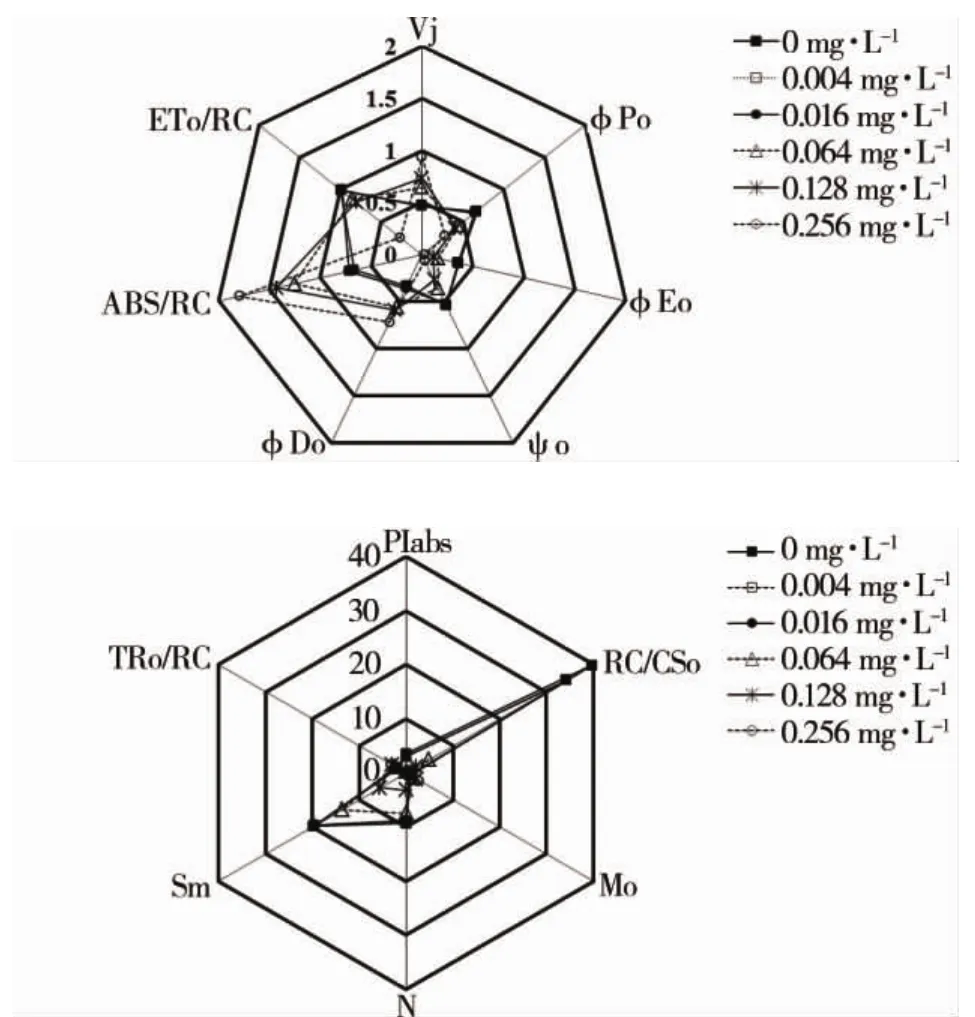
图4 三氯生处理后羊角月牙藻光合作用各动力学JIP-测定参数的变化Fig.4 Changes of selected JIP-test parameters for S.capricornutum after TCS treatment
2.2 三氯生对羊角月牙藻GSH和MDA含量与GST和CAT酶活性的影响
由图5可见,随着三氯生浓度的增加,GST和CAT活性均呈现出先诱导后抑制的现象。GST在浓度组 0.128 mg·L–1中受到极显著诱导(P <0.01),当三氯生浓度为0.256 mg·L-1时,GST活性为对照组的1.7 倍,差异不显著(P >0.05)。在暴露组0.064 mg·L–1中CAT 受到显著诱导(P <0.05),当暴露浓度达到0.128mg·L-1时,CAT 含量为对照组的2.18 倍,受到极显著诱导(P<0.01),CAT活性在高浓度组0.256 mg·L-1中为对照组的1.3 倍,差异不显著(P >0.05)。

图5 三氯生对羊角月牙藻CAT、GST活性与GSH、MDA含量的影响
三氯生对羊角月牙藻GSH的影响不大,其含量总体升高,只在浓度组0.128mg·L–1中受到显著诱导(P<0.05)。三氯生对羊角月牙藻MDA含量呈现诱导的现象,在低浓度组(0.004、0.016 mg·L–1)中,MDA含量跟对照组相差不大,随着三氯生浓度的增加,MDA含量逐渐增加,在三氯生浓度为0.064和0.128 mg·L–1时,MDA 受到显著诱导(P <0.05),当三氯生浓度达到0.256 mg·L-1时,MDA含量为对照组的1.81 倍,达到最大,受到极显著诱导(P <0.01)。
3 讨论(Discussion)
3.1 三氯生对羊角月牙藻生长和叶绿素a的影响
在低浓度三氯生暴露时,随着时间的延长,羊角月牙藻在96 h表现出对三氯生的逐渐适应,生长速度虽然不及对照组,但仍呈增长趋势。随着三氯生暴露浓度的增大,藻细胞生长受到抑制。高浓度三氯生暴露可能对羊角月牙藻光合作用等关键代谢过程产生了干扰,从而影响了藻的代谢和繁殖,导致藻的生长受到抑制[23]。三氯生对藻类生长的影响首先体现在对羊角月牙藻叶绿素a含量的影响。在三氯生暴露浓度较低时,叶绿素a含量稳定增加,但高浓度的三氯生破坏了藻细胞的结构,使得叶绿素含量降低,藻液颜色变黄等现象,可能是高浓度的三氯生引起了藻细胞膜系统脂质过氧化而破坏了细胞和叶绿体等细胞器膜的结构,导致叶绿素合成受阻[24]。
3.2 三氯生对羊角月牙藻叶绿素荧光诱导动力学影响
植物在进行光合作用时,叶绿素吸收的光能主要用于推动光合作用,当中也有一部分在形成同化力之前以热的形式耗散或以荧光的形式重新发射出去[25]。在正常情况下,用来进行光化学反应的能量占叶绿素吸收光能的大部分,仅有少部分以热或荧光的形式耗散掉。但是当植物受到胁迫时,植物的光反应能力将下降,而热耗散和叶绿素荧光形式的耗散将增加,因此,叶绿素荧光动力学的变化过程可以用来反映植物受到环境胁迫的情况。
三氯生暴露使羊角月牙藻 RC/CSo、φPo、Sm、OEC和PIabs等指数大幅下降,表明了三氯生使羊角月牙藻的PSII反应中心受损,抑制了光合作用的原初反应,阻碍了光合电子传递的过程。这与红霉素对羊角月牙藻的的作用机制类似[17]。Ricart等[26]发现,三氯生会对藻类光合作用系统产生损害,藻类光合作用效率降低是藻类光合作用系统结构水平上受到损害的前兆。脂质不仅是复合体上内囊体基质的主要组成部分,同时也是PSII在装配和修复过程中的重要组成部分[27]。三氯生可通过抑制酰基载体蛋白还原酶从而抑制脂肪酸的形成,进而抑制脂质的形成。脂质合成的受阻会导致PSII反应中心功能受阻,从而使原初光化学反应等重要过程无法完成,因此,RC/CSo和φPo等指标大幅下降。Kanervo等[28]发现D1蛋白的功能取决于内囊体膜上脂质的不饱和程度,而参与构成PSII反应中心的D1蛋白,是维持QB蛋白稳定的重要因素之一[29],由于三氯生暴露使D1蛋白合成受阻,导致QB易于从类囊体膜上脱落,使PSII受体库减小,Sm下降。此外,PSII反应中心的受损,也影响到了OEC的正常组装,使OEC的比例大幅下降,继而影响水的光解。
3.3 三氯生对羊角月牙藻抗氧化酶系的影响
GST具有消除体内自由基和解毒双重功能,是一种重要的解毒酶,能催化内源小分子GSH与许多次级底物结合,包括脂质过氧化的次级产物,从而解除外源性污染物的毒性[30]。实验表明,随三氯生暴露浓度增加,羊角月牙藻体内的GST活性也呈现出升高的趋势。GST的活性与外源化合物的解毒和排除密切相关,GST活性的升高是生物体抵御外源污染物的一种应激反应机制。这可能与生物在外源污染物胁迫下产生活性氧自由基有关。有文献报道,三氯生暴露可显著诱导体内自由基的产生和积累[31]。本研究中MDA的持续升高也间接印证了三氯生引起了藻类体内自由基的产生,随着自由基的积累从而诱导GST活性升高;但随着三氯生暴露浓度的持续增加,高于 0.128 mg·L–1时,GST 的诱导呈现下降趋势,这可能是由于过高浓度三氯生造成大量自由基产生并在体内积累,抑制了GST酶的活性,这种GST活性在低浓度污染物暴露呈现诱导而高浓度暴露下降的变化在许多水生生物对污染物的暴露中均有报道[32-36]。
CAT是植物体内一种重要的抗氧化酶,能催化H2O2生成H2O与O2,以减轻H2O2对细胞的氧化损伤。在低浓度的三氯生暴露下,羊角月牙藻体内的CAT活性受到明显的诱导,并且随着三氯生浓度的增大而升高。这说明此时三氯生的暴露已经对羊角月牙藻产生了氧化胁迫作用,诱导抗氧化酶活性的启动。随着三氯生浓度继续增加,超过了藻细胞的耐受极限,从而使CAT活性下降,羊角月牙藻生长受到明显抑制。Canesi等[37]研究发现,三氯生暴露导致地中海贻贝的消化腺CAT活性急剧下降,其可能原因是三氯生会影响酶参与维护生物机体的氧化还原平衡。CAT的下降反映出为抵御外源亲电基团的氧化,细胞体内需要消耗还原性物质同时抗氧化酶活性下降,并伴随氧化产物MDA含量逐渐增加,也间接地反映出细胞损伤的程度[38]。
GSH是生物体内重要的非酶系抗氧化系统的成分,其既可由于污染物的暴露而产生适应性诱导反应[39],也可由于污染物的毒性作用大量耗竭,导致生物体内GSH含量降低[40-41]。三氯生对羊角月牙藻体内的GSH的合成无直接抑制效应,羊角月牙藻经过96 h的暴露,GSH含量总体处于被诱导状态,但当三氯生浓度达到 0.256 mg·L–1时,GSH 含量并没有显著增加。在蛋白核小球藻受到诺氟沙星药物暴露过程中的GSH含量变化也有类似表现[42]。这可能和藻类体内还存在其他可猝灭氧化自由基的还原性小分子(如抗坏血酸等)有关,但本实验没有同时测定其他还原性小分子变化,所有不能解释GSH相对稳定的变化原因,这需要在今后的工作中进一步深入研究和探讨。
MDA含量的上升指示了膜脂质过氧化以及氧化胁迫的存在。膜脂质过氧化由ROS引发并严重影响生物膜的功能及完整性,并对细胞造成不可逆的损伤[43]。本研究中,三氯生为光合作用抑制剂,它们可以阻断羊角月牙藻PSII电子传递,使处于激发态的叶绿素分子可自发转变为三线态叶绿素,进而促使 O2转变为 ROS,从而导致氧化胁迫的产生[44],这一点也可从本实验中3种抗生素导致羊角月牙藻MDA含量的显著上升予以证明。
综上所述,三氯生对羊角月牙藻96 h-EC50为0.112 mg·L-1,对羊角月牙藻属于高毒物质。三氯生对羊角月牙藻叶绿素荧光动力学ABS/RC、PIabs、RC/CSo和OEC比例等参数变化比较敏感。随着三氯生浓度的增大,羊角月牙藻的叶绿素荧光中ABS/RC大幅上升,PI-abs、RC/CSo和OEC的比例下降,当三氯生浓度为0.256mg·L-1时,ABS/RC 达到最大值,PIabs、RC/CSo和OEC比例下降为最小值,表明藻细胞光合作用的原初反应及电子链传递过程受到严重阻碍。三氯生对羊角月牙藻体内抗氧化酶系中GST活性和MDA也有较大影响。在低浓度暴露下,GST活性随TCS浓度增加而增大,但当TCS浓度超过0.256 mg·L-1时,GST 活性出现显著下降,同时MDA的含量达到最大,这种GST活性的下降同时伴随MDA含量的增加表明,藻细胞膜系统受到较大损害。因此,光合作用过程叶绿素荧光动力学参数,如 ABS/RC、PIabs、RC/CSo和 OEC,以及抗氧化酶系统中GST和MDA可以作为有效的指标参数用于三氯生的毒性的评价。
[1] Corteza F S,Seabra Pereira C D,Santos A R,et al.Biological effects of environmentally relevant concentrations of the pharmaceutical triclosan in themarinemussel Perna perna(Linnaeus,1758)[J].Environmental Pollution,2012,168:145-150
[2] Sanderson H,Brain R A,Johnson D J,et al.Toxicity classification and evaluation of four pharmaceuticals classes:Antibiotics,antineoplastics,cardiovascular,and sex hormones[J].Toxicology,2004,203(1):27-40
[3] 周雪飞,陈家斌,周世兵,等.三氯生检测方法的建立与优化[J].中国给水排水,2010,26(12):126-129 Zhou X F,Chen JB,Zhou SB,et al.Determination of triclosan in wastewater and sludge treatment by USE/SPE-HPLC[J].ChinaWater& Wastewater,2010,26(12):126-129(in Chinese)
[4] 周世兵,周雪飞,张亚雷,等.三氯生在水环境中的存在行为及迁移转化规律研究进展[J].环境污染与防治,2008,30(10):71-74 Zhou SB,Zhou X F,Zhang Y L,et al.The research for occurrence,transport and transformation rules of triclosan in water environment[J].Environmental Pollution& Control,2008,30(10):71-74(in Chinese)
[5] Peng X Z,Yu Y Y,Tang C M.Occurrence of steroid estrogens,endocrine-disrupting phenols,and acid pharmaceutical residues in urban riverine water of the Pearl River Delta,South China[J].Science of the Total Environment,2008,397(1-3):158-156
[6] Coogan M A,Edziyie R E,La point TW,et al.Algal bioaccumulation of triclocarban,triclosan,and methyltriclosan in a North Texaswastewater treatment plant receiving stream [J].Chemosphere,2007,67(10):1911-1918
[7] Adolfsson-Erici M,Petterssona M,Parkkonen J,et al.Triclosan,a commonly used bactericide found in human milk and in the aquatic environment in Sweden [J].Chemosphere,2002,46(9-10):1485-1489
[8] Milagros M,Gomez M J,Imma F,et al.Evidence of 2,7/2,8-dibenzodichloro-p-dioxin as a photodegradation product of triclosan in water and wastewater samples[J].Analytica Chimica Acta,2004,524(1):241-247
[9] 曹光群,陈忠良,宋启军.三氯生的光降解产物分析及相关日化产品的安全性研究[J].分析实验室,2008,27(8):58-61 Cao G Q,Chen Z L,Song Q J.Analysis of the photodegradation products of triclosan and the safety study of related daily-used chemical products[J].Chinese Journal of Analysis Laboratory,2008,27(8):58-61(in Chinese)
[10] Rule K L,Ebbett V R,Vikesland P J.Formation of chloroform and chlorinated organics by free-chlorine-mediated oxidation of triclosan[J].Environmental Science& Technology,2005,39(9):3176-3185
[11] 李林朋,马慧敏,胡俊杰,等.三氯生和三氯卡班对人体肝细胞DNA损伤的研究[J].生态环境学报,2010,19(12):2897-2901 Li L P,Ma H M,Hu JJ,etal.The genotoxicity of triclosan and triclocarban in human hepatocyte L02 cell[J].Ecology and Environmental Sciences,2010,19(12):2897-2901(in Chinese)
[12] Gee R H,Charles A,Taylor N,et al.Oestrogenic and androgenic activity of triclosan in breast cancer cells[J].Journal of Applied Toxicology,2008,28(1):78-91
[13] Kobraei M E,White D S.Effects of 2,4-Dichlorohenoxyacetic acid on Kentucky algae:Simultaneous laboratory and field toxicity tests[J].Archives of Environmental Contamination and Toxicology,1996,31(4):571-580
[14] 唐丽,孙秀发,张军,等.三氯生对大鼠脂肪代谢的影响[J].中国药理学与毒理学杂志,2002,16(1):70-74 Tang L,Sun X F,Zhang J,et al.Effects of triclosan on fatmetabolism in rats[J].Chinese Journal of Pharmacology and Toxicology,2002,16(1):70-74(in Chinese)
[15] 姜淑卿,周蕾,李怡岚,等.三氯生亚急性经口毒性的研究[J].中国职业医学,2006,12(6):432-434 Jiang SQ,Zhou L,Li Y L,et al.Subacute toxicity of triclosan in rats[J].China Occupational Medicine,2006,12(6):432-434(in Chinese)
[16] 伍筱琳,刘仁沿,李红霞,等.三氯生对小球藻的生长效应研究[J].海洋通报,2009,28(3):117-120 Wu X L,Liu R Y,LiH X,etal.Effects of triclosan on the growth of chlorella spp[J].Marine Science Bulletin,2009,28(3):117-120(in Chinese)
[17] Liu B Y,Nie X P,Liu W Q,et al.Toxic effects of erythromycin,ciprofloxacin and sulfamethoxazole on photosynthetic apparatus in Selenastrum capricornutum[J].Ecotoxicology and Environmental Safety,2011,74(4):1027-1035
[18] 王学奎.植物生理生化实验原理和技术(第二版)[M].北京:高等教育出版社,2002:220-227
[19] Appenroth K J,Stöckel J,Srivastava A,etal.Multiple effects of chromate on the photosynthetic apparatus of Spirodela polyrhiza as probed by OJIP chlorophyll a fluorescencemeasurements[J].Environmental Pollution,2001,115(1):49-64
[20] Strasser B J,Strasser R J.Measuring fast fluorescence transients to address environmental questions:The JIP test[G] //Mathis P.Photosynthesis:From Light to Biosphere(5th).Dordrecht:Kluwer Academic Publisher,1995:977-980
[21] 国家环保局.水生生物监测手册[M].南京:东南大学出版社,1993:192-202
[22] 洪华嫦,周海云,蓝崇钰.五氯酚对斜生栅藻的毒性效应研究[J].环境科学研究,2003,16(6):23-25,28 Hong H C,Zhou H Y,Lan CY.Toxicity effects of pentachlorophenol on the growth,the contents of pigments and soluble protein of Scenedesmus obliquus[J].Research of Environmental Sciences,2003,16(6):23-25,28(in Chinese)
[23] 牟文,熊丽,胡芹芹,等.HgCl2对斜生栅藻(Scenedesmus obliquus)生理生化特性的影响[J].生态毒理学报,2009,4(6):854-859 Mu W,Xiong L,Hu Q Q,et al.Effects of HgCl2on physiological and biochemical characteristics of Scenedesmus obliquus[J].Asian Journal of Ecotoxicology,2009,4(6):854-859(in Chinese)
[24] Morant-Manceau A,Pradier E,Tremblin G.Osmotic adjustment,gas exchanges and chlorophyll fluorescence of a hexaploid triticale and its parental species under salt stress[J].Journal of Plant Physiology,2004,161(1):25-33
[25] Strasser R J,Tsimill-MichaelM,Srivastava A.Analysis of the chlorophyll a fluorescence transient[G]//Pagageorgiou G,Govindjee.(Eds.)Advances in Photosynthesis and Respiration,Chapter 12.Dordrecht:KAP Press,2004:1-47
[26] RicartM,Guasch H,Alberch M,et al.Triclosan persistence through wastewater treatment plants and its potential[J].Aquatic Toxicology,2010,100(4):346-353
[27] Naoki M,Hajime W.The role of lipids in photosystem II[J].Biochimica et Biophysica Acta,2012,1817(1):194-208
[28] Kanervo E,Tasaka Y,Murata N,et al.Membrane lipid unsaturation modulates processing of the photosystem II reaction-center protein D1 at low temperatures[J].Plant Physiology,1997,114(3):841-849
[29] Strasser B J.Donor side capacity of photosystem II probed by chlorophyll a fluorescence transients[J].Photosynthesis Research,1997,52(2):147-155
[30] Mitchell A E,Lakritz J,Jones A D.Quantification of individual glutathione S-transferase isozymes in hepatic and pulmonary tissues of naphthalene-tolerantmice[J].Archives of Toxicology,2000,74(4-5):215-221
[31] Binelli A,Parolini M,Pedriali A,et al.Antioxidant activity in the zebra mussel(Dreissena polymorpha)in response to triclosan exposure[J].Water,Air& Soil Pollution,2011,217(1-4):421-430
[32] Binelli A,Cogni D,Parolini M,et al.In vivo experiments for the evaluation of genotoxic and cytotoxic effects of triclosan in zebra mussel hemocytes[J].A-quatic Toxicology,2009,91(3):238-244
[33] 周启星,孔繁翔,朱琳.生态毒理学[M].北京:科学出版社,2004:55-110
[34] 王朋,温蓓,张淑贞.环丙沙星对玉米芽期抗氧化酶活性及自由基代谢的影响[J].环境化学,2011,30(4):753-759 Wang P,Wen B,Zhang SZ.Influence of ciprofloxacin(CIP)on antioxidative enzymes and free radical levels in maize(Zea mays L.)early stage development[J].Environmental chemistry,2011,30(4):753-759(in Chinese)
[35] 李燕,朱琳,刘硕.铅、汞单一及联合胁迫对栅藻的生长、GSH含量及相关酶活性的影响[J].环境科学,2009,30(1):248-253 Li Y,Zhu L,Liu S.Individual and joint stress of lead and mercury on growth,glutathione and glutathione-related enzymes of Scenedesmus quadricauda[J].Environmental Science,2009,30(1):248-253(in Chinese)
[36] Sinha S,Basant A,Malik A,etal.Iron-induced oxidative stress in a macrophyte:A chemometric approach[J].Ecotoxicology and Environmental Safety,2009,72(2):585-595
[37] Canesl L,Ciacci C,Lorusso L C,et al.Effects of triclosan on Mytilus galloprovincialis hemocyte function and digestive gland enzyme activities:Possiblemodes of action on non-target organisms[J].Comparative Biochemistry and Physiology Part C:Toxicology&Pharmacology,2007,145(3):464-472
[38] 吴伟,瞿建宏,陈家长,等.多氯联苯(PCBs)胁迫下鲫鱼肝脏EROD酶活性与血清性激素含量的相关性研究[J].生态与农村环境学报,2006,22(4):52-56 Wu W,Qu JH,Chen JC,et al.Correlation between EROD activity in liver and sex hormone in blood serum of Carassius auratus under stress of polychlor inated biphenyls[J].Journal of Ecology and Rural Environment,2006,22(4):52-56(in Chinese)
[39] 于方明,仇荣亮,胡鹏杰,等.不同Cd水平对小白菜叶片抗氧化酶系统的影响[J].农业环境科学学报,2007,26(3):954-956 Yu FM,Qiu R L,Hu P J,et al.Effects of different cadmium levels on the antioxidative enzymes activities of leaf in Brassica chinensis[J].Journal of Agro-Environment Science,2007,26(3):954-956(in Chinese)
[40] Xu Z R,Bai S J.Effects of waterborne Cd exposure on glutathione metabolism in Nile tilapia(Oreochromis niloticus)liver[J].Ecotoxicology and Environmental Safety,2007,67(1):89-94
[41] 马剑敏,蔡林林,胡灵卫,等.溴化1-己基-3-甲基咪唑对斜生栅藻谷胱甘肽及其代谢酶的影响[J].水生生物学报,2009,33(4):696-701 Ma JM,Cai L L,Hu LW,et al.Responses of glutathione cycle enzymes and glutathione metabolism to 1-hexyl-3-methyl imidazolium stress in Scenedesmus obliquus[J].Acta Hydrobiologica Sinica,2009,33(4):696-701(in Chinese)
[42] 聂湘平,王翔,陈菊芳,等.三氯异氰尿酸与盐酸环丙沙星对蛋白核小球藻的毒性效应[J].环境科学学报,2007,27(10):1694-1701 Nie X P,Wang X,Chen JF,etal.Toxic effects of trichloroisocyanuric acid and ciprofloxacin hydrochloride on a freshwater alga,chlorellapyrenoidosa[J].Acta Scientiae Circumstantiae,2007,27(10):1694-1701
[43] Aravind P,Prasad M N V.Modulation of cadmium-induced oxidative stress in Ceratophyllum demersum by zinc involves ascorbate-glutathione cycle and glutathione metabolism [J].Plant Physiology and Biochemistry,2005,43(2):107-116
[44] Nemat Alla M M.Glutathione regulation of glutathione S-transferase and peroxidase activity in herbicide-treated Zea mays [J].Plant Physiology and Biochemistry,1995,33(2):185-192 ◆
