一种简单高效的水稻体细胞诱变育种新方法*
2013-08-15林建中杨远柱符辰建杜长青胡小淳唐冬英赵小英史江伟朱咏华刘选明
林建中,杨远柱,周 波,符辰建,杜长青,胡小淳,唐冬英,赵小英,史江伟,朱咏华,刘选明†
(1.湖南大学 生物学院,植物功能基因组学与发育调控湖南省重点实验室,湖南 长沙 410082;2.湖南亚华种业科学研究院,湖南 长沙 410001)
水稻(Oryza sativa L.)是世界上重要的经济谷类作物,有超过一半的世界人口以大米作为主食.然而,随着人口的不断增长和耕地的减少,据估计到2030年大米的需求将比现在提高40%[1].因此,很有必要通过各种育种方法以提高水稻产量.
育种是一个从大量株系中筛选出理想表型株系的过程,这些大量的株系一般来源于自然和人工突变以及杂交重组.因突变可能产生的优良种质是育种的一个重要来源.多样化的种质资源对水稻育种非常重要,如提高产量以及其他农艺性状的改良等[2-3].然而,优良品种的筛选需要大量原始育种材料,因而采用新的方法来获得大量多样化的候选株系就显得非常重要.体细胞无性系变异作为一个新的变异来源,引起了遗传学家和育种学家的大量关注[4].许多作物包括玉米和水稻[5]等已被用于组织培养和体细胞无性系变异研究[5-7],为作物育种提供了一种新的诱变途径.体细胞的诱导突变能够获得相当丰富的遗传变异,又因其容易应用和推广而具有很高的实用价值[8-9].突变体因染色体数目改变、点突变、结构性染色体重排等原因而引起表型改变,而且该表型还可以稳定遗传.因此,以此为基础可以培育新的作物优良品种.
体外培养诱导突变所涉及的因素包括培养基的成分(各种盐类、激素和有机物质等)和培养条件(温度、光照和培养时间等)[10].诱变造成组织培养细胞的突变可能是一个或多个诱变因素.迄今,在水稻诱变育种方面还未见以高浓度2,4-D为诱变剂的诱变育种方法的报道.在本研究中,我们分别研究了继代培养时间、2,4-D浓度和不同外植体对突变频率的影响,建立了一种以幼穗为外植体和4.0mg/L 2,4-D诱变处理的水稻体细胞无性系诱变育种方法.同时,利用该诱变方法从水稻品种株1S和中9B中分别成功选育了2个稳定的优良矮秆突变株系SV14S和SV9B,并进一步证实了该水稻体细胞诱变育种方法的有效性.
1 材料与方法
1.1 实验材料
本研究所用的植物材料为4个籼稻品种株1S,中9B,316B和R527,均为华南地区的杂交水稻骨干亲本.株1S为湖南省株州市农科所培育的籼型光温敏核不育水稻[11],中9B和316B是优良三系保持系,而R527是一种优良的恢复系.
株1S用于进行各种诱变因素的优化实验.当最优诱变体系建立后,中9B,316B和R527用于后续的诱变育种实验,用以对该诱变方法加以验证.
1.2 实验方法
1.2.1 培养基和培养条件
选用MS为基本培养基[12],蔗糖浓度为3.0%,用0.8%的琼脂或0.4%植物凝集素固化,pH 为5.8~6.0,在121℃湿热高压灭菌20min,不同发育阶段添加不同的激素(见表1).培养温度为25±1℃,光照强度为2 000lx,光照时间为12h光照/12h黑暗.

表1 培养基类型与成分Tab.1 The category and components of medium
1.2.2 外植体的获取和愈伤组织的诱导
幼穗采集自水稻花粉母细胞形成时期,约2~3 cm长,与外面包裹的2层叶鞘一并采集.采集的幼穗可以在4℃冰箱中保存7d.将幼穗外层叶片剥去,保留旗叶鞘,置于70%酒精中浸泡1min,再置于10%NaClO中表面消毒10min.于超净工作台用无菌水冲洗4~5次,除去包裹着的旗叶鞘,将幼穗切成1cm左右的小段,接种于诱导培养基中以获得愈伤组织(图1(a)).幼胚采集自水稻受精后10~15d的幼嫩种子,其表面消毒过程与幼穗一样.于超净工作台用镊子将幼胚从颖壳内挤压出来,然后接种在诱导培养基中以获得愈伤组织.成熟胚来自除去颖壳的成熟种子,其表面消毒过程与幼穗一样.最后将除去颖壳的成熟种子接种于诱导培养基中以获得愈伤组织.
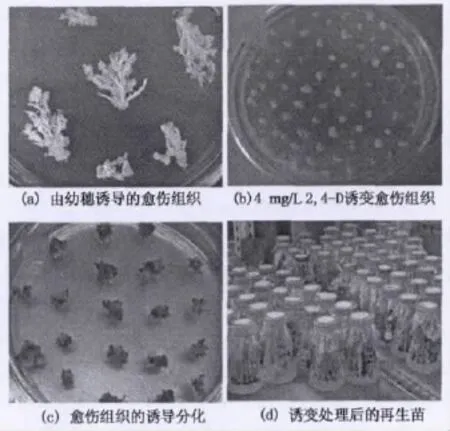
图1 水稻体细胞无性系诱变程序Fig.1 The procedure of somatic mutagenesis
1.2.3 继代时间对植株再生的影响
选取由株1S幼穗经过21d诱导培养所得的新鲜愈伤组织,接种于继代培养基中进行继代培养.以25d为一个继代培养周期,将愈伤组织分别继代培养1~9个周期.然后将经过不同时间继代培养的愈伤组织转移至分化培养基中进行分化培养,28d后统计愈伤组织的分化率.
1.2.4 2,4-D浓度对诱变频率的影响
选取由株1S幼穗经过3周诱导培养所得的新鲜愈伤组织,先于继代培养基中继代培养1个周期.然后将愈伤组织转移至分别添加2.0,2.5,3.0,3.5,4.0,4.5和5.0mg/L 2,4-D的 MS基本培养基中,诱变处理1个周期(图1(b)).经诱变处理的愈伤组织再转移至继代培养基中继代培养1个周期,以恢复其活力.最后选取活力较好的胚性愈伤组织进行分化和生根培养(图1(c)和(d)),所得分化苗(R1)经炼苗后移栽至大田中.抽穗期套袋使其自交结实,并单株收种(R2).再将收集的种子按株系播种于大田中,按照刘选明等[13]方法于整个生长发育时期考察R2代株系的农艺性状.与对照(未经诱变的植株)相比,只要某个肉眼可见的性状发生显著变异即被视为突变株系.诱变频率计算公式为:诱变频率=变异株系数/总的再生株系数×100%.
1.2.5 不同外植体对诱变频率的影响
分别选取株1S的幼穗、幼胚和成熟胚作为外植体诱导愈伤组织.先继代1个周期,然后在4.0mg/L 2,4-D的 MS培养基上诱变1个周期.其后的步骤与2,4-D浓度对诱变频率影响的实验方法相同.最后分别统计3种外植体对诱变频率的影响.
1.2.6 矮秆突变体的筛选和表型鉴定
具体方法参照我们先前发表的一篇论文[14],主要于R2代考查其株高性状,并观察其性状分离情况.对于比原亲本水稻株高有所降低而且能稳定遗传的突变株系,于抽穗期套袋使其自交结实和采收种子(R3),同时考察和评价其农艺性状.对符合目标性状且稳定遗传的变异株即为优良诱变品种(系).
1.2.7 茎的单位长度干物质含量分析
于成熟期分别随机选择株1S和SV14S各20株,先测量整个茎秆的长度,然后将各节间分开,分别测量各节间长度.将各节间再置于50°C烘箱烘烤16h,于分析天平称取各节间重量.最后,根据所得的数据,计算整个茎秆和各节间重量(mg)/长度(cm)的比值.另外,统计突变株系SV14S的重量(mg)/长度(cm)比值的增加率.其计算公式为:增加率=[SV14S的比值(mg/cm)-株1S的比值(mg/cm)]/株1S的比值(mg/cm)×100%.
2 结果与讨论
2.1 继代时间对植株再生的影响
已有研究发现[15],组织培养的体细胞变异频率随培养时间的延长而提高.但是随着培养时间的延长,其愈伤组织的分化频率也急剧下降,往往导致再生苗分化的极度困难.因此,我们首先研究了继代时间对植株再生的影响,以寻找愈伤组织的最佳继代时间.以25d为一个培养周期,挑取刚从株1S幼穗诱导出来的颜色淡黄、质地致密的胚性愈伤组织于继代培养基进行继代培养,分别继代0~9个周期,然后转接到分化培养基上观察并统计分化频率.其中,继代0周期的胚性愈伤组织即为刚从幼穗诱导出来的胚性愈伤组织转接到分化培养基.实验结果发现,当继代4个周期以上,其愈伤组织的分化频率急剧下降,由继代3个周期时的59.0%急降至15.8%左右(图2(a)).因此,为了保持较高的分化频率和变异频率(由继代时间决定),我们认为在高浓度2,4-D诱变处理前的最佳继代时间为3个周期.
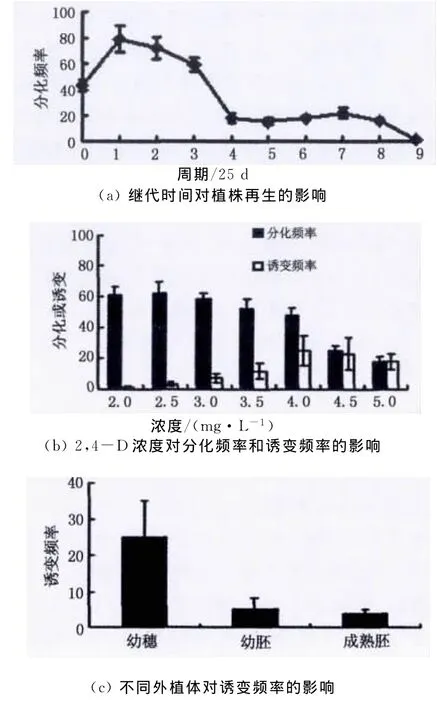
图2 影响植株再生和诱变频率因素的分析Fig.2 Effect of factors on the frequencies of plant regeneration and mutagenesis
2.2 2,4-D浓度对诱变频率的影响
2,4-D作为一种人工合成的生长素类的植物激素被广泛应用于各种植物组织培养中,主要用于愈伤组织的诱导[16-17].但是我们发现,当经高浓度2,4-D处理后的愈伤组织其突变率显著增加(图2(b)).同时也发现,随着2,4-D浓度的升高(>3.0 mg/L)以及处理时间的延长,愈伤组织的活力也显著降低,容易褐化死亡,严重影响了后续的分化频率.因此,综合考虑分化和变异频率,应以变异频率较高而分化频率不能太低,即分化频率下降曲线与变异频率上升曲线交叉点的2,4-D浓度为最佳诱变浓度.从图2(b)可看出,2,4-D的最佳诱变浓度为4.0mg/L.值得特别指出的是,愈伤组织在4.0 mg/L 2,4-D的继代培养基中的诱变时间不能超过1个周期(约25d),否则后续的分化频率很低,而且大多数愈伤组织会褐化坏死(结果未列出).
2.3 不同外植体对诱变频率的影响
在水稻组织培养中,一般选用幼穗、幼胚和成熟胚作为外植体[13,16-17].在3种外植体中,究竟哪种最适合作为体细胞无性系变异的外植体呢?迄今还未见相关研究内容的文献报道.于是我们研究了水稻幼穗、幼胚和成熟胚等3种外植体对诱变频率的影响.研究结果发现,由幼穗诱导的愈伤组织的诱变频率达到了24.7%,由幼胚诱导的为5.2%,而由成熟胚诱导的仅为3.8% (图2(c)).在单一性状的变异方面,由幼穗诱导的愈伤组织的诱变频率也很高.如由株1S幼穗诱导、诱变和再分化得到的500株分化苗中,经在海南陵水基地的表型鉴定,发现共有24株表现出株高不同程度的矮化.就株高性状的变化来说,其突变率达到了4.8% (24/500)(表2).而由成熟胚诱导的愈伤组织经诱变和再分化后得到的分化苗中,几乎没有发现矮化突变株(结果未列出).由此可以看出,在体细胞无性系诱变的外植体中,幼穗明显优于幼胚和成熟胚.其可能的原因是处于花粉母细胞形成时期的水稻细胞在离体培养条件下对外界环境更敏感,更易发生变异.另外,幼穗作为外植体还有具有愈伤组织诱导率高和活力强等优势(结果未列出).因此,体细胞无性系诱变育种的最佳外植体为幼穗.
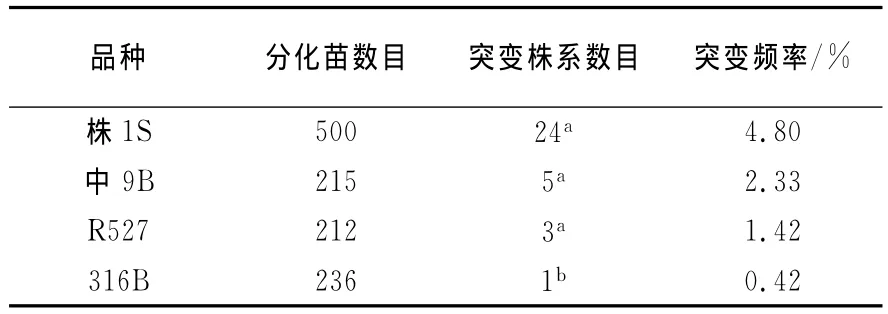
表2 不同基因型水稻的R2代体细胞无性系中的单一性状的突变频率Tab.2 Frequencies of one trait mutations in R2lines of somaclones of different genotypes of Oryza sativa L.
2.4 不同品种的体细胞突变频率的分析
通过上面以株1S为材料进行的继代时间、2,4-D浓度和不同外植体对诱变和分化频率的影响,初步建立了以幼穗为外植体,以4.0mg/L 2,4-D为最佳诱变浓度的体细胞无性系诱变方法.为了进一步验证该方法的有效性,我们对包括株1S在内的水稻品种中9B,R527和316B等进行了无性系诱变.为了实验的准确性,仅以单一性状的突变进行统计分析.在生产中,株1S,中9B和R527的株高偏高,导致所配组合抗倒伏性差,而316B的种子颖壳闭合度差,容易导致种子霉变和发芽率降低.因此,在株1S,中9B和R527中,以矮秆或半矮秆突变株系进行统计分析,而316B则以种子颖壳闭合度好的突变株系进行统计分析.实验结果发现,诱变频率最高的是株1S,在500株分化苗中共得到了24个矮化变异株系,其诱变频率达到了4.8% (24/500).诱变效率最低的是316B,在236株分化苗中仅得到了1个种子颖壳闭合度较好的突变株系,其诱变频率仅为0.42% (1/236).中9B和R527分别为2.33%和1.42% (表2).由此说明,体细胞无性系的突变率还取决于品种间的基因型差异.
2.5 矮秆突变株系的表型分析
在株1S的24个SV矮化突变株系中,选取了SV5S,SV10S和SV14S等3个综合农艺性状较优的变异株系,对它们的株高和各节间长度进行了分析.由于在不育状态时不育系水稻的穗不能完全从旗叶的叶鞘中伸展出来,对植株高度的测量产生很大的影响[18-19].因此,亲本株1S和其SV突变体(R3)都是经20℃低温处理使其育性恢复后于成熟期测量株高及节间长度(表3).从表中的统计结果可知,在株高上出现株1S,SV10S,SV14S和SV5S依次变矮的顺序,其节间特别是基部的节间明显缩短,而穗长却缩短幅度很小.该结果说明,矮化突变体能显著提高抗倒伏性.通过进一步综合农艺性状的鉴定和评价,发现SV14S的各种农艺性状更加优良[13].于是我们检测了株1S和SV14S各节间及整个茎秆的单位长度干物质含量,以进一步研究SV14S的抗倒伏能力.实验结果发现,除了第一节间外,SV14S其它节间的单位长度干物质含量均比亲本株1S高(表4).该结果说明,突变体SV14S既能增加抗倒伏性,又能提高产量.杂交配组实验也进一步说明了SV14S的优良抗倒伏性能.如SV14S与恢复系912的杂种后代(F1)的抗倒伏性明显优于株1S与912的杂种后代(结果未列出).因此,突变株系SV14S在杂交水稻育种中具有良好的应用前景.另外,我们还对突变株系SV14S进行了相关分子生物学分析,并在基因水平上证明该突变体确实发生了稳定变异,具体结果见先前发表的相关文章[14,20-21].
在中9B的5个SV矮化突变株系中,经过3~4代的考察和评价,选取了其中综合农艺性状最优的矮化株系命名为SV9B,并对其农艺性状进行了考察和评价.图3显示了SV9B和对照亲本中9B的植株形态、株高和各节间长度.从图可知,中9B和SV9B的植株高度分别为93cm和75cm,SV9B的株高明显低于对照亲本中9B(图3(a)和(b)),而且SV9B的各节间均缩短,其中基部节间长度缩短明显,而上部节间长度缩短幅度较小(图3(c)和(d)).特别是SV9B的III节间的缩短幅度最大,还不到中9B的III节间长度的一半.另外,我们还测量了中9B和SV9B成熟穗的农艺性状(图4和表5),发现与对照亲本中9B相比,SV9B的穗长几乎没有变化,初级小穗数和千粒重稍微降低,而次级小穗数和每穗粒数却显著增加.同时,SV9B的种子比中9B的种子更加饱满(图4(c)).这些结果说明,突变体SV9B不仅增加了抗倒伏性,而且提高了单株产量,具有良好的应用前景.

图3 SV9B和亲本中9B的表型Fig.3 Phenotypes of SV9Band its parent Zhong 9B
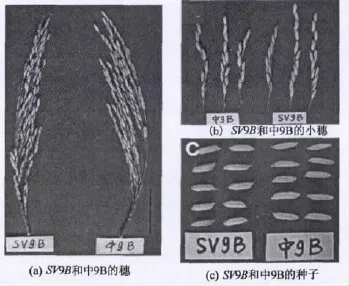
图4 SV9B和亲本中9B穗的性状Fig.4 Panicle traits of SV9Band its parent Zhong 9B
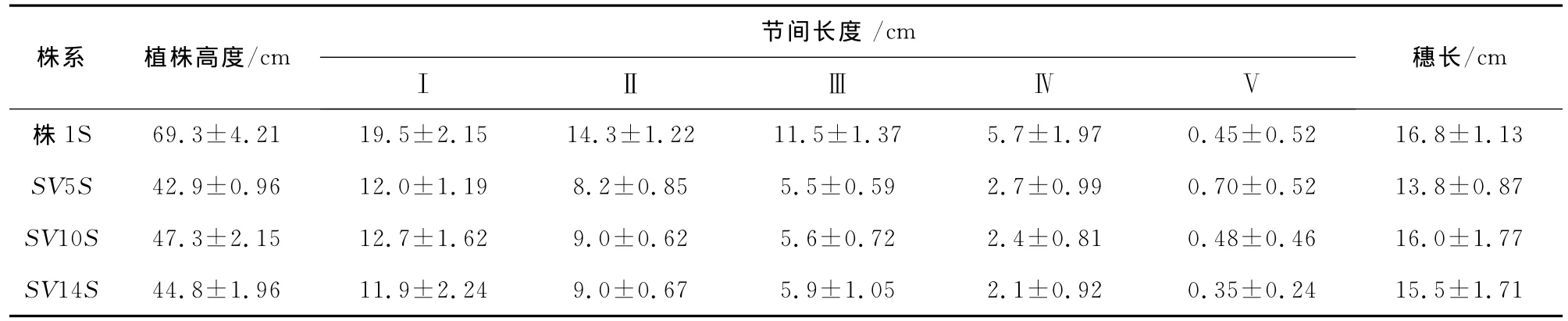
表3 株1S的体细胞突变株系的植株及节间高度Tab.3 Plant height of somatic variant lines derived from Zhu1Sin R3generation
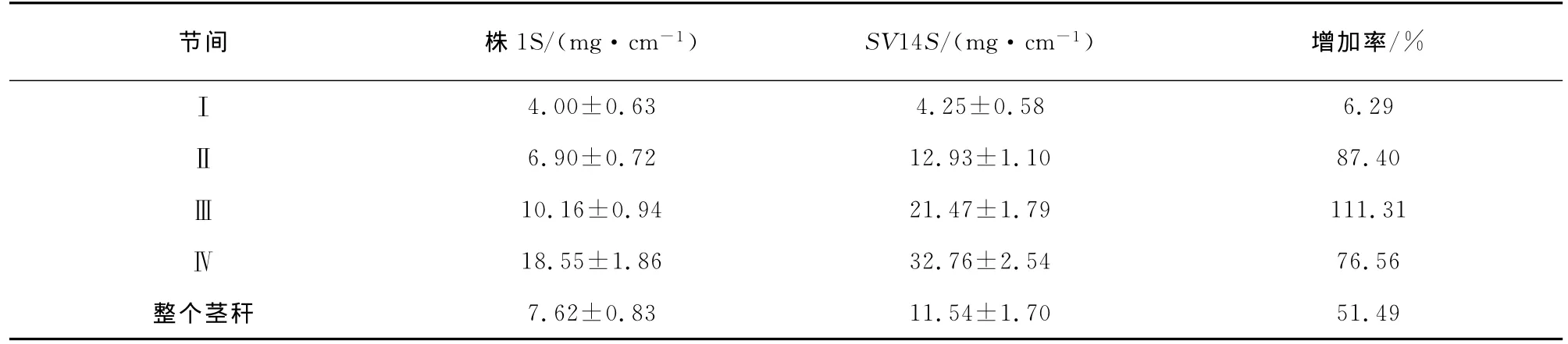
表4 SV14S和亲本株1S各节间及整个茎秆的单位长度干物质含量Tab.4 The dry matter content per unit length of each internode and overall culm of SV14Sand its parent Zhu1S

表5 SV9B和亲本中9B的穗的性状比较Tab.5 Comparison of panicles of SV9Band its parent Zhong 9B
优良矮秆突变株系SV14S和SV9B的成功选育为后续的传统杂交育种提供了优质种质资源.随后,以SV14S与优质抗稻瘟病父本ZR02杂交,通过“人工低温与自然低温双重压力选择”和定向培育,育成优质两用核不育系湘陵628S(品种授权号:CNA20070803.1).用该亲本选配的杂交组合在国家和湖南省区试评比中农艺性状表现优异(结果未列出),已获准大面积商业推广.如超级杂交早稻组合陵两优268,两年国家区试第一名,已通过国家审定.同样,利用SV9B与三系胞质不育系T98A测交、多代回交选育出抗倒伏的优质三系胞质不育系SV9-16A,利用该亲本选育的优质超级杂交稻组合即将应用于生产.总之,这些卓有成效的育种成果的取得进一步证实,利用幼穗为外植体和2,4-D为诱变剂的水稻体细胞诱变育种方法是一种简单有效的新型育种方法.同时也说明,在整个诱变和后续的选育过程中,如果结合一定的选择压力可以有效加快育种进程.
3 结 论
在本研究中,通过研究继代时间、2,4-D浓度和不同外植体对诱变和分化频率的影响,初步建立了以幼穗为外植体、诱变前继代培养时间为3个周期(约75d)以及以4.0mg/L 2,4-D为最佳诱变浓度的体细胞诱变育种方法.同时,利用该方法诱变株1S和中9B,分别成功选育到了优良矮化突变株系SV14S和SV9B,为后续的传统杂交育种提供了优质种质资源.这些育种成果的取得进一步证实了该水稻体细胞诱变育种方法是一种简单有效的新型育种方法.
[1] KHUSH G S.What it will take to feed 5.0billion rice consumers in 2030[J].Plant Mol Biol,2005,59:1-6.
[2] AHLOOWALIA B S,MALUSZYNSKI M.Induced mutations-A new paradigm in plant breeding[J].Euphytica,2001,118:167-173.
[3] JIANG S Y,BACHMANN D,LA H,etal.Ds insertion mutagenesis as an efficient tool to produce diverse variations for rice breeding[J].Plant Mol Biol,2007,65:385-402.
[4] MALUSZYNSKI M,BEANT S,AHLOOWALIA B S.Application of in vivo and in vitro mutation techniques for crop improvement[J].Euphytica,1995,100:1-13.
[5] WU D,SHU Q,XIA Y.In vitro mutagenesis induced novel thermo/photoperiod-sensitive genic male sterile indica rice with green-revertible xanthan leaf color marker[J].Euphytica,2002,123:195-202.
[6] GENGENBACH B G,GREEN C E,DONOVAN C M.Inheritance of selected pathotoxin resistance in maize plants regenerated from cell cultures[J].Proc Natl Acad Sci USA,1977,74:5113-5117.
[7] VENKATAIAH P,CHRISTOPHER T,KARAMPURI S.Selection of atrazine-resistant plants by in vitro mutagenesis in pepper(Capsicum annuum)[J].Plant Cell Tiss Organ Cult,2005,83:75-82.
[8] CHALEFF R S.Isolation of agronomically useful mutants from plant cell cultures[J].Science,1983,214:676-682.
[9] LARKIN P J,RYAN S A,BRETTELL R L,etal.Heritable somaclonal variation in wheat[J].Theor Appl Genet,1984,67:443-455.
[10] LING D H,MA Z R,CHEN W Y,etal.Male sterile mutant from somatic cell culture of rice[J].Theor Appl Genet,1987,75:127-131.
[11] 杨远柱,唐平徕,杨文彩,等.水稻广亲和低温敏两用核不育系株lS的选育及应用技术[J].杂交水稻,2000,3:57-60.YANG Yuan-zhu,TANG Ping-lai,YANG Wen-cai,etal.Breeding and utilization of TCMS line ZhulS in rice[J].Hybrid Rice,2000,3:57-60.(In Chinese)
[12] MURASHIGE T,SKOOG F.A revised medium for rapid growth and bioassays with tobacco tissue cultures[J].Physiol Plantarum,1962,15:473-497.
[13] 刘选明,杨远柱,陈彩艳,等.利用体细胞无性系变异筛选水稻株1S矮杆突变体研究[J].中国水稻科学,2002,18(4):321-325.LIU Xuan-ming,YANG Yuan-zhu,CHENG Cai-yan,etal.Breeding of dwarfing variants with the technique of somaclonal variation for photo-(thermo-)sensitive genic male sterile line ZhulS[J].Chinese Journal of Rice Science,2002,18(4):321-325.(In Chinese)
[14] 林建中,杨远柱,赵小英,等.一种优良半矮秆水稻品种的分离与分子鉴定[J].湖南大学学报:自然科学版,2010,37(8):66-73.LIN Jian-zhong,YANG Yuan-zhu,ZHAO Xiao-ying,etal.Isolation and molecular characterization of semi-dwarf mutations in an elite rice cultivar[J].Journal of Hunan University:Natural Sciences,2010,37(8):66-73.(In Chinese)
[15] 游晴如,黄庭旭,张水金,等.植物诱变新技术及其在水稻育种上的应用[J].江西农业学报,2003,15(2):43-47.YOU Qing-ru,HUANG Ting-xu,ZHANG Shui-jin,etal.New techniques of plant mutation and their application to rice breeding[J].Acta Agriculture Jiangxi,2003,15(2):43-47.(In Chinese)
[16] LIN Y,ZHANG Q.Optimizing the tissue culture conditions for high efficiency transformation of indica rice[J].Plant Cell Rep,2005,23:540-547.
[17] LIN J Z,ZHOU B,YANG Y Z,etal.Piercing and vacuum infiltration of the mature embryo:a simplified method for agrobacterium mediated transformation of indica rice[J].Plant Cell Reports,2009,28:1065-1074.
[18] KOH H J,SON Y H,HEU M H,etal.Molecular mapping of a new genic male-sterility gene causing chalky endosperm in rice(Oryza sativa L.)[J].Euphytica,1999,106:57-62.
[19] DONG N V,SUBUDHI P K,LUONG P N,etal.Molecular mapping of rice gene conditioning thermosensitive genic male sterility using AFLP,RFLP and SSR techniques[J].Theor Appl Genet,2000,100:727-734.
[20] 刘选明,林建中,杨远柱,等.7种水稻光温敏核不育系品种(系)的RAPD多态性分析[J].湖南大学学报:自然科学版,2003,30(1):1-4.LIU Xuan-ming,LIN Jian-zhong,YANG Yuan-zhu,etal.Polymorphisms analysis in seven varieties of rice photo-(thermo-)sensitive genic male sterile-line by RAPD[J].Journal of Hunan University:Natural Sciences,2003,30(1):1-4.(In Chinese)
[21] 袁小川,杨远柱,刘选明,等.雄性核不育水稻矮秆突变体突变分子机制的初步研究[J].生命科学研究,2005,9(2):141-144.YUAN Xiao-chuan,YANG Yuan-zhu,LIU Xuan-ming,et al.A preliminary study on the mutational mechanism of genie male-sterile rice dwarfing mutants[J].Life Science Research,2005,9(2):141-144.(In Chinese)
