59个油橄榄种质的ISSR分子鉴定1)
2013-08-09陈海云宁德鲁李勇杰毛云玲陈少瑜
陈海云 宁德鲁 李勇杰 吴 涛 李 瑞 毛云玲 陈少瑜
(云南省林业科学院,昆明,650204) (云南省森林植物培育与开发利用重点实验室(云南省林业科学院))
油橄榄(OleaeuyopaeaL.),木犀科(Oleaceae)木犀榄属(OleaLinn.)植物,是世界著名的亚热带常绿木本油料树种之一,由于其高含量的不饱和脂肪酸(近90%)[1],日趋受到广大消费者的青睐。油橄榄原产于西亚和地中海地区,19世纪引种到美洲、澳洲和亚洲,从南半球的澳大利亚至北半球的苏联,许多国家都有分布[2]。油橄榄品种繁多,据统计,世界各地油橄榄自产品种共计1 275个,中国现有登记品种共158个[3]。可见,油橄榄的栽培历史悠久,种质资源丰富,其中包含大量的野生种、半野生种和栽培种,而且不同地域间品种交换频繁,导致同名异物或同物异名的现象十分普遍。分子标记对品种的鉴定和分类,实质上是直接在分子水平上对品种基因型的鉴定,其准确度高、效率高且信息量大[4],目前已被广泛应用于植物种质资源鉴定、系谱关系分析等研究中。近年来,国外已有一些采用RAPD、AFLP、SSR和ISSR等分子标记技术进行油橄榄品种鉴定和遗传多样性研究的报道[5-9]。我国于1964年开始油橄榄的引种,之后开展了大量的栽培和品种选育等方面的研究[10],但对于油橄榄种质分子标记方面的研究还非常缺乏,仅见邱源等[11]采用RAPD技术对23个引种的油橄榄品种进行过分类和鉴定研究,以及马万里等[12]运用RAPD技术进行了澳大利亚油橄榄品种的鉴定研究等极少的报道。由此,本研究拟采用成本低、稳定性高、操作简单、重复性强的ISSR分子标记技术[13]对云南省永仁县油橄榄品种资源收集圃中的59个油橄榄引种和选育品种进行遗传多样性和分子鉴定,为这些油橄榄品种资源的规范管理、进一步的科学研究和开发利用提供基础资料。
1 材料与方法
1.1 材料
分析材料来源于收集种植在云南省楚雄州永仁县油橄榄品种(种质)资源收集圃的59个油橄榄品种(表1)。其中:包括41个引种品种(1~41),内含品种名字相同,但引种来源地不同的12个品种(科拉蒂、配多灵、爱桑、米扎、皮瓜尔等);13个国内选育品种(42~55);4个只有编码代号和引种来源地品种(56~59)。以嫩叶为提取基因组DNA的材料。采集嫩叶后放入装有硅胶的自封袋中,带回实验室置冰箱中-20℃保存备用。

表1 59个油橄榄品种原产地、来源及主要用途
1.2 基因组DNA的提取及ISSR-PCR扩增
采用植物基因组DNA提取试剂盒(Tiangen)提取59个油橄榄品种的基因组DNA,0.8%琼脂糖凝胶电泳检测提取的DNA,具体方法见文献[14]。以提取检测后的基因组DNA为模板,进行ISSR引物(北京奥科鼎盛生物技术有限公司合成)筛选,筛选出扩增条带清晰、多态性和重复性较高的引物用以ISSR分析。筛选出的清晰稳定、多态性强的11条引物的序列、退火温度见表2[14]。
扩增体系(20 μL):1×TaqBuffer,3.5 mmol·L-1Mg2+,0.4 mmol·L-1dNTPs,1.0 μmol·L-1引物,1.0 UTaqDNA聚合酶,20 ng DNA模板;反应程序:94℃预变性5 min;94℃变性30 s,50~55℃退火30 s,72℃延伸2 min,40循环;72℃延伸10 min,4℃保存。扩增产物于2.0%的琼脂糖凝胶电泳,电泳缓冲液为0.5×TBE,电泳电压为4 V/cm,电泳结束后在凝胶紫外成像仪上观察、拍照。
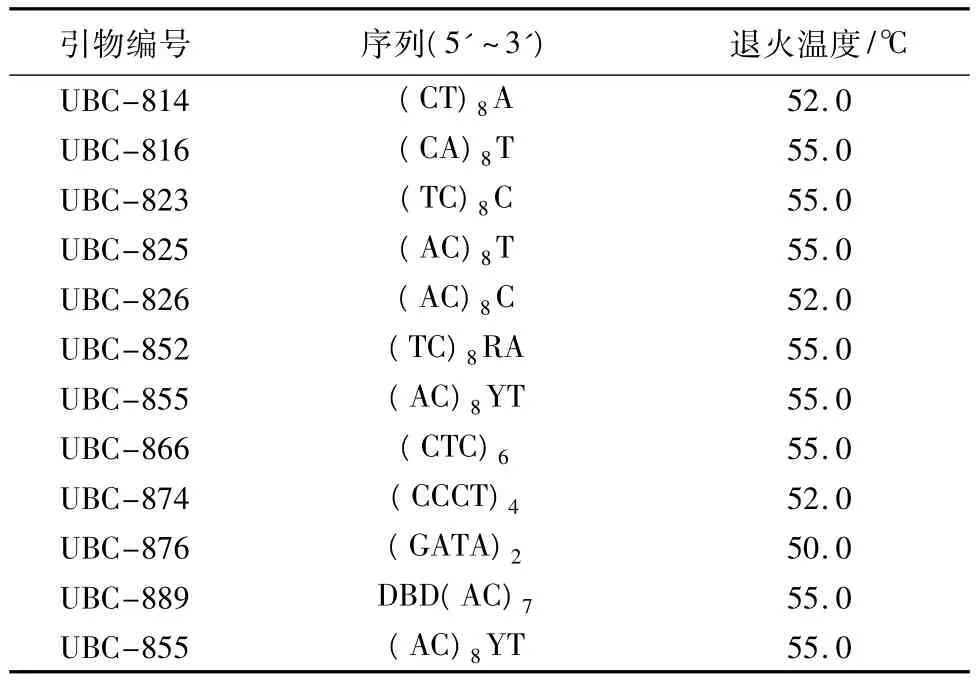
表2 用以ISSR扩增的11条引物序列及退火温度
1.3 数据统计与遗传分析
根据DNA Marker判读电泳图谱中扩增条带的分子量大小及有无,同一位点有条带的记为“1”,无条带的记为“0”。采用Excel软件对胶板样本条带进行转化,构建0/1数据矩阵。以Excel软件的数据记录为基础,利用DCFA1.1软件将ISSR谱带统计结果转换为POPGENE软件适用文件,由POPGENE32软件获得多态性位点及其百分数(PP,B)、基因的多样性(H)及Shannon信息指数(I)等遗传参数,根据POPGENE计算得到的Nei's遗传距离和遗传相似性系数,运用NTSYSpc 2.10软件进行UPGMA法聚类分析,构建59个样品亲缘关系树状聚类图。
2 结果与分析
2.1 引物扩增的多态性
用筛选出的11条ISSR引物对59个样品进行扩增,扩增结果见表3。图1为引物823和引物855对部分样品的扩增图谱。由表3可知,11条引物一共扩增出106条DNA谱带,平均每条引物扩增9.63条带。各条引物扩增的条带数为3~16不等。扩增的条带分布在300~2 600 bp之间,主要分布区间为500~1 500 bp。由扩增图谱(图1)可以直观看到,所有样品有相同的扩增位点,也有特异扩增位点,一定程度上说明所分析的油橄榄品种间的同源性,以及其遗传背景的复杂性和多样性,这些特异扩增位点也是各品种分子鉴别的依据。

图1 引物823、855对部分油橄榄样品的ISSR扩增图谱
由表3可见,106个扩增位点中有99个为多态性位点,总的多态位点百分率为93.4%。其中:UBC-814、UBC-816、UBC-826 和 UBC-874 引物扩增产物的多态位点百分率皆为100%;引物UBC-852扩增的位点数最少,多态百分率也最低,仅有66.67%。基因的多样性(H)为0.325 7;Shannon信息指数(I)为0.462 1。可见,云南永仁县油橄榄品种资源收集圃中收集的油橄榄品种资源具备了较高的遗传多样性和丰富的遗传基础,为进一步的遗传育种奠定了基础。
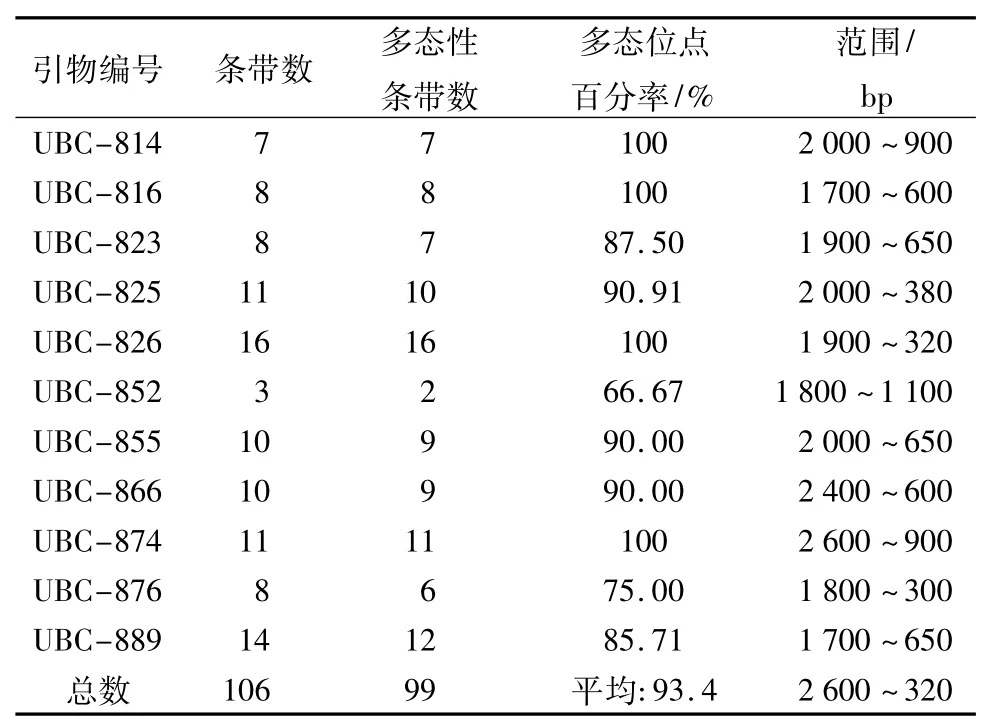
表3 11个引物对59个品种的扩增结果
2.2 UPGMA聚类结果
根据POPGENE计算得到各品种的Nei's遗传距离和遗传相似性系数,运用NTSYSpc 2.10软件进行UPGMA法聚类分析,构建59个品种亲缘关系树状聚类图(图2)。图2中以遗传距离0.171处作一结合线,可以将所有59个品种分成4个大类:第Ⅰ类有6个品种,除引种自达州的奥托卡和米扎两个引种品种外,其他4个品种皆为昆明本地选育的品种,包括3个杂交品种和1个亲本;第Ⅱ大类只有切拉姆和米扎(广元)2个品种;第Ⅲ大类由国内选育和部分引种,共24个品种组成,而且大多引种自武都;第Ⅳ大类共有27个品种,其中21个为引种品种,主要来源于希腊和广元,只有2个品种(城固31和城固32)为国内选育的品种,还有4个只知编码代号和引种来源地品种。
在遗传距离0.154处的4个大类又可以分别分成若干亚类(图2)。第Ⅰ大类可分为2个亚类Ⅰ-ⅰ和Ⅰ-ⅱ,每个亚类各包含了3个品种。第Ⅲ大类包含2个亚类:Ⅲ-ⅰ含有以国内选育品种为主的13个品种,著名的果用品种阿斯和卢克斯被聚于此亚类中;Ⅲ-ⅱ含有以引种品种为主的11个品种。第Ⅳ大类被分为3个亚类:Ⅳ-ⅰ包含直接引种于希腊的4个品种柯基、柯基优、贝翠丽-p、贝翠丽-t,以及引种自武都但原产地为法国的德坦彩;Ⅳ-ⅱ仅有莫约拉1个品种;Ⅳ-ⅲ亚类共有21个品种,其中15个为引种品种,主要来源于希腊和广元,2个是国内选育的品种(城固31和城固32);另外还含有4个未知身份的品种(M1~M4)。
2.3 亲缘关系及分子鉴定
由POPGENE计算得到各品种的Nei's遗传距离在0.1815~0.0178之间。在遗传距离小于0.050之内,豆果和豆果优、M1和M3、柯基和柯基优、贝翠丽-p和贝翠丽-t、配多灵(武)和配多灵(俞)、科拉蒂(武1)和科拉蒂(武2)、卢克斯和佛奥、杂交2号和杂交3号分别两两聚在一起,表明两两间的遗传相似性较高,很有可能分别属于同一品种,其中卢克斯和佛奥很有可能出现了同物异名;而名字相同、引种地不同的九峰(武都)和九峰(广元)、爱桑(广元)和爱桑(昆明)、米扎(广元)和米扎(达州)以及皮瓜尔(希腊)和皮瓜尔(武都)却两两分别聚在了不同的大类或亚类中,有可能出现了同名异物的现象;另外,引种自广元的M1、M2、M3和M4聚在同一个亚类当中,它们也具有较高的遗传相似性,有可能从同一品种选育或引种而来。
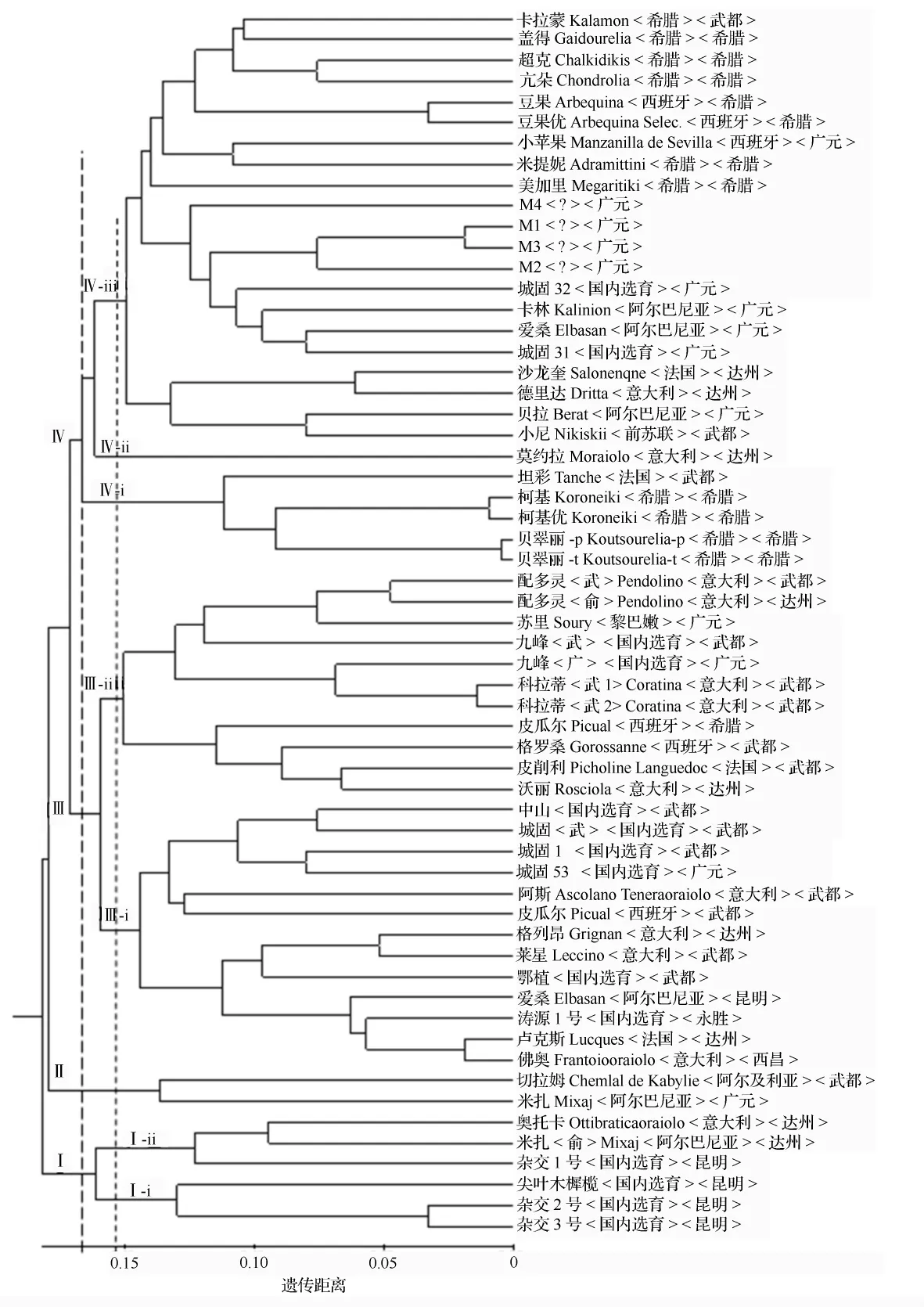
图2 59个油橄榄品种的UPGMA聚类图
3 结论与讨论
用筛选出的11条ISSR引物对59个油橄榄品种种质进行扩增,在全部106个扩增位点中有99个为多态性位点,总的多态位点百分率为93.40%,基因的多样性为0.325 7;Shannon信息指数为0.462 1。表明油橄榄品种间的多态性比较高。这可能是广泛的种质起源以及漫长的进化和长期的人工选育的结果[15],这一结果从分子水平上初步证明了油橄榄种质广泛和复杂的遗传背景。另一方面,也揭示了云南永仁县油橄榄品种资源收集圃中收集的油橄榄品种资源具备丰富的遗传基础,这些资源为进一步油橄榄种质的开发和利用提供了物质基础。
基于各品种的遗传距离,采用UPGMA法进行了59个品种的聚类,结果将59个品种聚成4个大类,其中第Ⅰ、第Ⅲ和第Ⅳ大类又分别分为若干亚类。总体上看,大多数引种品种并没有按照地理起源(原产地)而更多是依据引种材料来源地和主要用途进行聚类:著名的果用品种超克、贝拉聚于Ⅳ-ⅲ亚类中,卢克斯和阿斯聚于Ⅲ-ⅰ亚类中;84.6%的国内选育品种皆归类于第Ⅰ和第Ⅲ大类中;引种品种则聚于Ⅱ、Ⅳ大类中。可见,在漫长的人类利用油橄榄种质资源的过程中,由于广泛、复杂的引种和选育,造成以生长、经济性状、抗性等为主要目标的选择压力以及油橄榄种质间频繁的基因交流,进而导致这样的聚类结果。这一结果与Besnard等[16]、Annalida 等[17]的研究结果相似,他们的研究结果表明,由于不同地域间频繁的品种交换,导致划分的类群与其地理起源没有明显的关系,而与果实的大小和用途明显相关。
由于油橄榄的栽培历史悠久,种质资源丰富,资源引种的渠道较多,再加上长期的人工选育、管理不够完善等因素,使得品种同名异物、同物异名的现象较为严重,给生产和科研带来很多不便,从遗传本质上弄清楚所收集的种质资源情况,对于更好地规范管理和利用这些资源具有非常重要的意义。正因为如此,国外有不少关于油橄榄品种分子鉴定的研究报道。比如:Terzopoulos等[18]对意大利栽培的31个油橄榄品种进行了ISSR分析,结果表明,ISSR标记在油橄榄品种中有较高的鉴定效率,可将供试品种完全区分开;Sanz-Cortés等[19]采用AFLP技术对10个西班牙品种进行鉴定,通过相似系数分析对其命名进行了更正。本研究基于ISSR标记的聚类结果表明,在所收集的59个油橄榄种质中也存在同物异名和同名异物的现象,并进行了具体的分析。当然这只是一个方面的信息资料,如果能结合形态学特征和其他标记信息进行研究,则更能客观和科学地鉴定和分类这些种质资源,这也是下一步需要开展的工作。
[1]马亭山,马健.林添佳与他的橄榄梦[J].农业经营管理,2011,95(1):38-41.
[2]邱源,韩华柏,侯春霞,等.分子标记在油橄榄种质资源和育种研究上的应用[J].四川林业科技,2007,28(1):34-38.
[3]吴开志,肖千文,贾瑞芬,等.油橄榄品种表型性状的多样性[J].经济林研究,2008,26(2):48-52.
[4]张学宁,郭宝林,张开春.果树分子标记研究现状及发展前景[J].生物学报,2003,13(5):45-46.
[5]Belaj A,Satovic Z,Ralh L,et al.Optimal use of RAPD markers for identifying varieties in olive(OleaeuropaeaL.)germplasm collections[J].JAmer Soc Hort Sci,2004,129(2):266-270.
[6]Hagidinitriou M,Katsiotis A,Menexes G,et al.Genetic diversity of major Greek olive cultivars using molecular(AFLP and RAPDs)markers and morphorlogical traits[J].J Amer Soc Hort Sci,2005,130(2):211-217.
[7]Owen C A,Bita E C,Banilas G,et al.AFLP revealed structural detail of genetic diversity within cultivated olive germplasm from the Eastern Mediterranean[J].Theor Appl Genet,2005,110(7):1169-1176.
[8]Montemurro C,Sineone R,Pasqualone A,et al.Genetic relationships and cultivar identification among112 olive accessions using AFLP and SSR markers[J].Hort Sciences,2005,80(1):105-110.
[9]Bemard R,Manzo M,Durante M,et al.Molecular markers for cultivar characterization inOleaeuropaea[J].Acta Horticulturae,2002,586:97-100.
[10]姜成英,戚登臣,苏瑾.甘肃省油橄榄生产现状与发展对策[J].经济林研究,2006,24(2):78-81.
[11]邱源,韩华柏,李俊强.23个油橄榄品种的RAPD分析[J].林业科学,2008,44(1):85-59.
[12]马万里,Collins G.运用RAPD技术鉴定澳大利亚油橄榄品种的研究[J].内蒙古师范大学学报:自然科学汉文版,2006,35(3):337-339.
[13]Zietkiewicz E,Rafalski A,Labuda-Genomics D.Genomic fingerprinting by simple sequence repeat(SSR)-anchored polymorase chain reaction amplification[J].Genomics,1994,20(1):176-183.
[14]李瑞,陈少瑜,宁德鲁,等.油橄榄ISSR-PCR反应体系优化与引物筛选[J].安徽农业科学,2012(10):5797-5799.
[15]Martins-Lopes P,Lima-Brito J,Gomes S,et al.RAPD and ISSR molecular markers inOleaeuropaeaL.:Genetic variability and molecular cultivar identification[J].Genetic Resources and Crop Evolution,2007,54(1):117-128.
[16]Besnard G,Breton C,Baradat P,et al.Cultivar identification in olive based on RAPDmarkers[J].JAmer Soc Hort Sci,2002,126(5):668-675.
[17]Rotondi A,Magli M,Ricciolini C,et al.Morphological and molecular analyses for the characterization of a group of Italy olive cultivars[J].Euphytica,2003,132(2):129-137.
[18]Terzopoulos P J,B Kolano,Bebeli P J,et al.Identification ofOlea europaeaL.cultivars using inter-simple sequence repeat markers[J].Scientia Horticlturae,2005,105(1):45-51.
[19]Sanz-Cortés F,Parfitt D E,Remero C,et al.Intraspecific olive diversity assessed with AFLP[J].Plant Breeding,2003,122(2):173-178.
