PRRSV经典株与变异株RT-PCR鉴别方法的建立及应用
2013-08-08俞建萍翁燕梅刘昌林
俞建萍 翁燕梅 刘昌林
(1.福州大北农生物技术有限公司 福州 350014;2.南昌市农业科学院 南昌 330006)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS),又称“猪无名高热病”、“猪高热综合征”、“猪高热征”,是20 世纪80年代末发现的一种传染性疾病,能引起妊娠母猪的流产、死胎、木乃伊胎等生殖障碍,以及各种年龄猪(特别是仔猪)的呼吸道疾病[1],具有传播速度快、流行范围广、感染发病率高、治疗效果较差、经济损失大等特点。该病于1987年初次暴发于美国[2-3]。随后短短几年时间内,迅速遍及全球各养猪业发达的国家和地区(北美洲,1987;欧洲,1990;亚洲,1991)[1-5]。国内1996年郭宝清等[6]首次分离到PRRSV,并命名为CH-1a,从而证实该病存在于我国。现在几乎所有的养猪国家都流行PRRSV[7-8]。试验通过高致病性猪繁殖与呼吸综合征病毒(PRRSV)Nsp2 基因的缺失信息,设计3条特异性引物,并优化各种条件,建立了一种能够鉴别诊断高致病性PRRSV和经典PRRSV的RT-PCR 方法,能够准确、快速地对养殖场提供PRRS 诊断,具有临床实用性。
1 材料与方法
1.1 病料来源 PRRSV 临床疑似病料均由江西农业大学兽医院提供,为病死猪的肺、淋巴结和肝脏等组织。
1.2 分子生物学试剂及主要药品 PCR 扩增试剂盒、RNA 反转录试剂盒、Trizol、100 bpDNA Marker均购自上海生工生物工程技术服务有限公司,RNA提取试剂盒购自OMEGA 公司,氯仿、无水乙醇、异丙醇、醋酸钠等其他试剂均为分析纯试剂。
1.3 引物合成设计 根据高致病性猪繁殖与呼吸综合征病毒(PRRSV)Nsp2 基因的缺失信息,设计了3条(两对)特异性引物(由上海生工合成):P1-P3 引物对既能扩增PRRSV 经典株又能扩增PRRSV 变异株;P2-P3 引物只能扩增PRRSV 变异株。
P1:TGTCCCAGCTCAGCGCAGCAAGC(上游引物);
P2:GCCGTAGAACTGTGACAACAACG(上游引物);
P3:CACAGGGAGCTGCTTGATGACAC(下游引物)。
1.4 方 法
1.4.1 病毒RNA的提取 将病死猪的肾脏、脾脏、淋巴结各取少量放入装有PBS的玻璃匀浆器中进行磨碎,4 ℃,12 000 r/min 离心,弃上清,然后根据RNA 提取试剂盒说明书进行操作提取RAN,最后加40μL DEPC 水溶解RNA,55~60 ℃温育10 min,-80 ℃保存备用或立即使用。
1.4.2 RT-PCR 反应
1.4.2.1 反转录体系(体积为20μL) 见表1。

表1 反转录体系表
按以上顺序将上述反应液依次加入到EP 管中,轻轻混匀。
1.4.2.2 反转录条件 42 ℃孵育30 min,85 ℃加热5 min 失活TransScript RI,共一个循环,反应在PCR 扩增仪上进行。合成的cDNA 立即使用或-20 ℃保存备用。
1.4.2.3 PCR 反应组成(体积为50μL)见表2。
按表中顺序将反应液依次加入到PCR 反应管中,轻轻混匀。
1.4.2.4 反应条件 94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;最后一个循环结束后72 ℃延伸10 min。PCR 产物立即使用或4 ℃保存。
1.4.2.5 电泳条件 取8μL RT-PCR 扩增产物与少许上样缓冲液充分混合,在80 伏电压、40 毫安条件下电泳40 min 左右,于1.5%琼脂糖凝胶上进行电泳然后在紫外线灯下观察结果并拍照。
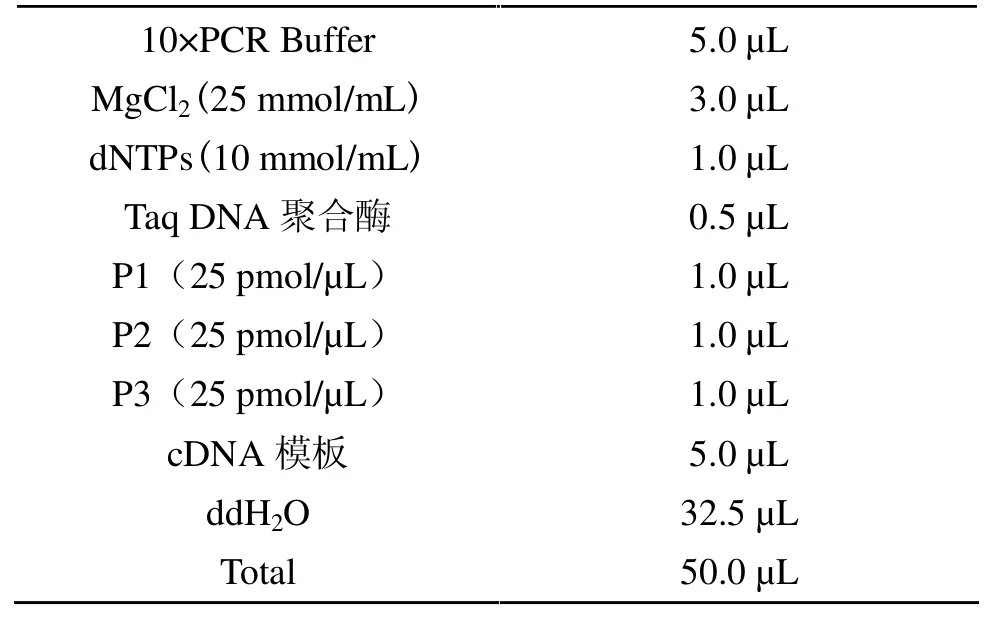
表2 PCR 反应体系
2 结 果
2.1 扩增结果检测 如图1 所示,PCR 扩增出的PRRS 经典株目的基因大小529 bp 与预期大小相符,PRRS 变异株目的基因大小218 bp 与预期相符。
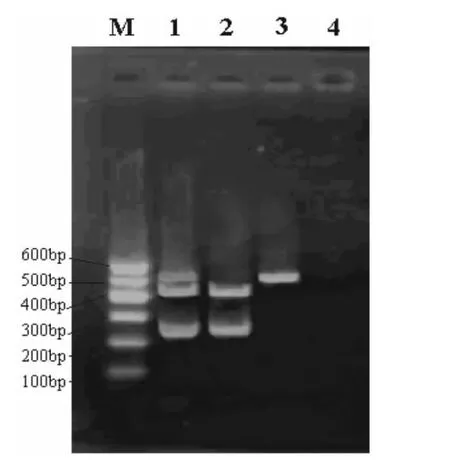
图1 PRRSV的PCR 扩增结果
2.2 扩增片段的特异性鉴定 PCR 产物纯化后送上海生工生物工程技术服务有限公司进行测序,对所测序列进行同源性分析,由引物P1、P3 扩增的529 bp 左右基因序列与GenBank 中已发表的PRRSV 经典株核酸序列同源性在93%以上;由引物P1、P3 扩增的439 bp 左右基因序列与GenBank 中已发表的高致病性PRRSV 核酸序列同源性在94%以上;由引物P2、P3 扩增的218 bp 左右基因序列与GenBank 中已发表的高致病性PRRSV 核酸序列同源性在94%以上。结果提示本试验产物具有良好的特异性,该方法进行临床组织病料中高致病性PRRSV和经典PRRSV的检测是可行的。
2.3 临床病料中的检测结果 283 份猪“猪高热病”病料,分别收集于2009年2月份到2009年12月份,来自于南昌、宜春、九江、新余、吉安等地区的发病猪场(病料的具体情况见表3)。
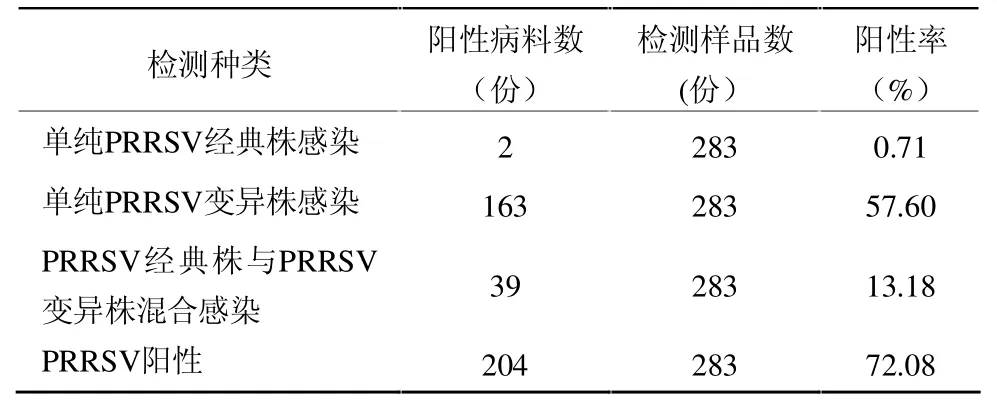
表3 283 份病料基本情况
从表3 中可以看出,感染的阳性病料主要为单纯PRRSV 变异株感染,共计163 份,占病料总数的57.60%。
2.4 部分病料检测的电泳图 部分病料检测电泳结果如图2和图3 所示。
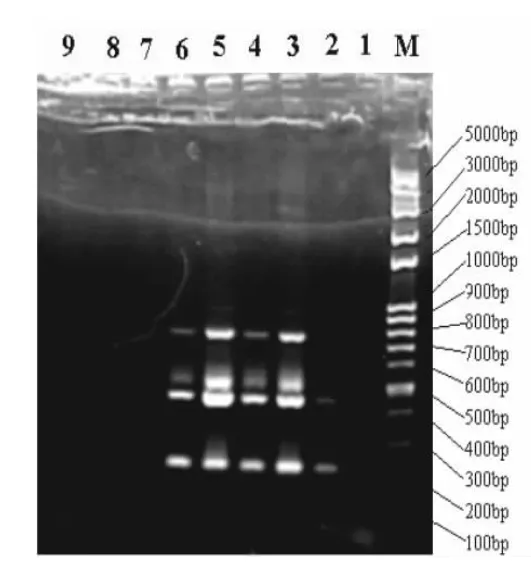
图2 部分病料检测的电泳图
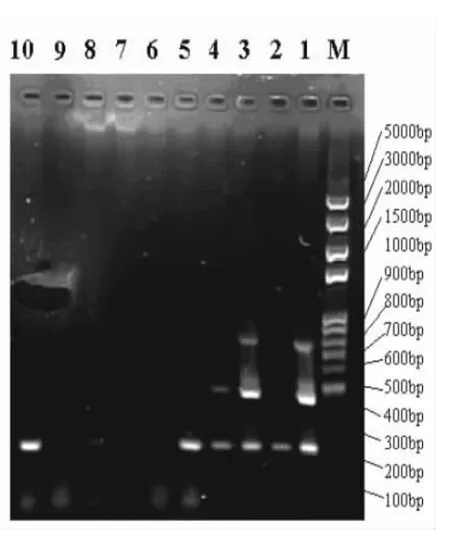
图3 部分病料检测的电泳图
3 讨论
用于PRRSV 诊断的方法主要有病毒的分离法、血清学方法(IFA、ELISA、IPMA、SN)和RT-PCR等方法[9]。血清学方法中IFA和ELISA 方法应用较广泛,IFA 方法需要荧光显微镜且结果通过肉眼观察,有一定的主观性;ELISA 主要用于检测抗体,血清学方法不能区分高致病性PRRSV和经典PRRSV;病毒分离法是一种传统的检测方法,但病毒分离所需时间长,因此,病毒分离法不适合用于该病的快速诊断。
本试验对几十株PRRSV 经典毒株和变异毒株的Nsp2 基因序列进行分析,根据PRRSV Nsp2 基因的缺失信息,设计了3条特异性引物,通过对PCR 体系中引物、dNTP 浓度、Mg2+浓度以及温度、时间以及循环次数等条件进行优化,建立了能够鉴别诊断高致性PRRSV和经典PRRSV的RT-PCR 方法。
近年来,部分省市和地区的生猪在高温季节都不同程度地发生“猪高热病”,该病特征是体温升高至41 ℃以上,呈稽留热,厌食、倦怠、皮肤发红、呼吸急促等。多数病程长达7 d 以上,或反复发作,发病率和死亡率都较高,给猪养殖业造成较大经济损失。为预防和控制该疾病的再次流行,保障养猪业持续健康发展,有必要了解临床病例中PRRSV 经典株和PRRSV 变异株的感染情况。从表3 中可以看出,在283 份病料中有204 份结果为PRRSV 阳性,阳性率72.08%。单纯PRRSV 变异株感染163 份,占57.60%;PRRSV 经典株与PRRSV 变异株混合感染39 份,占13.18%;单纯PRRSV 经典株感染仅为2 份,仅占0.71%。由此说明目前主要流行的还是高致病性PRRSV,PRRSV 变异株阳性率很高,可能与该病毒在猪群中的持续感染特性有关。感染中存在部分PRRSV 经典株与PRRSV 变异株混合感染,但是单纯的PRRSV 经典株感染情况却极其少,然而由于不能鉴定疫病中PRRSV 经典株到底是野毒感染还是疫苗株,因此,不能推测出PRRSV 经典株在“高热病”中的致病地位。通过对临床样品的检测表明该方法能够准确地诊断高致病性PRRSV,且具有快速、敏感和特异的特点,具有临床实用性。
[1]Goyal S M.Porcine reproductive and respiratory syndrome[J].J Vet Diagn Invest,1993(5):656-664.
[2]Dea S,Bilodeau R,Sauvageau R,et al.Virus isolation from farms in Quebecexperiencing severeoutbreaks of respiratory and reproductive problems[C].Denver,Colo,1991:67-72.
[3]White W.Blue ear disease of pigs[J].Vet Res,1991,128:574.
[4]Loula T.Mystery pig disease[J].Agri-practice,1991,12:23-24.
[5]杨汉春,管山红,尹晓敏,等.猪繁殖与呼吸综合征病毒的分离与初步鉴定[J].中国兽医杂志,1997,23(10):9-10.
[6]郭宝清,陈章水.应用间接免疫荧光法从国内生殖障碍猪群中检测生殖和呼吸综合征阳性抗体的研究[J].中国预防兽医学报,1999,21(6):427-429.
[7]Wensvoort G,Terpstra C,Pol J,et al.Mystery swine disease in the Netherlands:the isolation of Lelystad virus[J].J Vet Q,1991,13:121-130.
[8]Collins J E,Benfield D A,Christianson W T,et al.Isolation of swine infertility and respiratory syndrome virus(isolate ATCC VR -2332)in North America and experimental reproduction of disease in gnotobiotic pigs[J].J Vet Diag Invest,1992(4):117-126.
[9]Jusa E R,Inaba Y,Kouno M,et a1.Slow-reaction and complement requiring neutralizing antibody in swine infected with porcine reproductive and respiratory syndrome(PRRS)virus[J].J Vet Med Sci,1996,58:749-753.
